Презентація на тему:
ОСНОВНІ ПРИНЦИПИ КЛІНІЧНОГО ДОСЛІДЖЕННЯ ЛІКАРСЬКИХ ЗАСОБІВ
Завантажити презентацію
ОСНОВНІ ПРИНЦИПИ КЛІНІЧНОГО ДОСЛІДЖЕННЯ ЛІКАРСЬКИХ ЗАСОБІВ
Завантажити презентаціюПрезентація по слайдам:
ОСНОВНІ ПРИНЦИПИ КЛІНІЧНОГО ДОСЛІДЖЕННЯ ЛІКАРСЬКИХ ЗАСОБІВ Клінічні випробування – “ретельно і етично підготовлений експеримент з метою відповіді на точно поставлене запитання” Hill, 1951
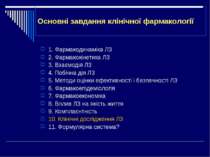
Основні завдання клінічної фармакології 1. Фармакодинаміка ЛЗ 2. Фармакокінетика ЛЗ 3. Взаємодія ЛЗ 4. Побічна дія ЛЗ 5. Методи оцінки ефективності і безпечності ЛЗ 6. Фармакоепідеміологія 7. Фармакоекономіка 8. Вплив ЛЗ на якість життя 9. Комплаєнтність 10. Клінічні дослідження ЛЗ 11. Формулярна система?
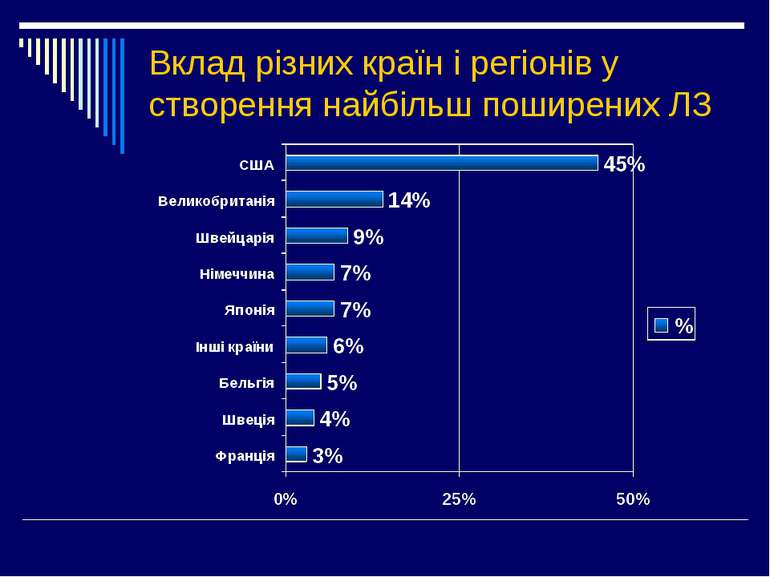
В Україні зареєстровано більше 9000 ЛЗ, а загальна кількість препаратів і різноманітних комбінацій у різних країнах – більше 200 000. Особливо швидко зростає кількість ЛЗ в останні роки Ще 20-30 років тому 60-80% ЛЗ, які використовуються у даний час ще не були відомі або не використовувались Щорічно список ЛЗ поповнюється на 200-300 назв Щорічна продажа ліків у світі складає 207 млрд. 506 млн. доларів і щорічним зростанням приблизно на 10%.
У зв'язку з таким значним розширенням ринку ЛЗ проблема їх раціонального використання в останні роки набуває все більшої уваги. Це привело до появи суміжних з клінічною фармакологією дисциплін, таких як фармацевтична медицина, яка вивчає процеси створення, вивчення, виробництва і широкого використання ЛЗ
Історичний аспект Перше дослідження, яке можна назвати клінічним, описане у роботі J.Ling “Трактат про цингу” (1753 р). “Я взяв дванадцять пацієнтів з цингою, які знаходились на борту нашого корабля, коли ми були далеко від берега. Я старався вибрати подібні випадки, наскільки це було можливо.... Я положив їх в одному місці... Всі вони знаходились на однаковій дієті. Двом з них я призначив по кварті сидру в день. Двоє інших приймали по двадцять п'ять крапель купоросу. Двоє інших отримували по дві ложки оцту. Двом я призначив курс морської води. Ще двоє отримували по два апельсини і по одному лимону щодня. Двоє інших отримували мускатний горіх. Найшвидший і видимий хороший ефект був отриманий при використанні апельсинів і лимонів, і один з тих, хто їх приймав, через 6 днів був готовий до служби. Інші продовжували хворіти і потребували нагляду.” Так в середині XVIII століття відбувалась апробація методів лікування хворих.
Історичний аспект (систематизація і математична обробка) На початку ХХ століття R.A. Fisher ввів принципи рандомізації у сільськогосподарських дослідженнях, а у 1931 році їх вперше застосували в клінічному дослідженні хворих на туберкульоз. Підбір хворих для контрольної і досліджуваної груп здійснювали підкиданням монети. Таким чином розподілили по 12 пацієнтів в кожну групу. Це дослідження вводило також поняття “сліпого” і “маскованого” дослідження. Пацієнта мне говорили, яку внутрішньовенну ін'єкцію вони отримували: це був препарат sanocrysin чи фізіологічний розчин.
Історичний аспект (етичні проблеми) Перший міжнародний кодекс етики був, що відносився до медичних експериментів з участю людей, був створений після того, як були виявлені злочини німецьких лікарів – воєнні кримінальні дослідження, засуджені Нюрнберзьким трибуналом у 1947 році. Нюрнберзький кодекс, виданий у 1947 році, ліг в основу стандартів проведення випробувань з участю людей, підкреслюючи їх добровільну згоду. У 1964 р. Медичною асоціацією була прийнята Гельсінська декларація, яку було доповнено у Токіо (1975), Венеції (1983), Гонконгу (1989) і у Сомерсет Уесті (1996). Декларація включає вимоги найширшого спектру до лікарів, які беруть участь в експериментах і клінічних дослідженнях. У 1966 році Генеральна Асамблея ООН схвалила Міжнародну конвенцію з громадянських і політичних прав, яка вступила в силу у 1976 році. Стаття 7 цього документу гласить .... Ніхто не повинен піддіватися медичним чи науковим експериментам з примусу.
Історичний аспект (якість досліджень) У 1937 р. Компанія M.E. Massengill вирішила випускати рідку форму сульфаніламідного препрату для дітей. Оскільки сульфаніламіди погано розчинні в звичайних розчинниках, з цією метою використовували різні речовини, з яких найбільш підходящим виявився диетиленгліколь. Було почато виробництво лікарської форми, до складу якої входили активна речовина, розчинник, вода і смакові добавки. Токсичність на тваринах не вивчалася. Дослідники обмежилися оцінкою органолептичних властивостей нової мікстури. Досліджень в клініці також не проводили. В жовтні 1937 року з Оклагоми в Food and Drug Administration (FDA - регуляторний орган США) поступило повідомлення про смерть 8 дітей і 1 дорослого пацієнта після прийому препарату. Компанія M.Е.Massengill розіслала 1100 телеграм, було дано попередження по радіо і в газетах, піднято на ноги всі 239 інспекторів FDA і місцева поліція. Був організований пошук покупців за адресами на рецептах. В найкоротші терміни препарат був вилучений з продажу, проте продана мікстура спричинила смерть 107 чоловік, в основному дітей. Ця трагедія розбурхала громадськість і уряд США. В 1938 року Конгрес прийняв закон про харчові продукти, ліки і косметичні засоби. Відповідно до нього ані один препарат або лікарська форма не може здійснювати продажу без дозволу FDA. Цей закон діє й досі.
Історичний аспект (якість досліджень) Найстрашніша трагедія в історії сучасної лікарської терапії розігралася в 1959-1961 роках при застосуванні нового лікарського засобу талідоміду. У ФРН, а потім в деяких інших країнах, виник спалах фокомелії («тюленячі кінцівки») - природженої аномалії розвитку, при якій виявляються дефекти трубчастих кісток кінцівок і формуються анормальні або рудиментарні кисті і стопи, розташовані близько до тулуба, як у тюленів. Одночасно можуть виникати і інші вади розвитку. Спонтанно фокомелія розвивається украй рідко. Ретроспективні дослідження продемонстрували зв'язок між прийомом талідоміду під час вагітності і народженням дітей з аномаліями розвитку, але ці дані здалися недостатньо переконливими. Були організовані проспективні спостереження за вагітними, що приймали талідомід. Траплялося гірше - багато дітей, народжених з фокомелією, померли, але багато хто живуть з деформаціями кінцівок, очей, вушних раковин, серця. У ФРН було зареєстровано 10000 дітей з деформаціями кінцівок, з яких 5000 вижили. Всього в світі налічується близько 10000 таких хворих. Катастрофа з талідомідом показала, що виробництво і застосування лікарських засобів повинне знаходитися під строгим державним контролем. Вивчення ефективності і безпеки нових лікарських засобів повинно проходити стандартизовано і неупереджено і ґрунтуватися на об'єктивних спостереженнях, а не на особистій думці окремих, хай навіть ведучих в своїй області, фахівців. При цьому процедура клінічних випробувань повинна бути гуманною. Талідомід став суворим уроком для людства, що примусив постійно думати про проблеми створення ліків, їхнього дослідження і застосування
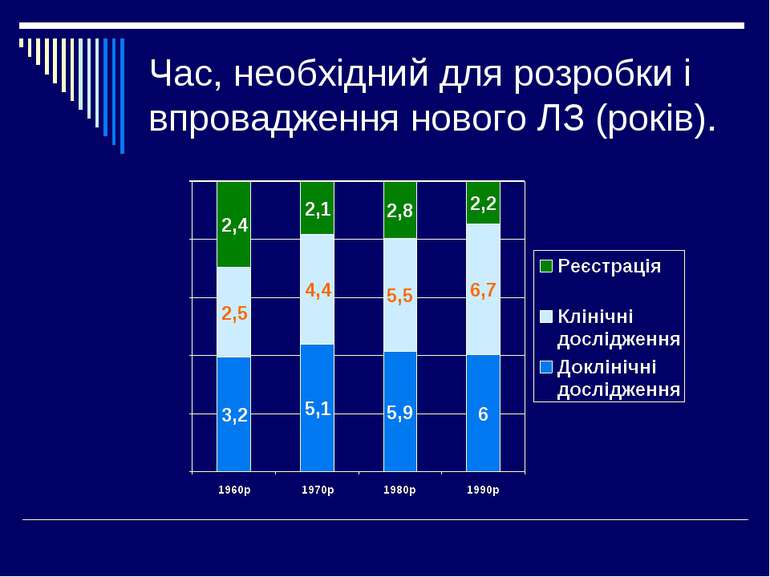
В 60-і роки в багатьох країнах Європи були ухвалені закони, згідно яких встановлювався обов'язковий державний контроль за продажем лікарських засобів. Тим часом в США під егідою FDA був розроблений і ухвалений закон, що безпосередньо визначав правила проведення клінічних випробувань медичних препаратів. Цей процес почався і в країнах Європи, де на підставі вже існуючих національних вимог до якості лікарських препаратів і принципів Гельсинкської декларації Всесвітньої медичної асоціації (1964 р.) сформувалися і були закріплені законодавчо правила проведення клінічних випробувань. В 70-і роки в США проводився аудит ряду дослідницьких центрів, де перевірялася документація і ведення записів випробувань нових лікарських препаратів. В ході перевірок було виявлено декілька випадків явних порушень. Прикладом таких порушень служать наступні випадки. Представлялися дані пацієнтів, яких включили в дослідження. При перевірці виявилося, що ці пацієнти померли (природною смертю) ще до початку дослідження. Лабораторні тести на тваринах проводилися до того, як вони (тварини) були куплені. У зв'язку з виявленими порушеннями, FDA в 1977 року перша запропонувала правила, які визначали обов'язки дослідників і спонсорів, які незабаром упровадили в практику. Розроблену систему назвали - GCP - Good Clinical Practice. При недотриманні правиш GCP американських дослідників дискваліфікували і усували від подальшої участі в дослідженнях лікарських засобів. До компаній-спонсорів застосовувалися ще більш жорсткі санкції, ніж до дослідників, не дивлячись на те, погоджувалися або ні компанії з висунутими вимогами.
Другий етап упровадження GCP в США зробив FDA, коли з властивою йому традиційною ґрунтовністю ввів систему контролю і інспекції дослідників, спонсорів і етичних комітетів закладів, де проводились дослідження. Протягом 1986-1990 рр. низка європейських країн (Великобританія, Ірландія, Німеччина Франція, Іспанія) прийняли свої правила проведення клінічних випробувань. Правила клінічних випробувань з посиланням на GCP були ухвалені також в Австралії і Японії. Регуляторні органи кожної країни стали вимагати дані по ефективності і безпеці для реєстрації препарату і дозволу на його медичне застосування. Вони встановлювали схожі принципи, але мали розбіжності в підходах. В Україні впровадження принципів GCP почалось у 1995 році. У складі Фармакологічного комітету (зараз Фармцентру) МОЗ України було створено підрозділ, який займається питанням клінічних досліджень ЛЗ. Розроблені методичні рекомендації (1995, 1999) з клінічних досліджень ЛЗ, прийнятий наказ МОЗ України N 281 від 01.11.2000 р. “Про затвердження Інструкції про проведення клінічних випробувань лікарських засобів та експертизи матеріалів клінічних випробувань та Типового положення про комісію з питань етики”.
Найбільш повно регламентація процесів виробництва і використання ЛЗ відображена у 3-ох кодексах: GLP - good laboratory practice - якісні лабораторні дослідження (або практика) - передбачає ретельне вивчення нового препарату на різних тваринах з їхнім сучасним якісним обстеженням для виключення несподіваних несприятливих наслідків при застосуванні препарату у людей. GCP - good clinical practice - якісні клінічні дослідження (або практика) - включає основні принципи і вимоги до організації цих досліджень, що гарантують надійність і достовірність отриманих даних і забезпечуючи захист прав людини. GMP - good manufacturing practice - якісне виробництво, що забезпечує випуск ліків, відповідних затвердженим державним органом стандартам.
З часу досліджень Франсуа Мажанді і його учня Клода Бернара, які поклали початок розвитку експериментальної фізіології фармакології, пройшло більше 150 років. Проте досягнення базисної фармакології не перешкодили просуванню на ринок під тиском виробників, практично неефективних «патентованих ліків», а також упровадженню в клінічну свідомість і повсякденну медичну практику багатьох помилкових положень, що здавалися істинами у кінцевої інстанції. J. Geerling писав, що ще близько 50 років назад лікування пацієнтів медикаментами нерідко ґрунтувалося на вірі і випадкових спостереженнях виживання, традиції і неперевірених вказівках вчителів. Існувала система, яка ставила в центр ухвалення рішень думку авторитету.
Відомо, що одужання хворих при ряді захворювань відбувається спонтанно і без застосування яких-небудь ліків. Прогноз і результати лікування окремих хворих невизначені, а тому повинні оцінюватися на підставі минулого досвіду спостереження за групами подібних пацієнтів. Хворі часто не спостерігаються у віддаленому періоді, не приймається до уваги так званий природний перебіг хвороби.
Клінічне дослідження важко віднести до «чистого експерименту». Об'єктом вивчення є пацієнт, який може мати різне відношення як до передбачуваного лікування, так і до лікаря. Експериментатор-лікар володіє не тільки різним професійним досвідом і знаннями, але і сприймається хворим як особистість, що має у ряді випадків як сано-, так і патогенний вплив. Цим можна пояснити, чому в клінічних дослідженнях завжди закладена небезпека систематичних помилок - упередженість і широка варіація терапевтичних відповідей. Тому лікування ми визначаємо як мистецтво застосування сучасних, науково доведених даних у процесі індивідуального спілкування з пацієнтом для досягнення оптимального (біологічного, психологічного і соціального) терапевтичного результату. 1948 рік, коли були опубліковані перші результати дослідження ефективності стрептоміцину для лікування туберкульозу, при якому розділення пацієнтів по групах було випадковим (рандомізованим) з використанням таблиці випадкових чисел, можна вважати датою народження доказової медицини.
З того часу почалося широке застосування контрольованих клінічних випробувань (ККВ; control clinical trials) рандомізованих контрольованих випробувань (РКВ; randomized controlled trials) і інших методів, що передбачають використання досягнень медичної статистики. Подібні дослідження дуже складні по механіці свого здійснення, вони вимагають величезних витрат, а також залучення великої кількості фахівців.
Клінічне дослідження (випробування) - це систематичне вивчення на людях (здорових або хворих) нових лікарських засобів з метою виявлення або підтвердження основних фармакологічних і побічних ефектів, а також визначення параметрів фармакокінетики.
Основні вимоги, що визначають адекватність проведення дослідження Порівняння кінцевих результатів повинно бути проведено в двох групах пацієнтів: контрольна група (лікування не проводиться; проводиться стандартне, традиційне лікування; пацієнти одержують плацебо); група активного лікування (проводиться лікування, ефективність якого досліджується). Групи пацієнтів повинні бути співставимі і однорідні, принаймні, по наступних показниках: клінічні особливості захворювання і супутня патологія; вік, стать, расова приналежність. Групи пацієнтів повинні бути репрезентативні: кількість пацієнтів в кожній групі повинна вистачати для отримання статистично достовірних результатів. Розподіл пацієнтів по групах повинен відбуватися випадковим чином (рандомізація). При оцінці результатів повинен бути виключений суб'єктивний чинник. Для цього використовують декілька типів досліджень: просте сліпе (про приналежність до певної групи не знає пацієнт); подвійне сліпе (про приналежність до певної групи не знають пацієнт і лікуючий лікар); потрійне сліпе (про приналежність до певної групи не знають пацієнт, лікуючий лікар і організатор випробування). Повинні бути використані об'єктивні критерії кінцевих результатів: смертність від даного захворювання; загальна смертність; частота розвитку «значних» ускладнень, особливо небезпечних для життя і тих, що можуть привести до інвалідності; частота повторних госпіталізацій;
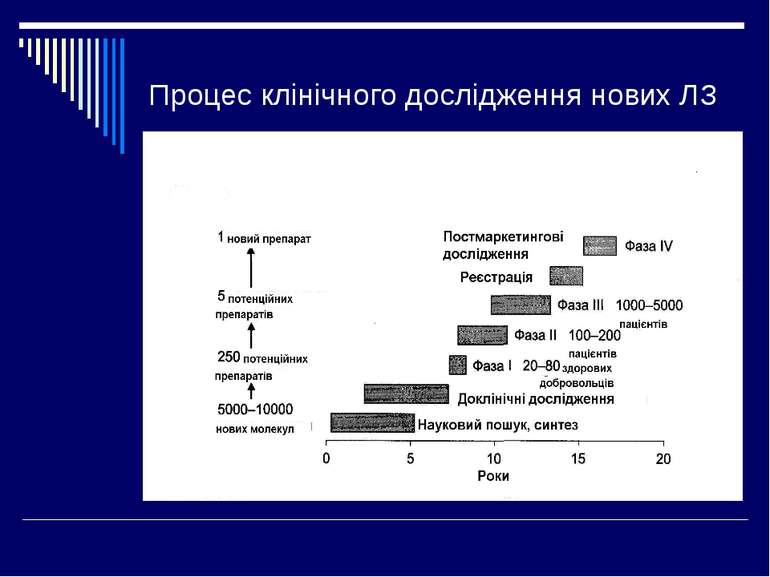
Фази клінічних досліджень І – клініко-фармакологічні дослідження ІІ – пілотні і контрольовані дослідження ІІІ – розширені клінічні дослідження IV – постреєстраційні дослідження
I фаза клінічних випробувань - випробування, яке проводиться з метою попередньої оцінки безпечності досліджуваного лікарського засобу, а також визначення попередньої схеми дозування шляхом дослідження фармакокінетики та фармакодинаміки на пацієнтах (добровольцях) та/або здорових добровольцях. Тривалість біля 1,5 роки, кількість досліджуваних – від 10 до 100.
Завданням І фази є оцінка переносимості препарату, встановлення наявності у нього терапевтичної дії і створення раціональної основи для вибору доз і схем застосування. Дослідження проводять на обмеженій кількості добровольців(5-10 осіб). Фармакокінетику вивчають після введення однієї дози ЛЗ, а потім при багаторазовому використанні. Після отримання розрахункових фармакокінетичних параметрів (період напіввиведення, AUC, обєм розподілу, загальний і нирковий кліренс) вивчають лінійність фармакокінетики при введенні різних доз препарату, вплив прийому їжі на фармакокінетику ЛЗ, якщо вони застосовуються перорально. Фармакодинамічне дослідження в фазі І включають вивчення взаємозвязку між дозою і ефектом препарату, встановлення тривалоті дії, найбільшої переносимої та найменшої ефективної дози. Всі дослідження в фазі І сумлінно моніторуються для виявлення небажаних реакцій. Якщо на доклінічному етапі і дослідженнях на здорових добровольцях доказана безпечність нового ЛЗ, то вже у фазі І можуть проводитись дослідження фармакокінетики і безпеки препарату на спеціальній популяції хворих, наприклад з порушенням функції нирок і печінки.
II фаза клінічних випробувань - випробування лікарського засобу з метою встановлення терапевтичної ефективності та короткочасної безпечності у досліджуваних відповідного профілю, вивчення фармакокінетики, а також визначення оптимальних терапевтичних доз, режиму введення, залежності ефекту від дози. Тривалість біля 2-ох років. Кількість досліджуваних – від 50 до 500.
Фаза II - пілотні і контрольовані дослідження Ціль фази II - показати ефективність і безпечність ЛЗ на певному контингенті хворих, що включає 100-200 чоловік, і встановити оптимальні режими дозування. Фаза II включає 2 виду клінічних досліджень: - пілотні дослідження (фаза ІІа); - контрольовані дослідження (фаза ІІв). Пілотні дослідження проводяться з метою пошуку додаткових фармакологічних властивостей ЛС у хворих. Проведення цих досліджень дозволяє продемонструвати потенційну ефективність нового препарату для того, щоб вирішити питання про доцільність його подальшої розробки і провадження подальших більш вартісних досліджень. В ході цих досліджень виявляється необхідність подальших контрольованих досліджень в цьому напрямі. Найбільше значення для фази II клінічних досліджень мають контрольовані дослідження. Контрольовані дослідження передбачають наявність контролю або контрольної групи (контроль початкового стану, плацебо-контроль, активний контроль), що дозволяє уникнути погрішностей пов'язаних з впливом різних залежних або незалежних чинників на результати лікування. Цілі контрольованих досліджень різні, і часто вони носять порівняльний характер: порівняння ефективності і переносимості з іншими препаратами, порівняння ефективності різних доз ЛС, порівняння переносимості і якості життя і ін. Як препарат порівняння може використовуватися плацебо або інший ЛЗ, а також різні дози одного препарату. Для порівняння використовуються мінімум 2 групи хворих: досліджувана і контрольна. Учасники експерименту в обох групах не повинні розрізнятися по статі, віку, важкості захворювання і інших чинниках, що досягається за допомогою методу рандомізації. Рандомізація (randomization) - призначення досліджуваних в групи методом випадкової вибірки. Рандомізація є основою статистичного порівняння груп.
Фаза II - пілотні і контрольовані дослідження Контрольовані дослідження можуть бути відкритими і сліпими. Найбільш часто на практиці проводять відкрите дослідження, при якому лікарю і хворому відомий спосіб лікування (досліджуваний препарат або препарат порівняння). Сліпе дослідження може здійснюватися двома способами: - просте сліпе дослідження; - подвійне сліпе дослідження. В першому випадку тільки хворий не знає, який ЛЗ він приймає, в другому - про це не обізнаний ані хворий, ані лікар, а тільки замовник дослідження. Застосування сліпих методів дослідження підвищує достовірність результатів у зв'язку з усуненням впливу суб'єктивних чинників. Для оцінки ефективності для кожної групи ЛЗ наперед визначаються обов'язкові і додаткові критерії оцінки ефективності, які можуть бути: - клінічними; - лабораторними; - інструментальними; - морфологічними і ін.
III фаза клінічних випробувань - випробування лікарського засобу з метою підтвердження терапевтичної ефективності, безпечності та встановлення віддалених ефектів, включаючи побічні реакції. Тривалість від 1 до 2-ох років. Кількість досліджуваних – декілька тисяч.
Фаза III - розширені клінічні дослідження Головна ціль розширених клінічних досліджень - отримати додаткову інформацію про ефективність і безпечність нових ЛЗ у хворих в умовах, максимально наближених до клінічної практики. В ході цих досліджень вивчаються особливості дії препарату у хворих з супутніми захворюваннями, порушеннями кровообігу, функції печінки і нирок, оцінюються терапевтичні переваги, вплив на якість життя, виявляються побічні реакції, що зустрічаються відносно рідко і особливості взаємодії нового препарату з іншими ЛЗ, а також вивчаються фармакоекономічні аспекти. Клінічні дослідження фази ІІІ включають крупні, іноді багатоцентрові, контрольовані і неконтрольовані дослідження на сотнях і навіть тисячах пацієнтів в різних популяціях не тільки в стаціонарі, але і в амбулаторних умовах. Фаза III клінічних досліджень завершується представленням препарату на реєстрацію, у зв'язку з чим вона ділиться на дві підфази: - фаза ІІІа охоплює період до представлення заявки на реєстрацію; - фаза ІІІв - період з моменту подачі заявки на реєстрацію і до остаточної реєстрації препарату.
Фаза III - розширені клінічні дослідження Звіт про результати клінічних досліджень нового ЛЗ оформляється відповідно до вимог Фармакологічного центру МОЗ України і представляється з конкретними рекомендаціями. Рекомендація до клінічного застосування вважається обґрунтованою, якщо новий препарат: - більш ефективний, ніж відомі препарати аналогічної дії; - володіє кращою переносимістю, ніж відомі препарати (при однаковій ефективності); - ефективний в тих випадках, коли лікування відомими препаратами безуспішне; - більш вигідний економічно, має більш просту методику лікування або більш зручну лікарську форму; - при комбінованій терапії підвищує ефективність вже існуючих ЛЗ, не збільшуючи їхню токсичність.
IV фаза клінічних випробувань - випробування лікарського засобу, яке здійснюється після реєстрації лікарського засобу та надходження його на ринок, з метою визначення терапевтичної значимості лікарського засобу, стратегії його подальшого використання, а також для отримання додаткової інформації про спектр та частоту побічних реакцій та взаємодії лікарського засобу з іншими лікарськими засобами. Тривалість декілька років. Кількість досліджуваних – десятки тисяч.
Фаза IV - постреєстраційні дослідження Після дозволу застосування нового препарату в медичній практиці і його впровадження можливе проведення фази IV - клінічних досліджень, ціллю яких є вивчення можливостей для розширення показань до застосування ЛЗ, удосконалення режимів призначення і схем лікування, а також тривале спостереження (протягом декількох років). Основна увага звертається на збір і аналіз інформації про побічну дію ЛЗ, які вивчаються. Ще більш важливим представляється вивчення віддаленої ефективності препаратів на виживання, яке проводиться у багатьох сотень і тисяч хворих. Контрольовані дослідження фази IV можуть включати різне число хворих (від декількох десятків до тисяч) і бути: - ретроспективними; - проспективними. Ретроспективні дослідження проводяться на основі минулого досвіду застосування різних ЛЗ або видів терапії за даними історій хвороби. Вони часто мають великі погрішності, оскільки базуються на вивченні різних груп хворих, не збалансованих по чинниках, що впливають і не впливають на результат (нерандомізовані дослідження). Проспективні дослідження плануються на перспективу (до початку набору хворих) і проводяться по загальному протоколу в збалансованих групах хворих, що значно підвищує надійність отриманих результатів. Іноді результати подібних досліджень заставляють змінити відношення до препаратів, ефект яких вважався давно вивченим
Основні вимоги до проведення клінічного дослідження ЛЗ Клінічні випробування повинні проводитися в строгій відповідності з основоположними етичними принципами Гельсинської Декларації, і діючими нормативними вимогами. До початку клінічного випробування повинна бути проведена оцінка співвідношення ризику, що передбачається, і незручностей з очікуваною користю для випробовуваного і суспільства. Клінічне випробування може бути почате і продовжене тільки в тому випадку, якщо очікувана користь виправдовує ризик. Права, безпека і здоров'я випробовуваного важливіше за інтереси науки і суспільства. Наявні дані доклинического і клінічного вивчення досліджуваного препарату повинні служити достатнім обґрунтовуванням планованого клінічного випробування. Клінічне випробування повинно бути науково обґрунтовано, детально і ясно описано у програмі випробувань (протоколі). Клінічне випробування проводиться відповідно до програми (протоколом) затвердженою Міністерством охорони здоров'я і схваленою комітетом із етики. Тільки кваліфікований лікар або стоматолог може узяти на себе відповідальність за надання випробовуваним медичної допомоги і ухвалення розв'язань медичного характеру.
Всі особи, що беруть участь в проведенні клінічного випробування повинні мати освіту, професійну підготовку, відповідні функціям, що виконуються. До включення випробовуваного в клінічне випробування у нього повинно бути отримано добровільна згода на участь на основі надання всієї інформації про випробування. Вся інформація про клінічне випробування повинна реєструватися, оброблятися і зберігатися так, щоб була можливість для її точного повідомлення, інтерпретації і перевірки правильності. Записи, які можуть дозволити ідентифікувати особистість пацієнтів, повинні захищатися відповідно до наявних нормативних вимог про захист права на конфіденційність даних і на недоторканність особистого життя. Виробництво і зберігання досліджуваного препарату, а також поводження з ним здійснюється відповідно до правил Належної виробничої практики (Good Manufacturing Practice - GMP). Препарат повинен використовуватися відповідно до затвердженої програми (протоколу). Потрібно неухильно дотримуватися процедур, що дозволяють забезпечити якість кожного аспекту клінічного випробування.
Клінічні дослідження усіх фаз проводять в офіційно сертифікованихдержавними органами контролю центрах (медичні центри, лікарні, поліклініки) що мають відповідне науково-технічне обладнання і можливість надання кваліфікованої медичної допомоги хворим з небажаними медикаментозними реакціями.
Не дивлячись на суттєві витрати (іноді десятки млн. доларів) і строгу оцінку ефективності, лише 1 із 10 зареєстрованих нових препаратів займає лідируючі позиції на ринку ЛЗ (наприклад, лосег, золцер, ліпітор, норваск, пульмікорт), приносячи виробнику значні прибутки. Інші 8 нових зареєстрованих препаратів приблизно відшкодовують витрати на їх створення, і ще 1 препарат із 10 наносить збитки своєму виробникові і/або знімається з виробництва (грепафлоксацин, ліпобай).
Схожі презентації
Категорії