Презентація на тему:
Узагальнення знань з теми «Вуглеводні»
Завантажити презентацію
Узагальнення знань з теми «Вуглеводні»
Завантажити презентаціюПрезентація по слайдам:
Узагальнення знань з теми «Вуглеводні» Ткаченко Ірина Іванівна, вчитель хімії Черкаської загальноосвітньої школи I-III ступенів № 21
Будь-яке суспільство – від найпростішого до найскладнішого має три різні, але взаємопов’язані ознаки – властивість, склад, будову. В.М. КЕДРОВ
М Е Т А узагальнити і систематизувати знання про вивчені класи вуглеводнів та хімічні властивості метану, етилену, ацетилену вдосконалювати вміння складати структурні формули речовин, називати органічні сполуки, записувати рівняння реакцій окиснення, заміщення, приєднання; встановити взаємозв’язок між основними класами вуглеводнів.
Дайте відповіді на питання 1. Назвіть основні класи вуглеводнів. 2. Які речовини називають гомологами? 3. Як називають етиленові та ацетиленові вуглеводні? 4. Визначте клас відповідних речовин: а) СН4; б) С2Н2; в) С3Н6; г) С4Н10 5. Які типи реакцій характерні для: а) насичених вуглеводнів; б) алкінів 6. Які речовини мають кратні зв’язки: а) С2Н4; б) С2Н6; в) С3Н8; г) С4Н6
І варіант 1. Вкажіть зв’язок між атомами Карбону у молекулі ацетилену: а) одинарний; б) подвійний; в) два подвійні; г) потрійний 2. Вкажіть суфікс, що використовується в назвах етиленових вуглеводнів: а) -ан; б) -ін; в) -ен; г) -ол ІІ варіант 1. Вкажіть мономер, що використовується для добування поліетилену: а) пропен; б) метан; в) етан; г) етен 2. Яка загальна формула ацетиленових вуглеводнів ? а) СnH2n-2; б) СnH2n+2; в) СnH2n+4; г) СnH2n
І варіант 3. Молекулярна формула пропену: а) С3Н6; б) С3Н8; в) С2Н6; г) СН4 4. У якій речовині є кратні зв’язки? а) метан; б) пропан; в) ацетилен; г) бутан ІІ варіант 3. На першій стадії приєднання водню до ацетилену утворюється: а) пропен; б) етан; в) етилен; г)пропан 4. Яка речовина належить до ненасичених вуглеводнів ряду етилену? а) С3Н4; б) С3Н5; в) С5Н10; г) С4Н10
І варіант 5. Скільки спільних ковалентних електронних пар є між атомами Карбону в молекулі етилену? а) одна; б) дві; в) три; г) чотири 6. Яка загальна формула етиленових вуглеводнів? а) СnH2n-2 б) СnH2n+2 в) СnH2n+4 г) СnH2n ІІ варіант 5. До якого типу реакцій належить відноситься реакція ацетилену з воднем ? а) обміну; б) заміщення; в) приєднання; г) розкладу 6. Молекулярна формула пропіну: а) С3Н6; б) С3Н4; в) С2Н6; г) СН4
І варіант 7. На першій стадії приєднання водню до ацетилену утворюється: а) пропен; б) етилен; в) етан; г) пропан 8. Етиленові вуглеводні вступають у реакції з: а) HCl; б) СO2; в) Cl2; г) H2O ІІ варіант 7. У якій речовині є кратні зв’язки? а) пропан; б) ацетилен; в) метан; г) бутан 8. Ненасичені вуглеводні ряду ацетилену вступають у реакції: а) приєднання; б) термічного розкладу; в) заміщення з галогенами
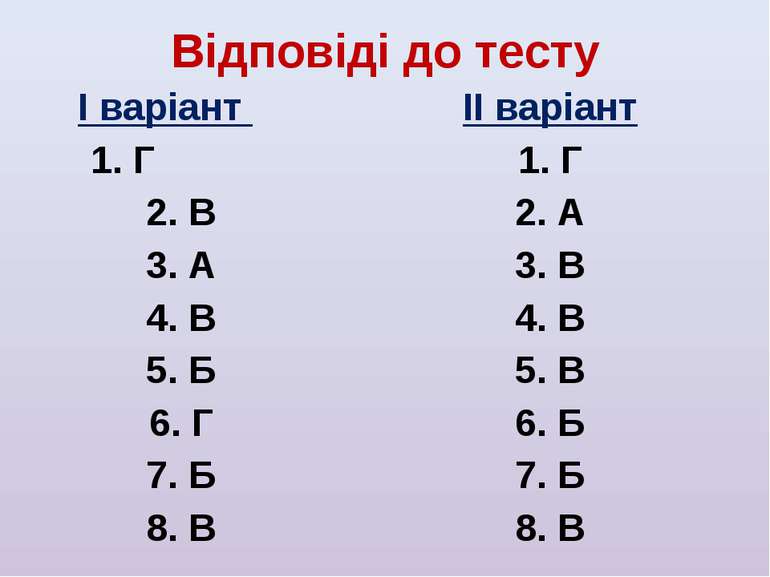
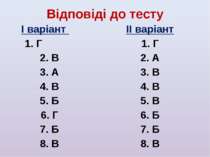
Відповіді до тесту І варіант 1. Г 2. В 3. А 4. В 5. Б 6. Г 7. Б 8. В ІІ варіант 1. Г 2. А 3. В 4. В 5. В 6. Б 7. Б 8. В
ЗАВДАННЯ ГРУПІ (І РІВЕНЬ) 1. Розподіліть по класам і назвіть речовини: а) С2Н2; б) С3Н8; в) С6Н12; г) СН4; д) С4Н6 2.Встановіть відповідність між структурною формулою і назвою сполуки: 1) СН3 –СН = СН2 - СН2 - СН3; а) пентан; 2) СН 2 - СН 2 – СН2 - СН3; б) бутин; 3) СН ≡ С – СН 2 - СН3; в) бутан; г) пентен 3. Допишіть рівняння реакцій: підказка а) СН4 + Br2 → див. насичені вуглеводні б) С3Н8 + O2 → реакція горіння в) С2Н4 + Cl2 → див. приєднання до етилену г) С2Н2 + Н2 → див. властивості ацетилену
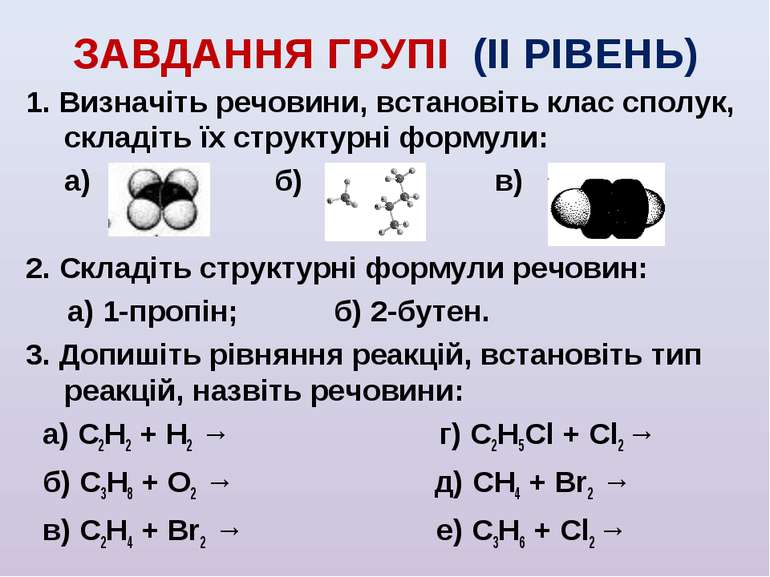
ЗАВДАННЯ ГРУПІ (ІI РІВЕНЬ) 1. Визначіть речовини, встановіть клас сполук, складіть їх структурні формули: а) б) в) 2. Складіть структурні формули речовин: а) 1-пропін; б) 2-бутен. 3. Допишіть рівняння реакцій, встановіть тип реакцій, назвіть речовини: а) С2Н2 + Н2 → г) С2Н5Cl + Cl2 → б) С3Н8 + O2 → д) СН4 + Br2 → в) С2Н4 + Br2 → е) С3Н6 + Cl2 →
ЗАВДАННЯ ГРУПІ (ІII РІВЕНЬ) 1. Розподіліть по класам і назвіть речовини: а) б) С3Н8; в) г) С3Н4; д) С4Н6; е) 2. Встановіть відповідність між класом вуглеводню і типом хімічної реакції: 1) заміщення з бромом; а) пропін; 2) приєднання хлору; б) бутан; 3) полімеризація; в) бензен; г) етен 3. Здійсніть перетворення, вкажіть тип реакцій, назвіть речовини: а) C2H6 → C2H4 → CО2 б) CH4 → C2H2 → C2H2СІ2 → C2H4Cl2 ↓ C2H5Br
ЗАВДАННЯ ГРУПІ (ІV РІВЕНЬ) 1. Розподіліть по класам і назвіть речовини: а) С3Н8; б) С3Н4; в) г) д) С4Н6; е) 2. Встановіть відповідність між класом вуглеводню і типом хімічної реакції: 1) полімеризація; а) ацетилен; 2) заміщення з хлором; б) пропан; 3) приєднання брому; в) етилен; г) бензен 3. Встановіть послідовність типів реакцій для здійснення перетворення Алкан → галогенпохідне алкану → алкен → алкін → вуглекислий газ: а) гідрогалогенування; б) дегідрування; в) горіння; г) дегідрогалогенування; д)галогенування. 4. Здійсніть перетворення, назвіть речовини: + Cl2 - НСІ - Н2 + СІ2 C2 H6 → Х1 → Х2 → Х3 → Х4
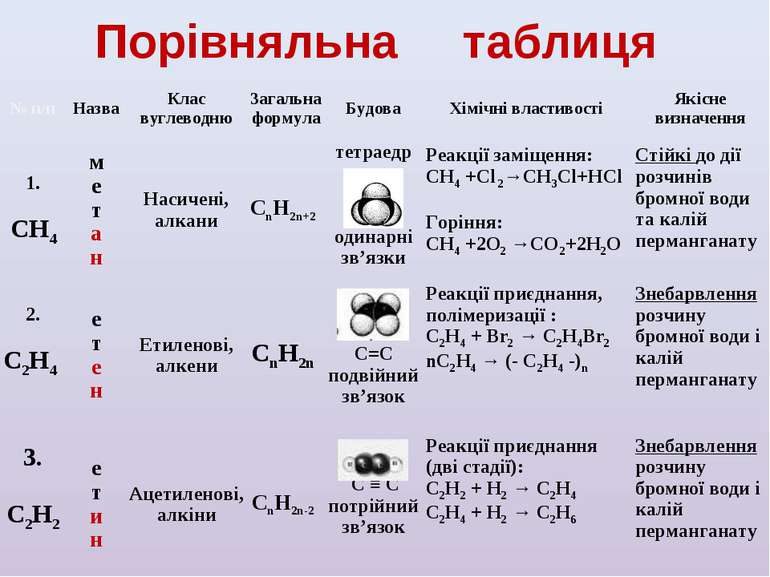
Порівняльна таблиця № п/п Назва Клас вуглеводню Загальна формула Будова Хімічні властивості Якісне визначення 1. СН4 м е т а н Насичені, алкани СnH2n+2 тетраедр одинарні зв’язки Реакції заміщення: СН4 +Cl 2→СН3Cl+НCl Горіння: СН4 +2O2 →СО2+2Н2О Стійкі до дії розчинів бромної води та калій перманганату 2. С2Н4 е т е н Етиленові, алкени СnH2n С=С подвійний зв’язок Реакції приєднання, полімеризації : С2Н4 + Br2 → С2Н4Br2 nС2Н4 → (- С2Н4 -)n Знебарвлення розчину бромної води і калій перманганату 3. С2Н2 е т и н Ацетиленові, алкіни СnH2n-2 С ≡ С потрійний зв’язок Реакції приєднання (дві стадії): С2Н2 + Н2 → С2Н4 С2Н4 + Н2 → С2Н6 Знебарвлення розчину бромної води і калій перманганату
КАРТКА САМООЦІНКИ Поставте кількість балів, що відповідає рівню Ваших знань: 1.Усна відповідь (1 бал) ___ 2. Контролюючий тест (1-4 бали, згідно рівня) __ 3. Робота в групі (справився сам – 2 бали, за допомоги групи - 1 бал, не справився – 0 балів): Відповіді на тести (0 -2 бали) ___ Складання формул речовин (0 – 2 бали) ___ Складання рівнянь реакцій (0– 2 бали) ___ 4. Доповнення (створення таблиці) (1 бал) ___ Загальна кількість балів за урок _____
Домашнє завдання Повторити вивчений матеріал теми. Повторити основні поняття. Письмове завдання.
Схожі презентації
Категорії