Презентація на тему:
Створення і розвиток теорії електролітичної дисоціації та вчення про хімічні розчини
Завантажити презентацію
Створення і розвиток теорії електролітичної дисоціації та вчення про хімічні розчини
Завантажити презентаціюПрезентація по слайдам:
Презентація вчителя хімії Смілянської загальноосвітньої школи І-ІІІ ступенів №2 Туренко Алли Борисівни
Мета: - ознайомитись з історією становлення і розвитку теорії електролітичної дисоціації та вчення про розчини; - розглянути механізм процесу електролітичної дисоціації на прикладі розчинів кислот, основ, солей; - навчитись складати рівняння дисоціації розчинів і розплавів кислот, основ, солей та реакцій йонного обміну.
У 30-х роках XIX ст. явище проходження струму крізь розчини досліджував англійський учений Майкл Фарадей. Він помітив, що розчини одних речовин при зануренні в них електродів, з'єднаних з гальванічним елементом, добре проводять електричний струм, а розчини інших речовин зовсім його не проводять. Було встановлено, що розплави солей також електропровідні. Дослідження Майкла Фарадея
Неодмінною умовою проходження електричного струму крізь якесь середовище (речовину, матеріал тощо) вважалася наявність у цьому середовищі заряджених частинок. Рухаючись у полі, частинки переносять заряд від одного електрода до другого. Створюється напрямлений рух електричних зарядів — електричний струм. Фарадей вважав, що наявність електричного поля спричиняє розпад речовин на заряджені частинки, а при відсутності електричного поля такий процес не відбувається. Останнє положення, як довели пізніше, було помилковим. Так було відкрито явище електропровідності розчинів.
Фарадей своїми дослідженнями довів існування в розчинах іонів. У 1833—1834 рр. Фарадей відкрив закони електролізу; ввів у хімію такі терміни, як електрод, електроліт, електроліз, анод, катод, іон, катіон, аніон та ін. Про можливість утворення заряджених частинок у водних розчинах деяких речовин зробив припущення ще на початку XIX ст. прибалтійський фізик X. Гротгус. Вивчаючи електропровідність води, він описав це явище як рух позитивно заряджених атомів водню до одного з електродів (тепер ми називаємо його катодом) і негативно заряджених атомів кисню — до другого електрода (анода). У 1880 р. учень Д. І. Менделєєва, викладач Київського університету М.М.Каяндер, який вивчав особливості протікання деяких реакцій за участю кислот, пояснив різну реакційну активність кислот їх різною здатністю до розпаду (дисоціації) на окремі йони. Учений висловив думку, що розчинник — не просто середовище, де відбувається дисоціація, а активний учасник цього процесу. Дослідження складу розчинів
Становлення теорії електролітичної дисоціації Шведський вчений Сванте Арреніусу (1884р.) описав досліди з розчинами електролітів та виклав тези, в яких було закладено контури майбутньої нової теорії. Арреніус установив, що кислоти в безводному стані не проводять електричного струму, а додавання води робить їх електропровідними. На підставі цього вчений висловив припущення, що водний розчин електроліту має «активну» частину, яка проводить електричний струм, і «неактивну» частину, що не проводить струм. Ці компоненти розчину зрівноважені. Для характеристики «активності» розчину Арреніус запропонував ввести коефіцієнт активності (пізніше його назвали ступенем електролітичної дисоціації), що визначають діленням числа йонів, які фактично містяться в розчині, на число йонів, яке давав би електроліт, при повнісй дисоціації. Однак праця Арреніуса не привернула особливої уваги. Лише німецький фізикохімік В. Оствальд і російський фізикохімік І.О. Каблуков належно оцінили її.
Петербурзький професор В.Ф. Алексєєв досліджував явище взаємної розчинності рідин. Він розглядав розчинення як складний процес, зумовлений фізичними силами і хімічною взаємодією. І.Ф. Шредер, вивчаючи розчинність твердих тіл, висунув ідею, що коли розчинення не супроводиться хімічною взаємодією речовини з розчинником, то воно мало чим відрізняється від процесу змішування двох газів, які не реагують між собою. Він уперше вивів рівняння розчинності твердих речовин, які не взаємодіють з розчинником, залежно від температури і теплоти плавлення речовини. Вплив хімічної природи розчинника на дисоціацію солей широко досліджував Л.В. Писаржевський. Вивчаючи залежність ступеня дисоціації сполуки від розчинника, він довів, що розчинник активно впливає на хімічну рівновагу, утворюючи з розчиненою речовиною хімічні сполуки — сольвати (від лат. solvent — розчинник), у водному розчині — гідрати. Становлення фізико-хімічної теорії розчинів
І.О. Каблуков систематично досліджував неводні розчини. Він підтримував ідеї Д.І. Менделєєва, який вважав, що розчинник здебільшого не є інертним середовищем — його молекули, вступають у взаємодію з речовиною, що розчиняється. І.О. Каблуков довів, що розчинник, діючи на молекули деяких речовин, може так ослабляти зв'язки між атомами, що молекули починають розпадатися на частини (йони). Каблуков перший застосував хімічну теорію розчинів Менделєєва до розчинів електролітів, розвинувши уявлення про сольватацію йонів як про складову механізму електролітичної дисоціації. Водночас Каблуков установив залежність між провідністю розчинів електролітів (отже, і їхньою дисоціацією) та діелектричною сталою (полярністю) розчинника. Чим вища остання, тим більша дисоціююча дія розчинника. Ще одним кроком в розвитку вчення про розчини стало створення теорії сильних електролітів. Основним поштовхом до цього було те, що дисоціація сильних електролітів не підпорядковувалася закону діючих мас. Такий висновок неодноразово підтверджували експериментально. Дослідження неводних розчинів
Електролітична дисоціація - процес розпаду речовин на йони. Електролітичної дисоціації у розчині зазнають гідроксиди, кислоти, солі, як неорганічні, так і органічні. Крім того, усі речовини йонної природи (їх кристали побудовані з йонів) - солі, луги, багато оксидів металів — можуть дисоціювати і в розплавленому стані. Якщо хімічна сполука має йонну кристалічну решітку, тобто решітку, у вузлах якої розміщені йони, що правильно чергуються між собою в усьому її об'ємі, така сполука поводиться як електроліт. Розчиняючись у воді, вона утворює йони, що надають розчину здатність проводити електричний струм. Проте властивості електролітів у розчині можуть мати й сполуки, кристалічна решітка яких побудована не з йонів, а з молекул з ковалентним полярним зв'язком між атомами, який за певних умов (під дією молекул розчинника) може легко перетворюватися в йонний. Теорія електролітичної дисоціації
Молекули розчинника відіграють важливу роль у процесі електролітичної дисоціації. Розглянемо на прикладі води, як молекули розчинника зумовлюють розпад речовин на іони: молекула води має два ковалентних зв'язки між атомами водню та кисню; Оксиген — більш електронегативний елемент, ніж Гідроген, і тому спільна електронна пара відтягнута до атома Оксигену. У просторі зв'язки О—Н молекули води розміщені не по прямій лінії, а під кутом близько 105°. Завдяки цьому на одному кінці молекули, з боку атома Оксигену, є певний надлишок негативного електричного заряду, а на протилежному, а з боку атомів Гідрогену,— надлишок позитивного заряду; молекули води полярні (їх називають диполями). Механізм процесу електролітичної дисоціації О δ- 104,5 δ+ Н Н
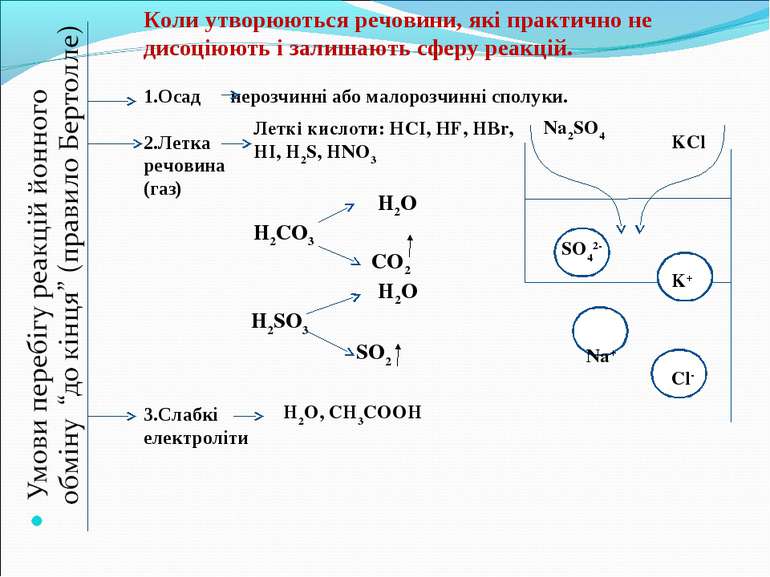
Коли утворюються речовини, які практично не дисоціюють і залишають сферу реакцій. Осад нерозчинні або малорозчинні сполуки. 2.Летка речовина (газ) Леткі кислоти: НСІ, НF, HBr, HI, H2S, HNO3 H2O H2CO3 CO2 H2SO3 SO2 H2O 3.Слабкі електроліти H2O, CH3COOH Na+ K+ SO42- Cl- KCl Na2SO4
1. Заряджені часточки, які утворюються під час дисоціації 2. 1нша назва речовини, яка слабко дисоціює. 3. Назва продукту реакції, який випадає на дно пробірки. 4. Тип реакції між двома складними речовинами, під час якої вони обмінюються своїми складовими частинами. 5. Хімічні рівняння реакції, записані з використанням йонів. 6. Речовина, яка з реагуючої суміші виділяється у повітря. 1 2 3 4 5 6
Схожі презентації
Категорії