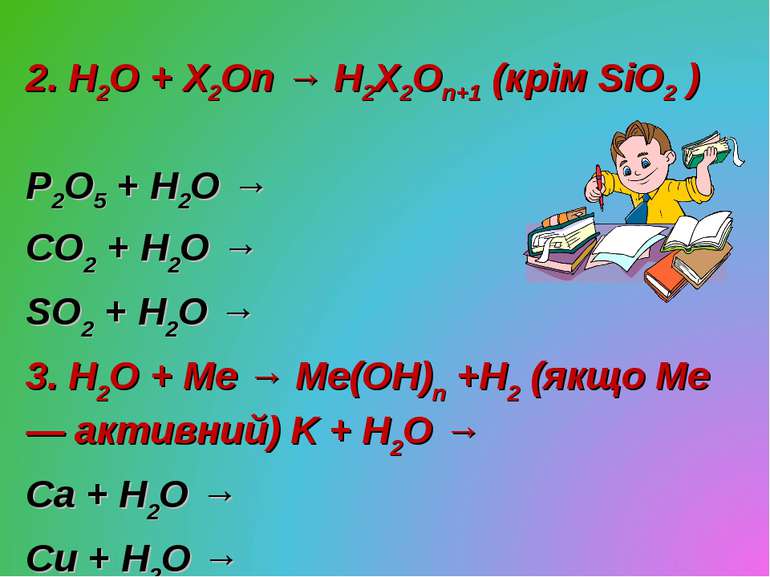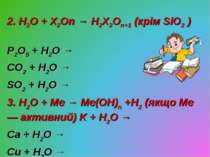Презентація на тему:
Розчин та його компоненти: розчинник, розчинена речовина. Вода як розчинник. Будова молекули води, поняття про водневий зв’язок
Завантажити презентацію
Розчин та його компоненти: розчинник, розчинена речовина. Вода як розчинник. Будова молекули води, поняття про водневий зв’язок
Завантажити презентаціюПрезентація по слайдам:
Розчин та його компоненти: розчинник, розчинена речовина. Вода як розчинник. Будова молекули води, поняття про водневий зв’язок
Відповісти на питання На які дві групи поділяються дисперсні системи? Які розчини називаються колоїдними? Які розчини називаються істинними? З яких компонентів складається розчин? Чи можна стверджувати, що розчини мають постійний склад? Чому?
Розчини — це багатокомпонентні системи. Один із компонентів називається розчинником. Зазвичай це речовина, що перебуває в тому ж агрегатному стані, що й розчин.
Вода — універсальний розчинник усіх речовин на Землі. Наведіть приклади водних розчинів Наведіть приклади неводних розчинів
За реакцією з водою всі речовини поділяються на три групи: розчинні; малорозчинні; практично нерозчинні.
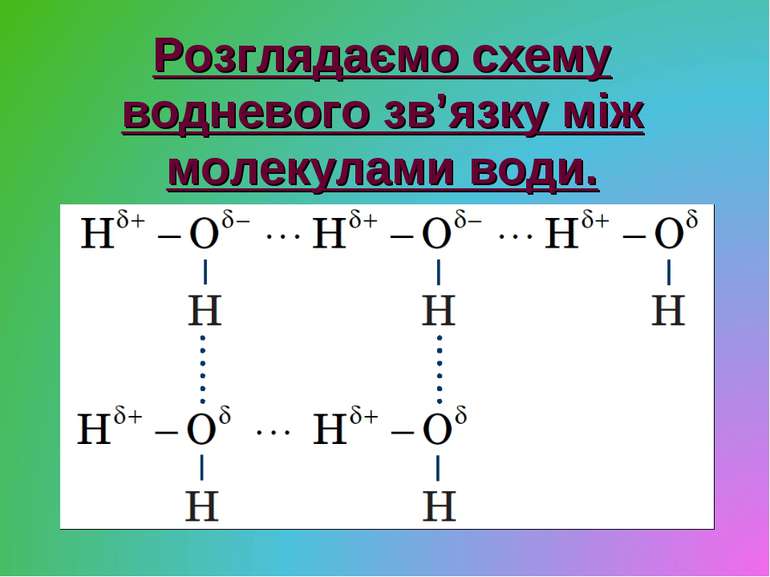
Тип зв’язку — ковалентний полярний, кут зв’язку — 104,5°. Тип кристалічної ґратки — молекулярний.
— Ґратка молекулярна? Чому ж за нормальних умов вода — рідина? Молекула води полярна — диполь. Між молекулами води виникає взаємне притягання за температури менш ніж 100°С. Такий зв’язок називається водневим.
Заповнюємо опорну схему Молекулярна формула: ________ Структурна формула: ________ M(H2O) _______________________
Поширення в природі В організмі людини: ___________ На Землі: _____________________ У Космосі: ____________________
Фізичні властивості За атмосферного тиску 1 атм: Ткип = 100°С, Тплав = 0°С, ρ = 1 г/см3. Агрегатні стани:
Хімічні властивості 1. H2O + Me2On → Me(OH)n (якщо Ме — активний, а основа — розчинна або малорозчинна) Na2O + H2O → CaO + H2O → CuO + H2O →
2. H2O + X2On → H2X2On+1 (крім SiO2 ) P2O5 + H2O → CO2 + H2O → SO2 + H2O → 3. H2O + Me → Me(OH)n +H2 (якщо Ме — активний) K + H2O → Ca + H2O → Cu + H2O →
Завдання 1 Обчисліть масу води, що утворюється внаслідок згоряння водню об’ємом 1,12 л (за н.у.). Обчисліть об’єм пари води цієї маси. Завдання 2 Обчисліть масу лугу, що утворюється в процесі розчинення у воді калію масою 3,9 г.
Домашнє завдання Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи. Розв’язати задачу: Обчисліть, яку масу сульфатної кислоти можна одержати з 3,2 г сірки.
Схожі презентації
Категорії