Презентація на тему:
Розчин і його компоненти: розчинник, розчинена речовина
Завантажити презентацію
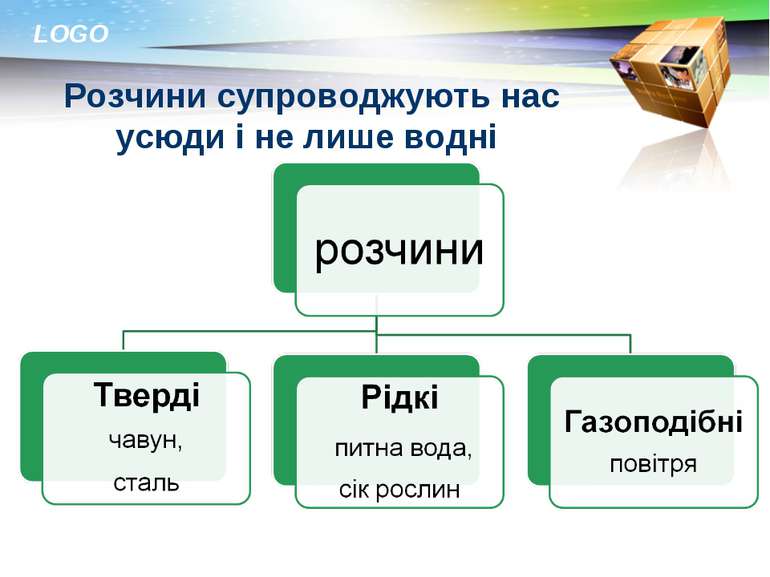
Розчин і його компоненти: розчинник, розчинена речовина
Завантажити презентаціюПрезентація по слайдам:
Розчин та його компоненти: розчинник, розчинена речовина. Вода як розчинник. Будова молекули води, поняття про водневий зв’язок. Фізико-хімічна суть процесу розчинення. Кристалогідрати. Урок № 2 LOGO
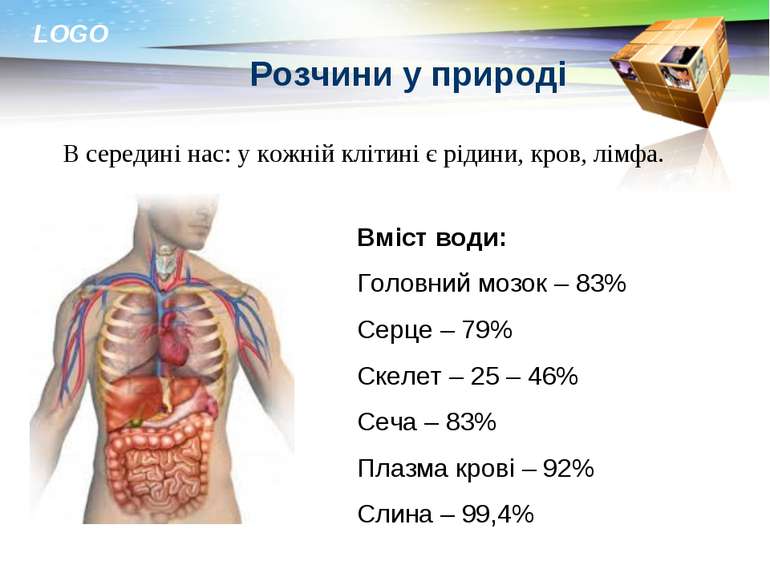
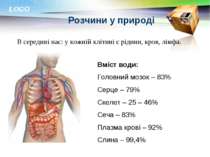
Розчини у природі В середині нас: у кожній клітині є рідини, кров, лімфа. Вміст води: Головний мозок – 83% Серце – 79% Скелет – 25 – 46% Сеча – 83% Плазма крові – 92% Слина – 99,4% LOGO
Задача 1. Якою буде маса розчину, якщо у 120 г води розчинили 40 г солі? Задача 2. Якою буде маса розчину, що утворився при розчиненні у 240 г води хлороводню, об’ємом 33,6 л. Розв’яжіть задачі: LOGO
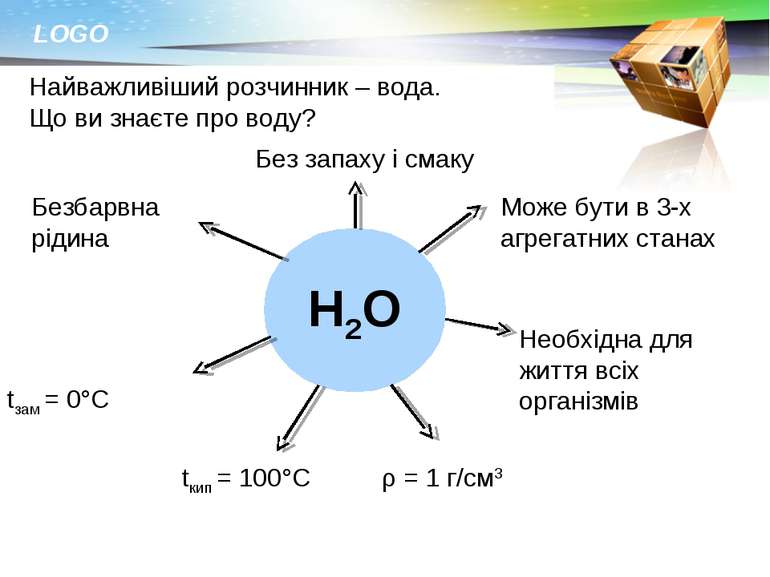
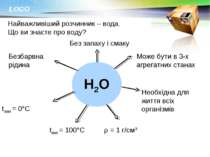
Найважливіший розчинник – вода. Що ви знаєте про воду? Н2О Безбарвна рідина Без запаху і смаку Може бути в 3-х агрегатних станах Необхідна для життя всіх організмів ρ = 1 г/см3 tкип = 100°С tзам = 0°С LOGO
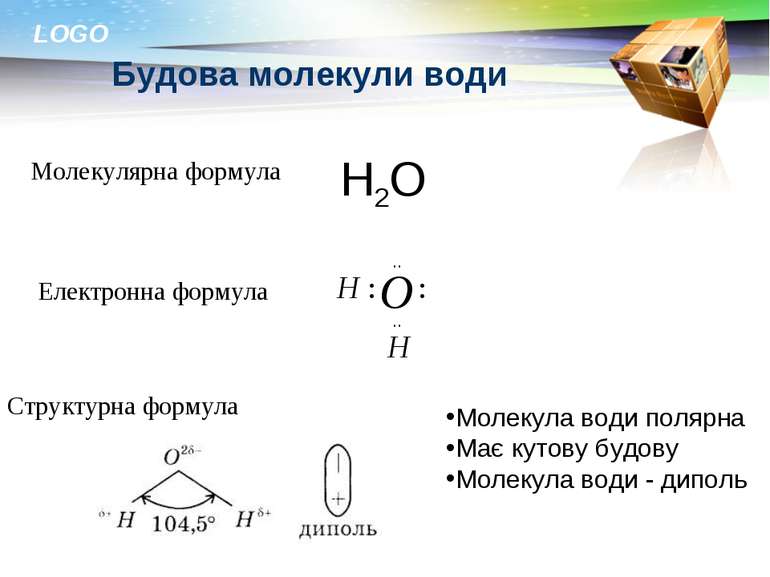
Будова молекули води Молекулярна формула Електронна формула Структурна формула Н2О Молекула води полярна Має кутову будову Молекула води - диполь LOGO
Водневий зв’язок – хімічний зв’язок, що виникає між атомами Гідрогену і атомами сильно електронегативних елементів (F, O, N) Водневий зв’язок позначається крапками Слабший за ковалентний зв’язок Легко розривається при випаровуванні води. LOGO
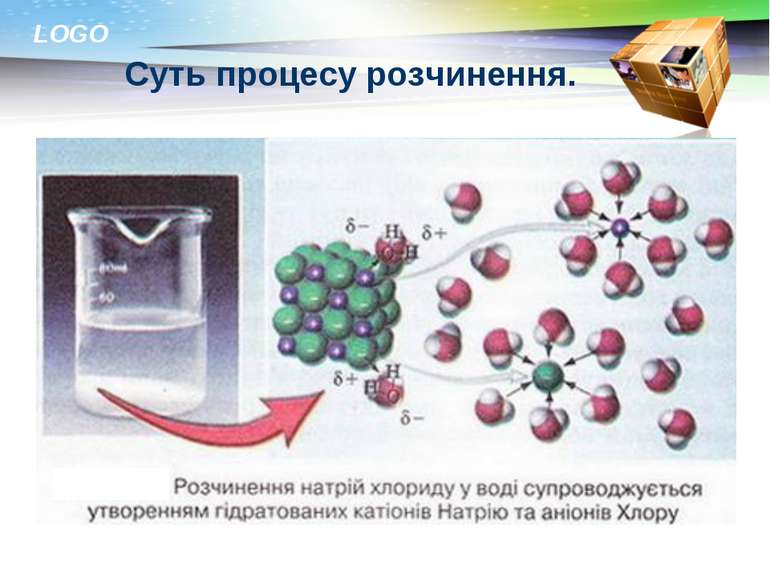
Суть процесу розчинення. Що відбувається під час розчинення речовини? Частинки однієї речовини розподіляються між частинками іншої. Розчинення – це фізичний чи хімічний процес? LOGO
Суть процесу розчинення. Чи утворилася нова речовина? Ні. Тому процес розчинення є фізичним процесом. Які зміни відбувалися при розчиненні Н2SO4 та NH4NO3? Виділення та поглинання теплоти. Це ознаки хімічних процесів. Висновок: розчинення – фізико-хімічний процес. Натисніть на малюнок для перегляду відео досліду LOGO
Розчинення складається з трьох процесів: ІІ. Руйнування кристалічної гратки речовини (при цьому енергія вбирається) І. Гідратація - взаємодія речовини з водою (при цьому енергія виділяється) ІІІ. Дифузія – розподіл гідратованих йонів у товщі розчинника Тепловий ефект розчинення залежить від співвідношення кількості енергії , що виділяється і поглинається у перших двох процесах. LOGO
Отже, розчинення – це складний фізико-хімічний процес, під час якого відбувається взаємодія між частинками розчинника та розчинюваної речовини. Уточнимо визначення розчину с. 37 підручника : Розчин – це однорідна (гомогенна) система змінного складу, що містить розчинювану речовину, розчинник та продукти їх взаємодії LOGO
Кристалогідрати Кристалогідрати – це кристалічні речовини, до складу яких входять молекули води Вода, що утримується в кристалах називається кристалізаційною . LOGO
Розв’яжіть задачі Задача 1. Обчисліть молярну масу залізного купоросу. Задача 2. Визначте масову частку води у мідному купоросі. Задача 3. Кристалогідрат Na2SO4 ∙ n Н2О масою 32,2 г прожарили. Добули безводну сіль масою 14,2 г. Визначте число молекул води у кристалогідраті. . LOGO
Схожі презентації
Категорії