Презентація на тему:
Прості й складні речовини
Завантажити презентацію
Прості й складні речовини
Завантажити презентаціюПрезентація по слайдам:
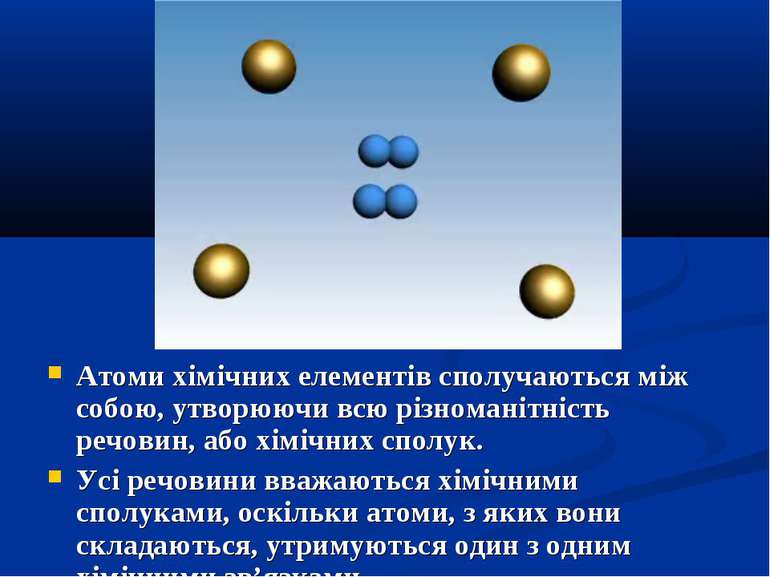
Атоми хімічних елементів сполучаються між собою, утворюючи всю різноманітність речовин, або хімічних сполук. Усі речовини вважаються хімічними сполуками, оскільки атоми, з яких вони складаються, утримуються один з одним хімічними зв’язками.
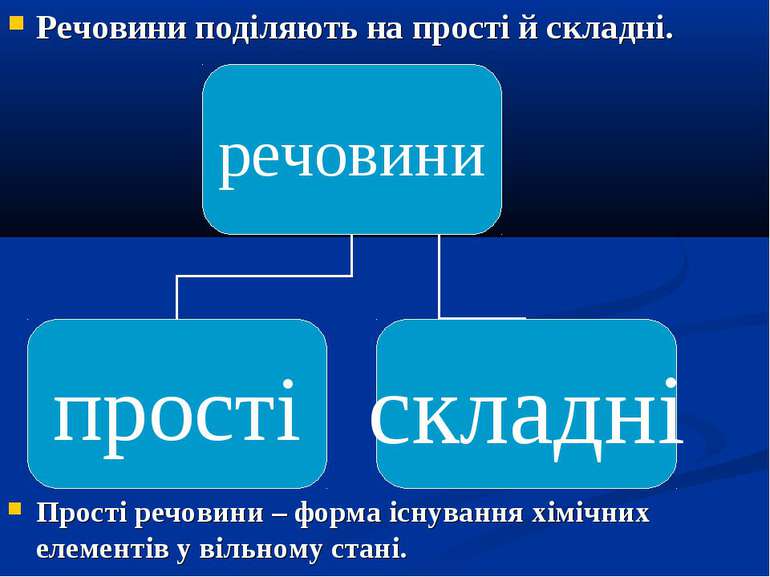
Речовини поділяють на прості й складні. Прості речовини – форма існування хімічних елементів у вільному стані.
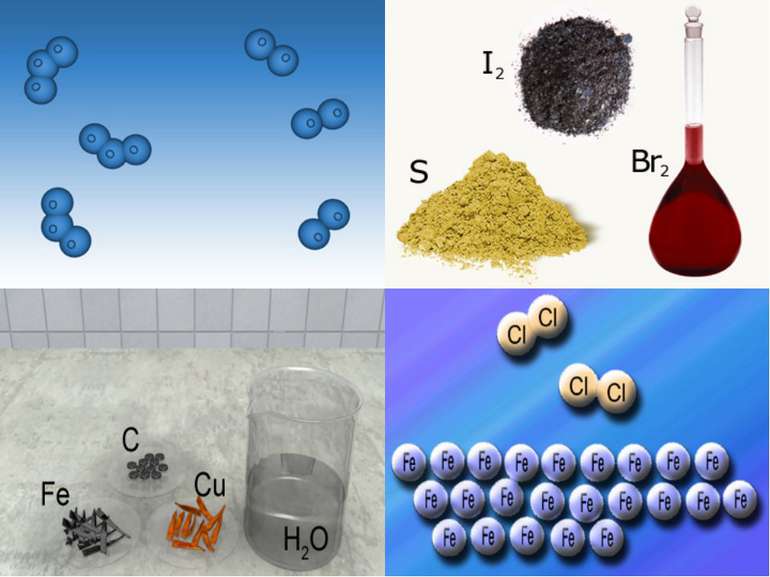
Переважна більшість елементів, які містяться у природних об’єктах, виділені у вигляді простих речовин, наприклад азот N2, хлор Cl2, водень Н2, кисень О2, озон О3 та ін. Їхні молекули містять атоми одного й того самого хімічного елемента, інших елементів немає.
Хімічна сполука, утворена атомами одного хімічного елемента, називається- простою речовиною. азот N2, хлор Cl2, водень Н2, кисень О2, озон О3
Маленька цифра, що стоїть справа внизу від символу відповідного елемента, показує, скільки атомів входить до складу молекули даної речовини. Вона називається індексом. азот N2
Для простих речовин атомної будови число атомів у формулі не зазначається. Хімічна формула таких речовин за написанням збігається з символом хімічного елемента. Так, формула заліза – Fe, силіцію – Si, графіту – С, міді – Cu, алюмінію – Al.
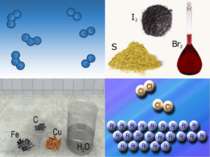
Прості речовини поділяють на: метали (натрій Na, цинк Zn, барій Ва, магній Mg) неметали (сірка S, фосфор Р, йод І2, бром Br2).
Усі метали мають немолекулярну будову, тому виявляють багато спільних властивостей. Метали добре проводять електричний струм і теплоту, Чимало з них пластичні: легко куються, розплющуються в пластини, витягуються в дріт. Більшість металів має сірий або сріблясто-сірий колір. Виняток становлять мідь і золото. Характерною ознакою металів є також металічний блиск. Властивості металів
Властивості неметалів Неметали можуть мати як молекулярну, так і немолекулярну структури. Вони погано проводять теплоту й електричний струм, крихкі, мають різний колір. Так, фосфор червоного кольору, сірка — жовтого, графіт — чорного, водень — безбарвний газ.
Назви простих речовин і відповідних хімічних елементів здебільшого збігаються. Наприклад, проста речовина, утворена хімічним елементом Хлором, називається хлором, а проста речовина, утворена хімічним елементом Кальцієм, - кальцієм.
Хімічна сполука, утворена атомами різних хімічних елементів, називається складною речовиною. HCl MgCl2 NaCl KClO3 KCl CH4 C2H2
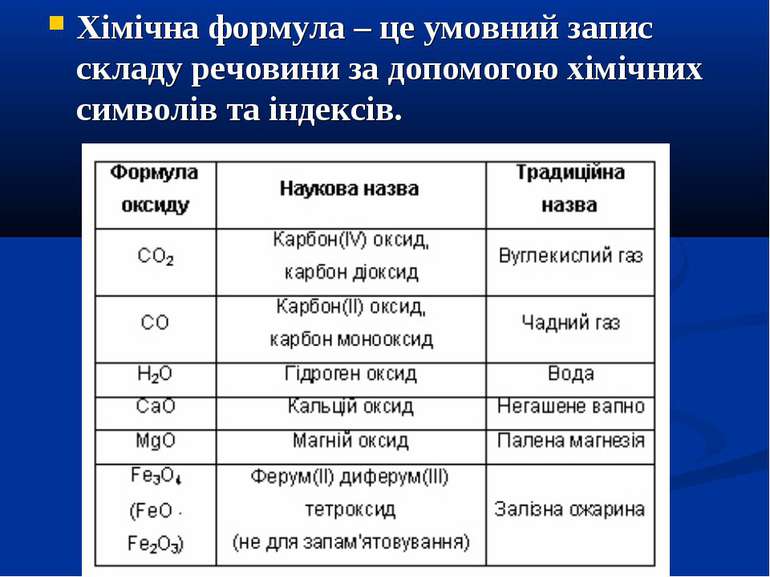
Прикладами складних речовин можуть бути вода Н2О річковий пісок SiO2 цинк оксид ZnO вуглекислий газ СО2 кухонна сіль NaCl метан СН4 глюкоза С6Н12О6 сода Na2CO3. Як бачимо, вони складаються з атомів різних хімічних елементів.
Складні речовини, так само як і прості, бувають молекулярної і немолекулярної будови До речовин молекулярної будови із зазначених вище належать вода Н2О, вуглекислий газ СО2, метан СН4, глюкоза С6Н12О6. Їхні формули відбивають склад молекул цих речовин.
Якісний і кількісний склад речовин молекулярної будови завжди сталий і не залежить від місцезнаходження або способів добування речовин.
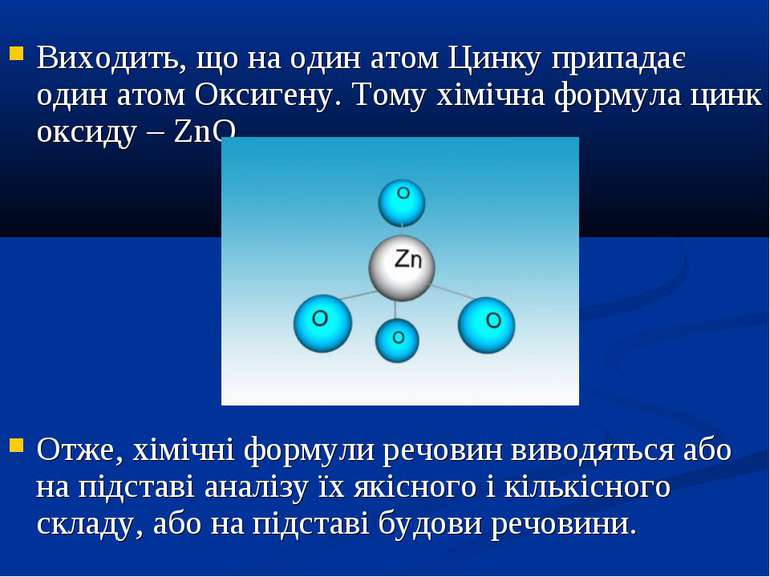
Якщо ж речовини мають немолекулярну будову наприклад, кухонна сіль NaCl, сода Na2CO3, річковий пісок SiO2, то їхні формули відбивають співвідношення атомів різних хімічних елементів у кристалі. Наприклад, було встановлено, що кристали цинк оксиду ZnO мають атомну будову. В кристалі кожний атом Цинку оточений чотирма атомами Оксигену, а кожний атом Оксигену – чотирма атомами цинку:
Виходить, що на один атом Цинку припадає один атом Оксигену. Тому хімічна формула цинк оксиду – ZnO. Отже, хімічні формули речовин виводяться або на підставі аналізу їх якісного і кількісного складу, або на підставі будови речовини.
Хімічна формула – це умовний запис складу речовини за допомогою хімічних символів та індексів.
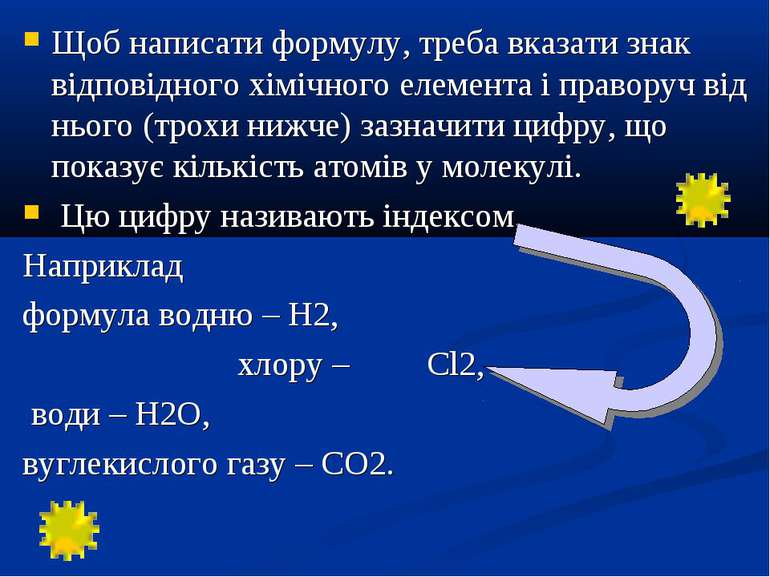
Щоб написати формулу, треба вказати знак відповідного хімічного елемента і праворуч від нього (трохи нижче) зазначити цифру, що показує кількість атомів у молекулі. Цю цифру називають індексом. Наприклад формула водню – H2, хлору – Cl2, води – Н2О, вуглекислого газу – СО2.
Коефіцієнт — це число, яке записується перед хімічною формулою і позначає кількість молекул або окремих атомів даної речовини. Наприклад, запис 4Н означає чотири окремих атоми Гідрогену запис 4Н2О — чотири молекули води. 4Н 4Н2О коефіціент
Висновки Усі речовини – це і є хімічні сполуки. Вони бувають прості та складні. Прості речовини складаються з атомів одного елемента. Складні речовини – з атомів різних елементів. Хімічна формула показує якісний і кількісний склад речовини молекулярної будови, взятої у чистому вигляді. У речовин атомної або йонної будови хімічна формула виражає співвідношення атомів різних елементів у складі речовини. У формулах речовин молекулярної будови індекс показує кількість атомів хімічного елемента в кожній молекулі речовини. У формулах речовин немолекулярної будови (атомної, йонної) індекси виражають співвідношення елементів у речовині.
Схожі презентації
Категорії