Презентація на тему:
ПРОЕКТ для обговорення Програма для загальноосвітніх навчальних закладів ХІМІЯ 7-9 класи
Завантажити презентацію
ПРОЕКТ для обговорення Програма для загальноосвітніх навчальних закладів ХІМІЯ 7-9 класи
Завантажити презентаціюПрезентація по слайдам:
ПРОЕКТ ДЛЯ ОБГОВОРЕННЯ ПРОГРАМА для загальноосвітніх навчальних закладів ХІМІЯ 7-9 класи Пропозиції до проекту надсилати на адреси: lvel@ukr.net dybovuk@voliacable.com s_fitsajlo@mon.gov.ua Київ 2012
В основній школі хімію вивчають за типовим навчальним планом з таким розподілом годин: 7 кл. – 1, 5 год., 8, 9 кл . – 2 год. на тиждень.
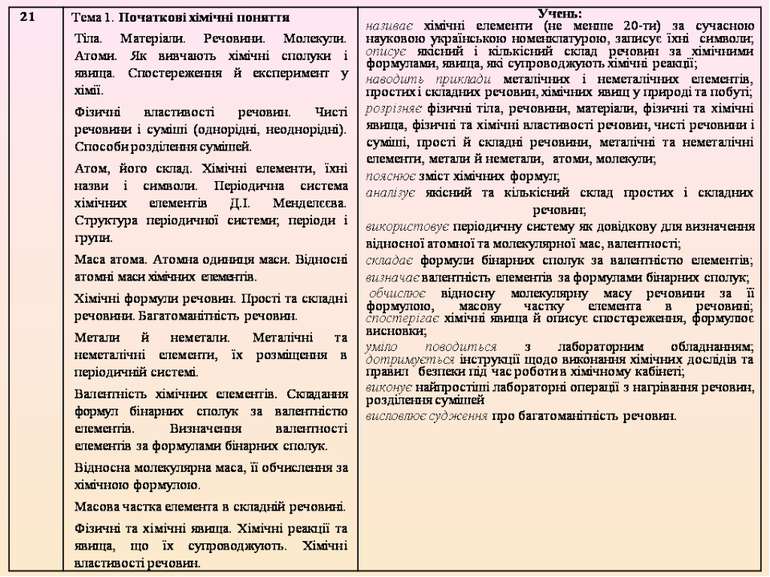
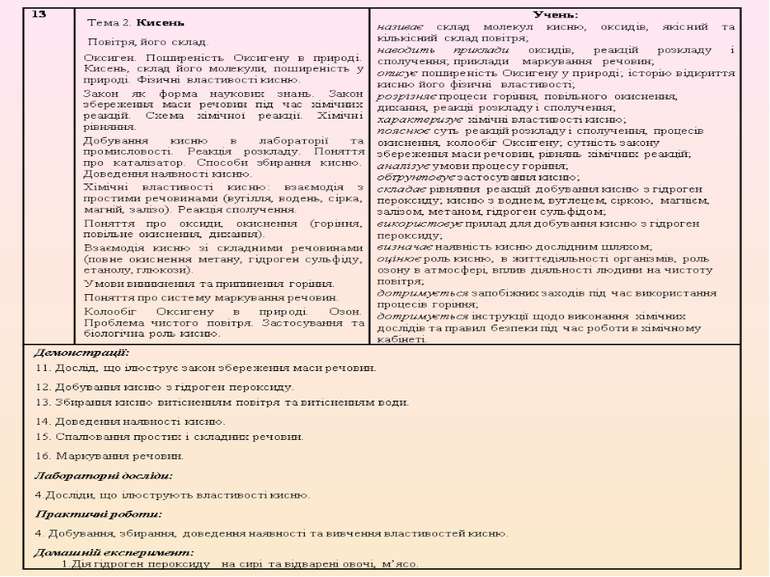
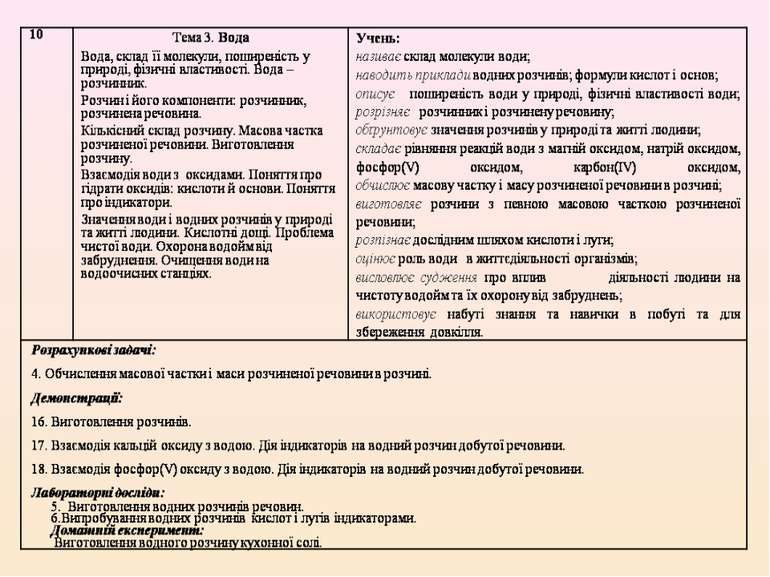
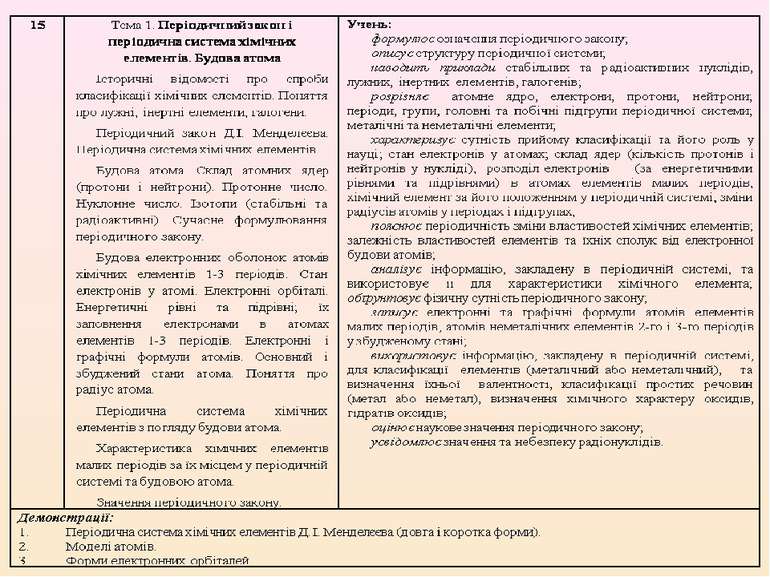
Обрано таку послідовність викладання навчального матеріалу: 7 клас. Вступ. Тема 1. Початкові хімічні поняття. Тема 2. Кисень. Тема 3. Вода. 8 клас. Тема 1. Періодичний закон і періодична система хімічних елементів. Будова атома. Тема 2. Хімічний зв’язок і будова речовини. Тема 3. Кількість речовини, розрахунки за хімічними формулами. Тема 4. Основні класи неорганічних сполук. 9 клас. Тема 1. Розчини. Тема 2. Найважливіші органічні сполуки. Тема 3. Хімічні реакції. Тема 4. Узагальнення знань з хімії.
25 Тема 4. Основні класи неорганічних сполук Класифікація неорганічних сполук, їхні склад і номенклатура. Фізичні властивості оксидів. Хімічні властивості оснóвних та кислотних оксидів: взаємодія з водою, кислотами, лугами, іншими оксидами. Фізичні властивості основ. Хімічні властивості лугів: дія на індикатори, взаємодія з кислотами, кислотними оксидами, солями. Реакція нецтралізації. Учень: називає оксиди, основи, кислоти, середні солі за сучасною науковою українською номенклатурою, індикатори (лакмус, метиловий оранжевий, фенолфталеїн, універсальний індикатор); описує поширеність представників основних класів неорганічних сполук у природі; наводить приклади основних і кислотних оксидів, оксигеновмісних і безоксигенових, одно-, дво-, триосновних кислот, розчинних і нерозчинних основ, середніх солей; класифікує неорганічні сполуки; розрізняє несолетворні (CO, N2O, NO) й солетворні оксиди (кислотні, основні), розчинні й нерозчинні основи, кислоти за складом (оксигеновмісні, безоксигенові) та основністю, середні солі; реакції замiщення, обміну, нейтралізації; характеризує фізичні та хімічні властивості оксидів, основ, кислот, солей; порівнює за хімічними властивостями основні та кислотні оксиди, луги і нерозчинні основи;
Хімічні властивості нерозчинних основ: взаємодія з кислотами і розкладання при нагріванні. Заходи безпеки під час роботи з лугами. Фізичні властивості кислот. Хімічні властивості кислот: дія на індикатори, взаємодія з металами, основними оксидами, основами, солями. Ряд активності металів. Реакції заміщення й обміну. Заходи безпеки під час роботи з кислотами. встановлює генетичні зв’язки між простими і складними речовинами, основними класами неорганічних сполук; обґрунтовує залежність між складом, властивостями та застосуванням речовин; прогнозує перебіг хімічних реакцій солей і кислот з металами, використовуючи ряд активності; складає хімічні формули оксидів, основ, кислот, середніх солей; рівняння реакцій, які характеризують хімічні властивості оснóвних та кислотних оксидів (взаємодія з водою, кислотами, лугами, іншими оксидами), лугів (взаємодія з кислотними оксидами, кислотами та солями в розчині), нерозчинних основ (взаємодія з кислотами, розкладання під час нагрівання), кислот (взаємодія з металами, основними оксидами, основами та солями в розчині), середніх солей (взаємодія з металами, кислотами — хлоридною, сульфатною, нітратною, лугами, солями в розчині); способи добування оксидів (взаємодія простих і складних речовин із киснем, розкладання нерозчинних основ, деяких кислот і солей під час нагрівання), лугів (взаємодія лужних і лужноземельних (крім магнію) металів із водою, оксидів лужних і лужноземельних елементів із водою) й нерозчинних основ (взаємодія солей із лугами в розчині), кислот (взаємодія кислотних оксидів із водою, неметалів із воднем, солей із кислотами),
Фізичні властивості середніх солей. Хімічні властивості середніх солей: взаємодія з металами, кислотами, лугами, іншими солями. Загальні способи добування оксидів, кислот, основ і середніх солей. Генетичні зв’язки між основними класами неорганічних сполук. Поширеність у природі та використання оксидів, кислот, основ і середніх солей. Вплив на довкілля. середніх солей (взаємодія кислот із металами, основних оксидів із кислотами, кислотних оксидів з лугами, лугів із кислотами, солей із кислотами, солей із лугами, кислотних оксидів з основними оксидами, солей із солями, солей із металами (реакції здійснюють у розчинах), металів із неметалами); використовує сучасну українську номенклатуру основних класів неорганічних сполук; таблицю розчинності кислот, основ та солей для складання рівнянь хімічних реакцій; індикатори для виявлення кислот і лугів; обчислює за рівняннями хімічних реакцій масу, кількість речовини та об’єм газу (н. у.) за відомою масою, кількістю речовини одного з реагентів чи продуктів реакції; планує експеримент, проводить його, описує спостереження, робить висновки; розв’язує експериментальні задачі; висловлює судження про значення хімічного експерименту як джерела знань; про вплив речовин на навколишнє середовище і здоров’я людини; оцінює значення найважливіших представників основних класів неорганічних сполук; дотримується запобіжних заходів під час роботи з кислотами і лугами.
25 Тема 2. Найважливіші органічні сполуки Спільні й відмінні ознаки органічних і неорганічних речовин. Особливості будови атома Карбону в основному і збудженому станах. Утворення ковалентних зв’язків між атомами Карбону. Структурні формули органічних речовин. Метан. Молекулярна, електронна і структурна формули метану. Гомологи метану. Молекулярні та структурні формули, назви. Моделі молекул. Значення моделювання в хімії. Фізичні властивості метану і його гомологіву. Етен (етилен) і етин (ацетилен). Молекулярні, електронні і структурні формули, фізичні властивості. Хімічні властивості насичених і ненасичених вуглеводнів: реакції окиснення, термічного розкладу, заміщення, приєднання водню і галогенів. Учень: називає найважливіші органічні сполуки (метан, етен, етин, метанол, етанол, гліцерол, етанова кислота, глюкоза, сахароза, крохмаль, целюлоза, аміноетанова кислота), перші 10 членів гомологічного ряду метану; наводить загальну формулу гомологів метану; описує загальну схему виробництва цукру; розрізняє за складом речовини молекулярної будови і полімери; насичені, ненасичені вуглеводні, спирти, карбонові й амінокислоти, мило, жири, вуглеводи, білки; природні й синтетичні речовини; порівнює органічні й неорганічні речовини, насичені й ненасичені вуглеводні, крохмаль і целюлозу, склад гомологів; пояснює утворення ковалентних зв'язків між атомами Карбону в молекулі метану;
Поширення вуглеводнів у природі. Застосування вуглеводнів. Поняття про полімери на прикладі поліетилену. Застосування поліетилену. Метанол, етанол, гліцерол (гліцерин), їхні молекулярні, структурні формули, фізичні властивості; реакції повного окиснення, взаємодія з активними металами. Якісна реакція на гліцерол. Отруйність етанолу й метанолу. Згубна дія алкоголю на організм людини. Етанова (оцтова) кислота, її молекулярна, структурна формули, фізичні властивості. Хімічні властивості: електролітична дисоціація, взаємодія з індикаторами, металами, лугами, солями. Застосування етанової кислоти. Поняття про вищі (насичені й ненасичені) карбонові кислоти. Мило, його склад, мийна дія. Жири. Склад жирів, фізичні властивості. Жири у природі. Гідрування жирів. Біологічна роль жирів. характеризує електронну будову молекули метану; склад, фізичні та деякі хімічні властивості метану, етену, етину, метанолу, етанолу, гліцеролу, етанової та аміноетанової кислот, жирів, глюкози, сахарози, крохмалю, целюлози, білків, поліетилену, хімічну суть фотосинтезу, моделювання як метод хімічної науки; обґрунтовує роль органічних сполук у живій природі; складає молекулярні й структурні формули метану та 9-ти його гомологів, етену, етину, метанолу, етанолу, гліцеролу, етанової та аміноетанової кислот; молекулярні формули глюкози, сахарози, крохмалю, целюлози; рівняння реакцій метану (повне і часткове окиснення, термічний розклад, хлорування), етену й етину (повне окиснення, приєднання водню і галогенів), метанолу, етанолу й гліцеролу (повне окиснення, взаємодія з активними металами), етанової кислоти (електролітична дисоціація, взаємодія з металами, лугами, солями),
Вуглеводи: глюкоза, сахароза, крохмаль, целюлоза. Молекулярні формули, фізичні властивості, поширення в природі. Полімерна будова крохмалю й целюлози. Якісні реакції на глюкозу і крохмаль. Окиснення вуглеводів; спиртове бродіння глюкози; гідроліз сахарози, крохмалю, целюлози. Застосування вуглеводів, їхня біологічна роль. Загальна схема виробництва цукру. Аміноетанова кислота, її молекулярна і структурна формули. Утворення дипептиду. Білки: склад і будова. Денатурація, кольорові реакції білків. Біологічна роль амінокислот і білків. Природні й синтетичні органічні сполуки. Застосування найважливіших органічних речовин. Захист довкілля від стійких забруднень органічного походження. глюкози (повне окиснення, спиртове бродіння), сахарози крохмалю й целюлози (взаємодія з водою); загальні схеми полімеризації етину, гідрування жирів, фотосинтезу, утворення і гідролізу ди-, трипептиду; збирає моделі молекул вуглеводнів; визначає дослідним шляхом гліцерол, етанову кислоту, глюкозу, крохмаль, білки (кольорові реакції); розв'язує розрахункові задачі вивчених типів на прикладі органічних сполук; оцінює згубну дію алкоголю на здоров'я; вплив продуктів синтетичної хімії на навколишнє середовище в разі неправильного використання їх; критично оцінює хімічну інформацію з різних джерел; висловлює судження щодо значення органічних речовин у суспільному господарстві, побуті, харчуванні, охороні здоров'я тощо; захисту довкілля від стійких органічних забруднювачів; дотримується правил безпечного поводження з горючими речовинами, побутовими хімікатами.
Схожі презентації
Категорії