Презентація на тему:
Процеси окиснення, відновлення. Окисники, відновники
Завантажити презентацію
Процеси окиснення, відновлення. Окисники, відновники
Завантажити презентаціюПрезентація по слайдам:
Запитання Що таке ступінь окиснення? Які правила необхідно згадати, щоб визначити ступінь окиснення атомів у речовині? Розрахуйте ступінь окиснення Нітрогену в сполуках: NH3, NO, N2 O3, NO2, HNO3, HNO2. Запишіть процеси передачі електронів, у результаті яких ступінь окиснення Нітрогену зміниться від 0 до –3; +3; +4. а) N0 + 3e− → N−3 б) N0 − 3e− → N+3 в) N0 − 4e− → N+4 Подумайте, у яких випадках ідеться про процеси окиснення. Подумайте, у яких випадках ідеться про процеси відновлення.
Окиснення, відновлення Окиснення — це процес віддачі електронів атомами (ступінь окиснення збільшується). Відновлення — це процес приєднання електронів атомами (ступінь окиснення зменшується). Розглянемо на простому прикладі: 2Fe2+3 O3−2 + 3C0 → 3C+4 O2−2 +4Fe0 Fe+3 +3e− → Fe0 C0 − 4e− → C+4 У цьому випадку C0 — відновник, а Fe2O3 — окисник.
Завдання 1 Допишіть рівняння, укажіть процеси окиснення й відновлення. Укажіть окисник і відновник 1) Mg + O 2 → 2) Al + Br2 → 3) Zn + H2 SO4 → 4) P + O 2 → 5) Mg + Cl2 → 6) Mg + HCl →
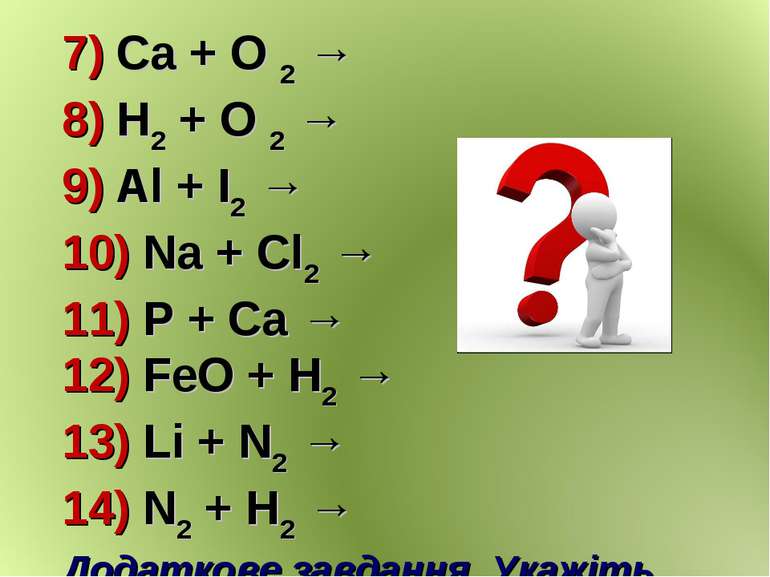
7) Ca + O 2 → 8) H2 + O 2 → 9) Al + I2 → 10) Na + Cl2 → 11) P + Ca → 12) FeO + H2 → 13) Li + N2 → 14) N2 + H2 → Додаткове завдання. Укажіть тип хімічної реакції.
Завдання 2 Сульфур може проявляти ступені окиснення –2, +4, +6. Наведіть приклади сполук Сульфуру й укажіть, окисні чи відновні властивості вони мають.
Самостійна робота Завдання. Допишіть ОВР, укажіть окисник і відновник, процеси відновлення й окиснення. Варіант І а) CH4 + O 2 → б) WO3 + H2 → в) Zn + HCl → г) Mg + HNO3 → Варіант ІІ а) H2 S + O 2 → б) Cr2 O 3 + H2 → в) Fe + HCl → г) Ca + HNO3 →
Домашнє завдання Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи. Творче завдання. Згадайте й наведіть приклади ОВР, з якими ми ознайомилися в курсах природознавства й хімії 7, 8 класу.
Схожі презентації
Категорії