Презентація на тему:
Основні положення МКТ
Завантажити презентацію
Основні положення МКТ
Завантажити презентаціюПрезентація по слайдам:
Зміст 1. Основні положення МКТ 1.1. Молекулярно-кінетична теорія 1.2. броунівський рух 1.3. дифузійний закон 1.4. тепловий рух 1.5. моль
Молекулярна фізика і термодинаміка Молекулярна фізика і термодинаміка - це по суті дві різні за своїми підходами, але тісно пов'язані науки, що займаються одним і тим же - вивченням макроскопічних властивостей фізичних систем, але абсолютно різними методами. В основі молекулярної фізики або молекулярно-кінетичної теорії лежать певні уявлення про будову речовини. Для встановлення законів поведінки макроскопічних систем, що складаються з величезного числа частинок, в молекулярній фізиці використовуються різні моделі речовини, наприклад, моделі ідеального газу. Молекулярна фізика є статистичною теорією, тобто теорією, яка розглядає поведінку систем, що складаються з величезного числа частинок (атомів, молекул), на основі імовірнісних моделей. Вона прагне на основі статистичного підходу встановити зв'язок між експериментально виміряними макроскопічними величинами (тиск, об'єм, температура і т.д.) і мікроскопічними характеристиками часток, що входять до складу системи (маса, імпульс, енергія і т.д.).
На відміну від молекулярно-кінетичної теорії, термодинаміка при вивченні властивостей макроскопічних систем не спирається ні на які уявлення про молекулярну структуру речовини. Термодинаміка є наукою феноменологічної. Вона робить висновки про властивості речовини на основі законів, встановлених на досвіді, таких, як закон збереження енергії. Термодинаміка оперує тільки з макроскопічними величинами (тиск, температура, об'єм тощо), які вводяться на основі фізичного експерименту. На відміну від молекулярно-кінетичної теорії, термодинаміка при вивченні властивостей макроскопічних систем не спирається ні на які уявлення про молекулярну структуру речовини. Термодинаміка є наукою феноменологічної. Вона робить висновки про властивості речовини на основі законів, встановлених на досвіді, таких, як закон збереження енергії. Термодинаміка оперує тільки з макроскопічними величинами (тиск, температура, об'єм тощо), які вводяться на основі фізичного експерименту. Обидва підходи - термодинамічний і статистичний - не суперечать, а доповнюють один одного. Тільки спільне використання термодинаміки і молекулярно-кінетичної теорії може дати найбільш повне уявлення про властивості систем, що складаються з великого числа частинок.
Основні положення МКТ Молекулярно-кінетичної теорією називають вчення про будову і властивості речовини на основі подання про існування атомів і молекул як найменших частинок хімічних речовин. В основі молекулярно-кінетичної теорії лежать три основних положення: Всі речовини - рідкі, тверді і газоподібні - утворені з найдрібніших частинок - молекул, які самі складаються з атомів («елементарних молекул»). Молекули хімічної речовини можуть бути простими і складними, тобто складатися з одного або декількох атомів. Молекули і атоми являють собою електрично нейтральні частинки. За певних умов молекули і атоми можуть набувати додатковий електричний заряд і перетворюватися на позитивні або негативні іони. Атоми і молекули перебувають у безперервному хаотичному русі. Частинки взаємодіють один з одним силами, що мають електричну природу. Гравітаційна взаємодія між частинками дуже мале.
Найбільш яскравим експериментальним підтвердженням уявлень молекулярно-кінетичної теорії про безладному русі атомів і молекул є броунівський рух. Це тепловий рух найдрібніших мікроскопічних частинок, зважених в рідині або газі. Воно було відкрите англійським ботаніком Р. Броуном в 1827 р. броунівський частинки рухаються під впливом безладних ударів молекул. Через хаотичного теплового руху молекул ці удари ніколи не врівноважують один одного. У результаті швидкість броунівський частинки безладно змінюється за модулем і напрямком, а її траєкторія являє собою складну зигзагоподібну криву (рис. 3.1.1). Теорія броунівського руху була створена А. Ейнштейном в 1905 р. Експериментально теорія Ейнштейна була підтверджена в дослідах французького фізика Ж. Перрена, проведених у 1908-1911 рр..
Головний висновок теорії А. Ейнштейна полягає в тому , що квадрат зміщення <r2> броунівський частинки від початкового положення , усереднений за багатьма броунівським частинкам , пропорційний часу спостереження t . Головний висновок теорії А. Ейнштейна полягає в тому , що квадрат зміщення <r2> броунівський частинки від початкового положення , усереднений за багатьма броунівським частинкам , пропорційний часу спостереження t . <r2> = Dt . Це співвідношення виражає так званий дифузійний закон. Як випливає з теорії коефіцієнт пропорційності D монотонно зростає із збільшенням температури. Постійне хаотичний рух молекул речовини проявляється також в іншому легко спостережуваному явищі - дифузії . Дифузією називається явище проникнення двох або декількох дотичних речовин один в одного. Найбільш швидко процес протікає в газі , якщо він неоднорідний за складом. Дифузія призводить до утворення однорідної суміші незалежно від щільності компонентів. Так , якщо в двох частинах посудини , розділених перегородкою , знаходяться кисень O2 і водень H2 , то після видалення перегородки починається процес взаємопроникнення газів один в одного , що призводить до утворення вибухонебезпечної суміші - гримучого газу. Цей процес йде і в тому випадку , коли легкий газ (водень ) знаходиться у верхній половині судини , а важчий ( віслород ) - у нижній.
Значно повільніше протікають подібні процеси в рідинах. Взаємопроникнення двох різнорідних рідин один в одного, розчинення твердих речовин в рідинах (наприклад, цукру у воді) і утворення однорідних розчинів - приклади дифузійних процесів в рідинах. Значно повільніше протікають подібні процеси в рідинах. Взаємопроникнення двох різнорідних рідин один в одного, розчинення твердих речовин в рідинах (наприклад, цукру у воді) і утворення однорідних розчинів - приклади дифузійних процесів в рідинах. У реальних умовах дифузія в рідинах і газах маскується більш швидкими процесами перемішування, наприклад, через виникнення конвекційних потоків. Найбільш повільно процес дифузії протікає в твердих тілах. Однак, досліди показують, що при контакті добре очищених поверхонь двох металів через тривалий час в кожному з них виявляється атоми іншого металу.
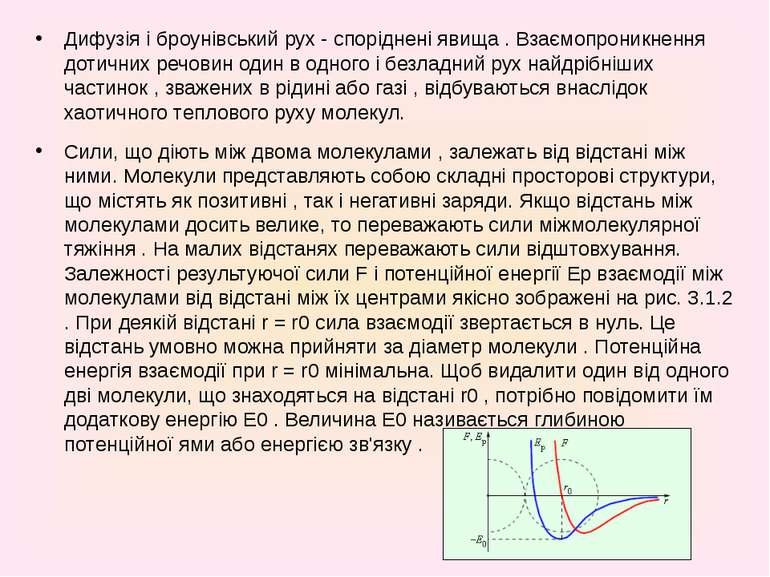
Дифузія і броунівський рух - споріднені явища . Взаємопроникнення дотичних речовин один в одного і безладний рух найдрібніших частинок , зважених в рідині або газі , відбуваються внаслідок хаотичного теплового руху молекул. Дифузія і броунівський рух - споріднені явища . Взаємопроникнення дотичних речовин один в одного і безладний рух найдрібніших частинок , зважених в рідині або газі , відбуваються внаслідок хаотичного теплового руху молекул. Сили, що діють між двома молекулами , залежать від відстані між ними. Молекули представляють собою складні просторові структури, що містять як позитивні , так і негативні заряди. Якщо відстань між молекулами досить велике, то переважають сили міжмолекулярної тяжіння . На малих відстанях переважають сили відштовхування. Залежності результуючої сили F і потенційної енергії Eр взаємодії між молекулами від відстані між їх центрами якісно зображені на рис. 3.1.2 . При деякій відстані r = r0 сила взаємодії звертається в нуль. Це відстань умовно можна прийняти за діаметр молекули . Потенційна енергія взаємодії при r = r0 мінімальна. Щоб видалити один від одного дві молекули, що знаходяться на відстані r0 , потрібно повідомити їм додаткову енергію E0 . Величина E0 називається глибиною потенційної ями або енергією зв'язку .
Молекули мають надзвичайно малі розміри. Прості одноатомні молекули мають розмір порядку 10-10 м. Складні багатоатомні молекули можуть мати розміри в сотні і тисячі разів більше. Молекули мають надзвичайно малі розміри. Прості одноатомні молекули мають розмір порядку 10-10 м. Складні багатоатомні молекули можуть мати розміри в сотні і тисячі разів більше. Безладне хаотичне рух молекул називається тепловим рухом. Кінетична енергія теплового руху зростає зі зростанням температури. При низьких температурах середня кінетична енергія молекули може виявитися менше глибини потенційної ями E0. У цьому випадку молекули конденсуються в рідке або тверде речовина; при цьому середня відстань між молекулами буде приблизно дорівнює r0. При підвищенні температури середня кінетична енергія молекули стає більше E0, молекули розлітаються, і утворюється газоподібна речовина. У твердих тілах молекули здійснюють безладні коливання близько фіксованих центрів (положень рівноваги). Ці центри можуть бути розташовані в просторі нерегулярним чином (аморфні тіла) або утворювати впорядковані об'ємні структури (кристалічні тіла).
У рідинах молекули мають значно більшу свободу для теплового руху. Вони не прив'язані до певних центрам і можуть переміщатися по всьому об'єму. Цим пояснюється плинність рідин. Близько розташовані молекули рідини також можуть утворювати впорядковані структури, що містять кілька молекул. Це явище називається ближнім порядком на відміну від далекого порядку, характерного для кристалічних тіл. У рідинах молекули мають значно більшу свободу для теплового руху. Вони не прив'язані до певних центрам і можуть переміщатися по всьому об'єму. Цим пояснюється плинність рідин. Близько розташовані молекули рідини також можуть утворювати впорядковані структури, що містять кілька молекул. Це явище називається ближнім порядком на відміну від далекого порядку, характерного для кристалічних тіл. У газах відстані між молекулами зазвичай значно більше їх розмірів. Сили взаємодії між молекулами на таких великих відстанях малі, і кожна молекула рухається вздовж прямої лінії до чергового зіткнення з іншою молекулою або зі стінкою посудини. Середня відстань між молекулами повітря при нормальних умовах близько 10-8 м, тобто в десятки разів перевищує розмір молекул. Слабка взаємодія між молекулами пояснює здатність газів розширюватися і заповнювати весь об'єм посудини. У межі, коли взаємодія прагне до нуля, ми приходимо до уявлення про ідеальному газі.
У молекулярно-кінетичної теорії кількість речовини прийнято вважати пропорційним числу часток. Одиниця кількості речовини називається молем (моль). У молекулярно-кінетичної теорії кількість речовини прийнято вважати пропорційним числу часток. Одиниця кількості речовини називається молем (моль). Моль - це кількість речовини, що містить стільки ж частинок (молекул), скільки міститься атомів у 0,012 кг вуглецю 12C. Молекула вуглецю складається з одного атома. Таким чином, в одному молі будь-якої речовини міститься одне і те ж число часток (молекул). Це число називається постійної Авогадро N А: N А = 6,02 · 1023 моль-1. Постійна Авогадро - одна з найважливіших постійних в молекулярно-кінетичної теорії. Кількість речовини ν визначається як відношення числа N частинок (молекул) речовини до постійної Авогадро N А:
Масу одного моля речовини прийнято називати молярної масою M. Молярна маса дорівнює добутку маси m0 однієї молекули даної речовини на постійну Авогадро: Масу одного моля речовини прийнято називати молярної масою M. Молярна маса дорівнює добутку маси m0 однієї молекули даної речовини на постійну Авогадро: M = N А · m0. Молярна маса виражається в кілограмах на моль (кг / моль). Для речовин, молекули яких складаються з одного атома, часто використовується термін атомна маса. За одиницю маси атомів і молекул приймається 1/12 маси атома ізотопу вуглецю 12C (з масовим числом 12). Вона називається атомною одиницею маси (а. е. м.): 1 а. е. м. = 1,66 · 10-27 кг.
Ця величина майже збігається з масою протона або нейтрона. Відношення маси атома або молекули даної речовини до 1/12 маси атома вуглецю 12C називається відносною масою. Ця величина майже збігається з масою протона або нейтрона. Відношення маси атома або молекули даної речовини до 1/12 маси атома вуглецю 12C називається відносною масою. Модель. дифузія газів
Список сайтів http://physics.ru/courses/op25part1/content/chapter3/section/paragraph1/theory.html
Схожі презентації
Категорії