Презентація на тему:
"Основні класи неорганічних сполук"
Завантажити презентацію
"Основні класи неорганічних сполук"
Завантажити презентаціюПрезентація по слайдам:
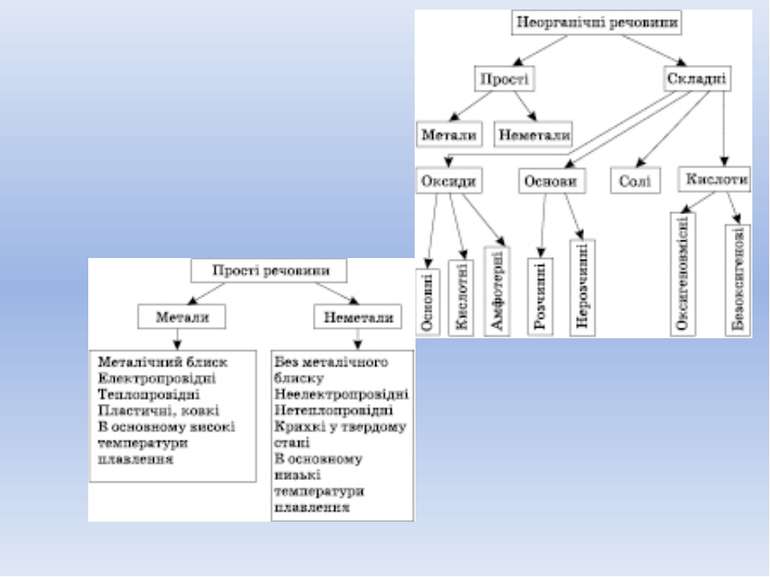
Оксиди Оксиди — складні речовини, утворені двома елементами, одним із яких є Оксиген. Їх назва складається зі слова «оксид» з додаванням спочатку назви елемента, що входить до складу речовини, у називному відмінку.
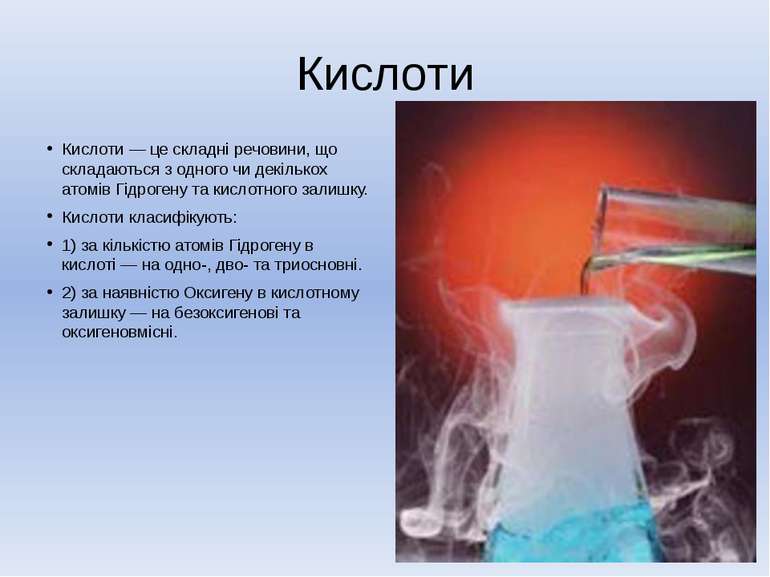
Кислоти Кислоти — це складні речовини, що складаються з одного чи декількох атомів Гідрогену та кислотного залишку. Кислоти класифікують: 1) за кількістю атомів Гідрогену в кислоті — на одно-, дво- та триосновні. 2) за наявністю Оксигену в кислотному залишку — на безоксигенові та оксигеновмісні.
Одержання кислот 1) Оксигеновмісні розчинні у воді кислоти можна добути взаємодією оксидів з водою: 2) Оксигеновмисні нерозчинні у воді кислоти добувають взаємодією відповідної солі з більш сильною кислотою: 3) Безкисневі кислоти добувають взаємодією водню з неметалом: з наступним розчиненням продукту реакції у воді.
Фізичні властивості кислот Більшість кислот — рідини, але є і тверді кислоти, наприклад ортофосфатна і метафосфатна, силікатна. Усі кислоти важчі за воду й у більшості випадків добре в ній розчиняються. Деякі леткі кислоти (хлоридна, нітратна) мають характерний запах. Майже всі кислоти безбарвні.
Хімічні властивості кислот 1) Дія на індикатори. Речовини, які змінюють своє забарвлення під дією кислот або лугів, називаються індикаторами. 2) Взаємодія з металами. Метали, що стоять у ряді напруг до Гідрогену, витісняють його з розведених кислот (крім нітратної кислоти): 3) Кислоти реагують з оксидами, що утворені металами: Реакції обміну — це реакції між двома складними речовинами, у результаті яких вони обмінюються своїми складовими частинами. 4) Кислоти реагують з основами:
Основи Основи — складні речовини, до складу яких входять атом металу й одна або кілька гідроксильних груп. Назви основ утворюються від назви відповідного металу в називному відмінку і слова «гідроксид»: NaOH — натрій гідроксид; Застосовуються й інші традиційні назви: NaOH — їдкий натр; Основи класифікуються за розчинністю у воді: 1) на розчинні, або луги, — добуті лужними або лужноземельними металами: Li, Na, K, Rb, Cs, Ba, Sr, Ca; 2) нерозчинні — всі інші основи.
Фізичні властивості основ За нормальних умов усі луги — тверді речовини білого кольору, милкі на дотик, їдкі, роз’їдають шкіру, тканини, папір. Нерозчинні основи — тверді речовини різного кольору.
1) Луги добувають: — взаємодією води з лужними або лужноземельними металами: — взаємодією води з оксидами лужних і лужноземельних металів: BaO + 2H2O = Ba(OH)2 2) Нерозчинні основи добувають унаслідок взаємодії розчинних солей з лугами:
Хімічні властивості основ 1) Луги мають такі хімічні властивості: — змінюють забарвлення індикаторів: фенолфталеїну без кольору на малинове, метилового оранжевого на жовте, фіолетового лакмусу на синє, універсального індикаторного паперу на синє; взаємодіють із кислотними оксидами: — взаємодіють із кислотами: — реагують із солями: 2) Нерозчинні основи мають такі хімічні властивості: — не змінюють забарвлення індикаторів; — практично не взаємодіють із кислотними оксидами; — взаємодіють із кислотами: — розкладаються при нагріванні: Реакція взаємодії кислот з основами називається реакцією нейтралізації і належить до реакцій обміну.
Амфотерні гідроксиди та оксиди Здатність хімічних речовин виявляти кислотні або основні властивості в залежності від природи речовини, з якою вони реагують, називається амфотерністю. Амфотерні властивості виявляють перехідні метали, їхні оксиди та гідроксиди, наприклад: цинк, алюміній, берилій, тривалентний хром і тривалентне залізо, їхні оксиди і гідроксиди тощо.
Хімічні властивості амфотерних речовин Характерною є взаємодія амфотерних речовин як із кислотами, так і з основами: а також реакції з цинк гідроксидом:
Солі Солі — це складні речовини, утворені атомами металів і кислотними залишками. Назви солей складаються з назви металу і назви кислотного залишку. Фізичні властивості солей За нормальних умов усі солі — тверді кристалічні речовини різного кольору. Розчинність їх у воді різна
Хімічні властивості солей Солі взаємодіють: 1) З металами (реакція заміщення): 2) Розчинні солі з лугами (реакція обміну): 3) З кислотами (реакція обміну). Ця реакція відбувається за таких умов: — утворюється осад, нерозчинний у кислотах: — реагуюча кислота сильніша від тієї, яка утворила сіль: — сіль утворена леткою кислотою, а реагуюча кислота нелетка: Кислота нестійка, тому при її утворенні відразу ж відбувається реакція розкладу. Наприклад: Зазвичай це записується так: 4) Із солями (реакція обміну): NaCl + AgNO3 = NaNO3 + AgCl
Схожі презентації
Категорії