Презентація на тему:
Окисно-відновні реакції, процеси окиснення і відновлення, окисники і відновники.
Завантажити презентацію
Окисно-відновні реакції, процеси окиснення і відновлення, окисники і відновники.
Завантажити презентаціюПрезентація по слайдам:
Кросворд на тему «Типи хімічних реакцій» Жукова О.В. Новоукраїнська ЗШ №8 Кіровоградська обл. 1. Речовини, що вступають в реакцію. По горизонталі: 2. Речовина, що утворюється в результаті реакції сполучення. 3. Одна із умов протікання реакції обміну 4. Тип реакції, що відбувається між металом і кислотою. 5. Хімічні реакції, під час яких дві складні речовини обмінюються своїми складовими частинами, утворюючи дві нові речовини. 1. Реакції, за яких з однієї складної речовини утворюється кілька більш простих. По вертикалі: 6. Речовина, утворення якої є однією з умов протікання реакції обміну до кінця. 7. Реакція між основою і кислотою. 9. Речовина, що складається з атомів одного хімічного елемента. 8. Хімічні реакції, за яких з двох або кількох речовин утворюється одна складна. 6 7 1 8 2 3 9 4 5
Мета: розглянути класифікацію реакцій за зміною ступенів окиснення; познайомитися з окисно-відновними реакціями, процесами окиснення і відновлення; навчитися прогнозувати окисно-відновні властивості речовин.
Пригадаємо! Жукова О.В. Новоукраїнська ЗШ №8 Кіровоградська обл. Жукова О.В. Новоукраїнська ЗШ №8 Кіровоградська обл.
Що називається ступеню окиснення? Ступінь окиснення – це умовний заряд атома в речовині, який виник би на атомі за умови, що спільні електронні пари повністю змістилися б до більш електронегативного елемента. Які значення має ступінь окиснення? Додатне, від'ємне, нульове. Як визначається ступінь окиснення? Визначте ступінь окиснення елементів у речовинах: N2, NaCl, H2SO4. Жукова О.В. Новоукраїнська ЗШ №8 Кіровоградська обл. Жукова О.В. Новоукраїнська ЗШ №8 Кіровоградська обл.
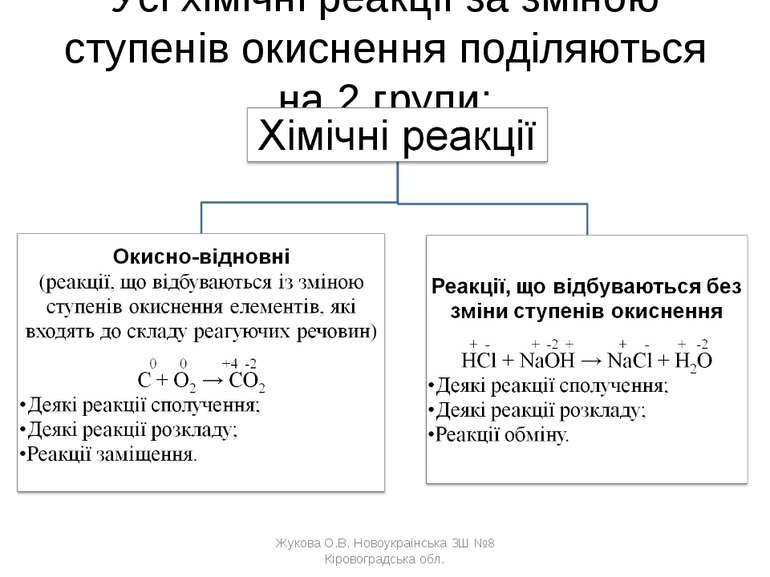
Усі хімічні реакції за зміною ступенів окиснення поділяються на 2 групи: Жукова О.В. Новоукраїнська ЗШ №8 Кіровоградська обл. Жукова О.В. Новоукраїнська ЗШ №8 Кіровоградська обл.
Які реакції називаються окисно-відновними? Окисно-відновні реакції - реакції, що відбуваються із зміною ступенів окиснення елементів, які входять до складу реагуючих речовин. Жукова О.В. Новоукраїнська ЗШ №8 Кіровоградська обл. Жукова О.В. Новоукраїнська ЗШ №8 Кіровоградська обл.
Алгоритм складання окисно – відновних реакцій Розставляємо ступені окиснення елементів. Визначаємо елементи, що змінили ступені окиснення. Виписуємо ці елементи. Визначаємо зміну кількості електронів за ступенем окиснення елементів. Складаємо електронний баланс. Проставляємо коефіцієнти в рівнянні реакції. Визначаємо окисник і відновник, процеси окиснення та відновлення. Жукова О.В. Новоукраїнська ЗШ №8 Кіровоградська обл. Жукова О.В. Новоукраїнська ЗШ №8 Кіровоградська обл.
Знайдіть в підручнику с. 87 - 88 Н.М. Буринська. Хімія 9 кл визначення: Відновники – атоми, молекули або йони, що віддають електрони. Окисники - атоми, молекули або йони, що приєднують електрони. Відновлення – процес приєднання електронів. Окиснення - процес віддавання електронів. Жукова О.В. Новоукраїнська ЗШ №8 Кіровоградська обл. Відновники Окисники Відновлення Окиснення Жукова О.В. Новоукраїнська ЗШ №8 Кіровоградська обл.
Схема взаємозв’язку змін ступенів окиснення з процесами окиснення і відновлення Відновлення – ступінь окиснення зменшується (+℮) -4, -3, -2, -1, 0, +1, +2, +3, +4, +5, +6, +7, +8 Окиснення – ступінь окиснення збільшується (-℮) Жукова О.В. Новоукраїнська ЗШ №8 Кіровоградська обл. Жукова О.В. Новоукраїнська ЗШ №8 Кіровоградська обл.
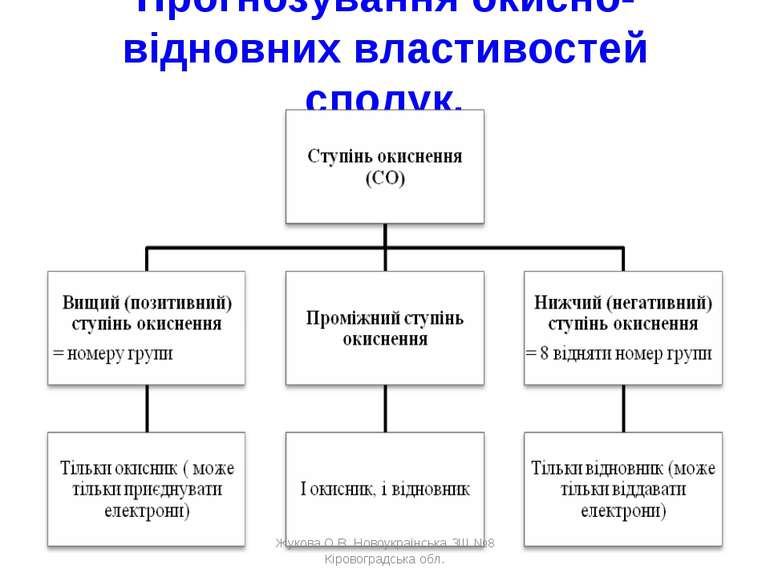
Прогнозування окисно-відновних властивостей сполук. Жукова О.В. Новоукраїнська ЗШ №8 Кіровоградська обл. Жукова О.В. Новоукраїнська ЗШ №8 Кіровоградська обл.
Приклад 1 до схеми 2 Cl -1, 0, +1, +3, +5, +7 лише і окисник, і лише окисник відновник відновник (найвищий СО) (найнижчий СО) Приклад 2 до схеми 2 S -2, 0, +2, +4, +6 лише і окисник, і лише окисник відновник відновник (найвищий СО) (найнижчий СО) Жукова О.В. Новоукраїнська ЗШ №8 Кіровоградська обл. Жукова О.В. Новоукраїнська ЗШ №8 Кіровоградська обл.
Закріпи свої знання! Жукова О.В. Новоукраїнська ЗШ №8 Кіровоградська обл. Жукова О.В. Новоукраїнська ЗШ №8 Кіровоградська обл.
Спрогнозуйте окисно-відновні властивості нижче наведених сполук і розподіліть їх у таблиці N2, CO2, O2, N2O5, NH3, H2SO4конц., SO2, H2S, H2SO3, Zn. Жукова О.В. Новоукраїнська ЗШ №8 Кіровоградська обл. Тільки окисник Тільки відновник І окисник, і відновник
Установіть відповідність між схемою перетворення та кількістю електронів, відданих або приєднаних атомами, вкажіть окисник і відновник, процеси окиснення та відновлення. А) Р0 → Р─3 ; 1.+ 4е─ Б) S┼6 → S─2 ; 2. ─4е─ В) Fe┼2 → Fe┼ 3; 3.+ 8е─ Г) Cl20 → 2Cl─; 4. + 3е─ Д) N2 → 2N┼2 5. + 2е─ 6. ─1е─ Жукова О.В. Новоукраїнська ЗШ №8 Кіровоградська обл. А Б В Г Д
Творче завдання Вкажіть, як називається вказаний процес і скільки електронів бере в ньому участь 2О─2 → О2, Напишіть кілька рівнянь реакцій, в яких може відбуватися даний процес.
Домашнє завдання: § 14 (с. 86-88) Хімія 9 кл Н.М. Буринська Впр. 6 с. 91 Жукова О.В. Новоукраїнська ЗШ №8 Кіровоградська обл. Жукова О.В. Новоукраїнська ЗШ №8 Кіровоградська обл.
Схожі презентації
Категорії