Презентація на тему:
Номенклатура насичених вуглеводнів
Завантажити презентацію
Номенклатура насичених вуглеводнів
Завантажити презентаціюПрезентація по слайдам:
План Визначення. Загальна формула насичених вуглеводнів. Гомологічний ряд. Види ізомерії. Номенклатура насичених вуглеводнів. Будова молекул насичених вуглеводнів. Фізичні властивості. Способи добування. Хімічні властивості. Застосування.
Насичені вуглеводні (алкани, парафіни) Насичені вуглеводні – органічні сполуки, в молекулах яких всі атоми карбону сполучені одинарними зв’язками (σ-) і відповідають загальній формулі: СnH2n+2
Гомологічний ряд метану СН4 метан С2H6 етан C3H8 пропан C4H10 бутан C5H12 пентан C6H14 гексан C7H16 гептан C8H18 октан C9H20 нонан C10H22 декан Гомологи – речовини, які мають подібну будову і властивості і відрізняються на одну і більше груп СH2.
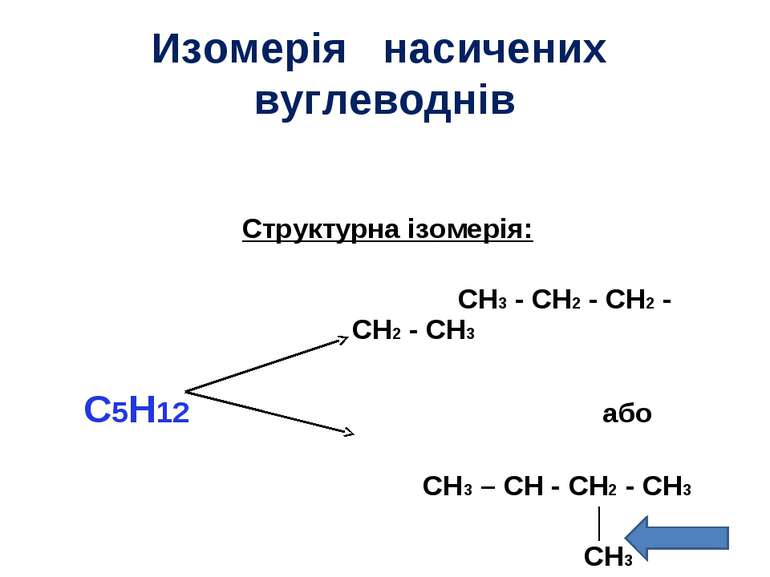
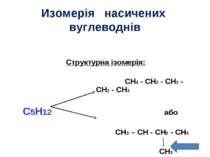
Изомерія насичених вуглеводнів Структурна ізомерія: CH3 - CH2 - CH2 - CH2 - CH3 C5H12 або CH3 – CH - CH2 - CH3 │ CH3
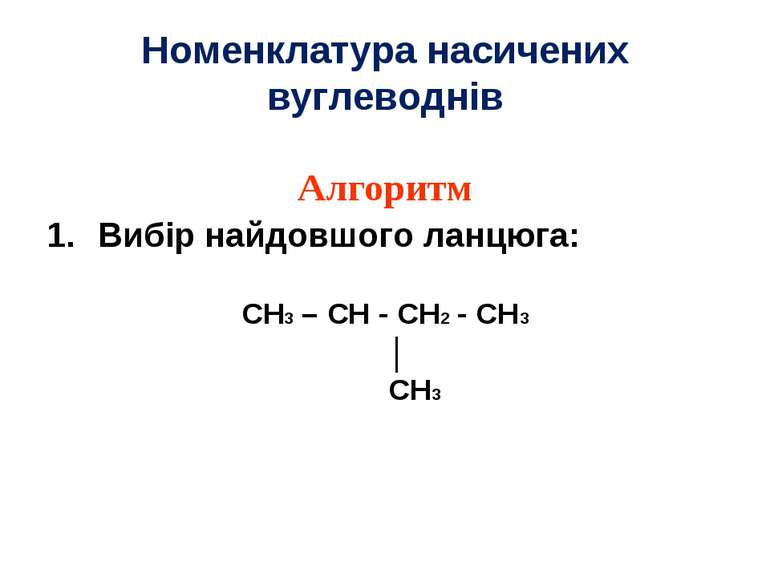
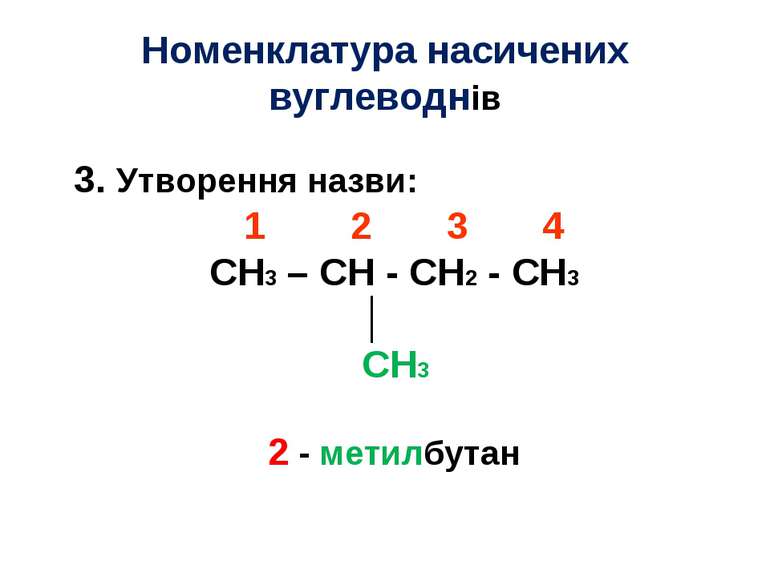
Номенклатура насичених вуглеводнів Алгоритм Вибір найдовшого ланцюга: CH3 – CH - CH2 - CH3 │ CH3
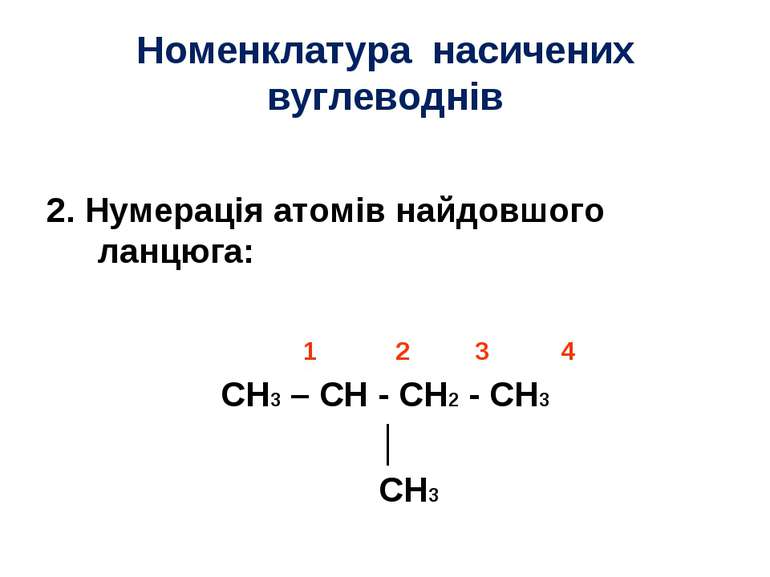
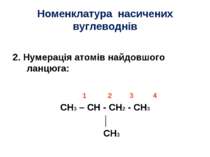
Номенклатура насичених вуглеводнів 2. Нумерація атомів найдовшого ланцюга: 1 2 3 4 CH3 – CH - CH2 - CH3 │ CH3
Номенклатура насичених вуглеводнів 3. Утворення назви: 1 2 3 4 CH3 – CH - CH2 - CH3 │ CH3 2 - метилбутан
Радикал –це частинка, що має неспарені електрони. Число Назва числа Формула радикала Назва радикала 1 Моно- -СН3 Метил 2 Ди- -С2Н5 Етил 3 Три- -С3Н7 Пропил 4 Тетра- -С4Н9 Бутил 5 Пента- -С5Н11 Пентил
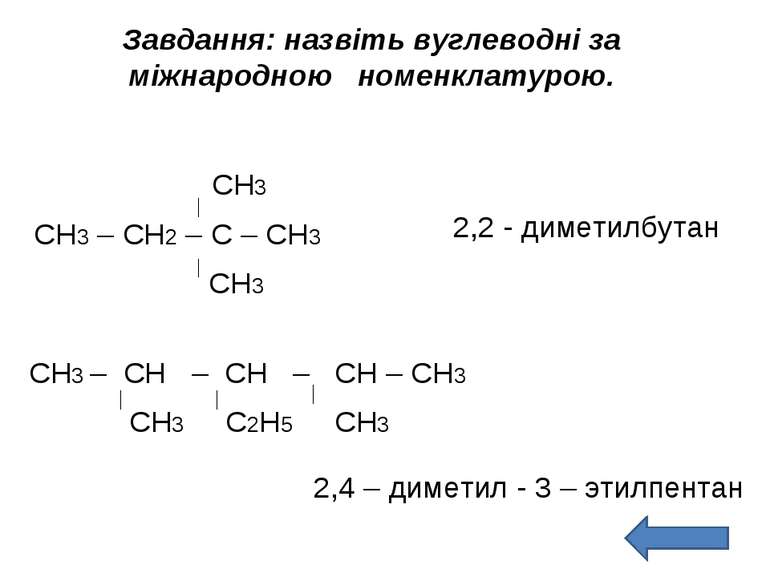
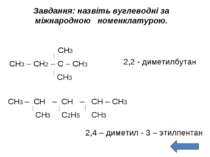
Завдання: назвіть вуглеводні за міжнародною номенклатурою. СН3 СН3 – СН2 – С – СН3 СН3 2,2 - диметилбутан СН3 – СН – СН – СН – СН3 СН3 С2Н5 СН3 2,4 – диметил - 3 – этилпентан
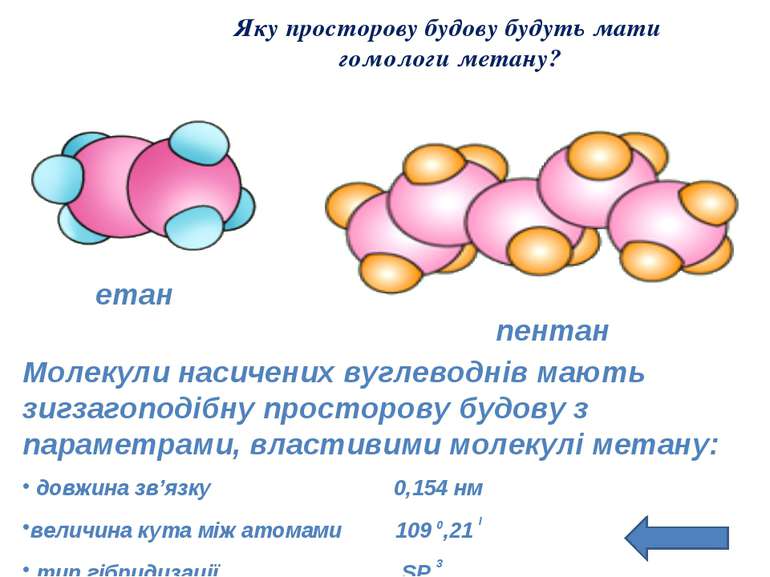
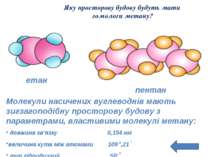
Яку просторову будову будуть мати гомологи метану? етан пентан Молекули насичених вуглеводнів мають зигзагоподібну просторову будову з параметрами, властивими молекулі метану: довжина зв’язку 0,154 нм величина кута між атомами 109 0,21 I тип гібридизації SP 3
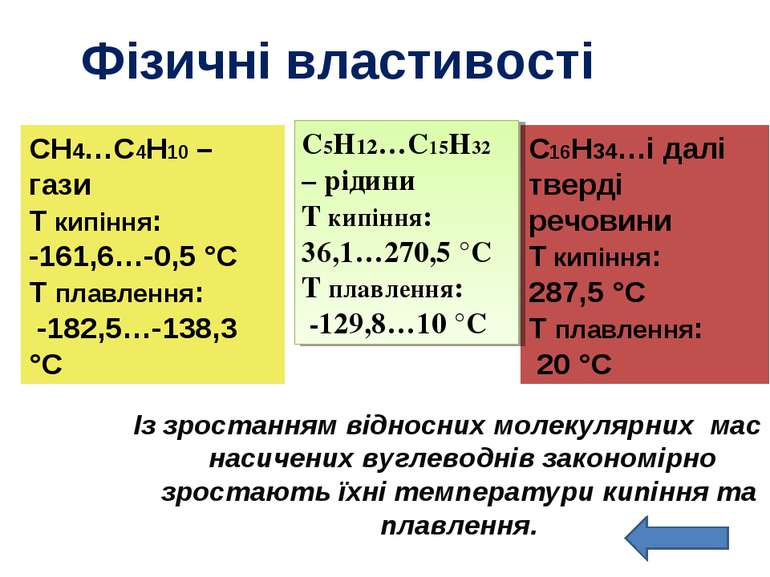
Фізичні властивості Із зростанням відносних молекулярних мас насичених вуглеводнів закономірно зростають їхні температури кипіння та плавлення. СН4…C4Н10 – гази T кипіння: -161,6…-0,5 °C T плавлення: -182,5…-138,3 °C С16Н34…і далі тверді речовини T кипіння: 287,5 °C T плавлення: 20 °C С5Н12…C15Н32 – рідини T кипіння: 36,1…270,5 °C T плавлення: -129,8…10 °C
1. Добування вуглеводнів з природньої сировини 2. Гідруванням циклопарафінів та ненасичених вуглеводнів 4. Синтез Вюрца 5. Гідроліз карбідів 3. Розкладання натрієвих солей карбонових кислот
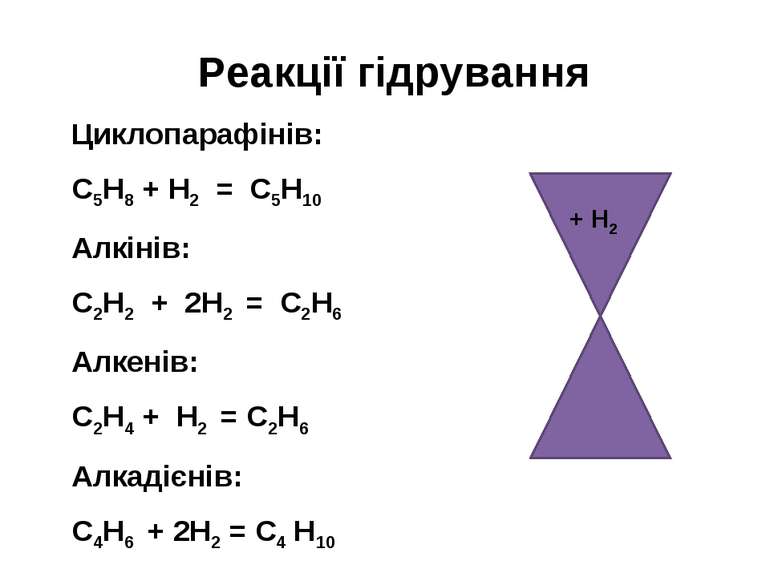
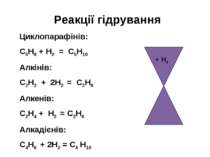
Реакції гідрування Циклопарафінів: С5Н8 + Н2 = С5Н10 Алкінів: С2Н2 + 2Н2 = С2Н6 Алкенів: С2Н4 + Н2 = С2Н6 Алкадієнів: С4Н6 + 2Н2 = С4 Н10 + Н2
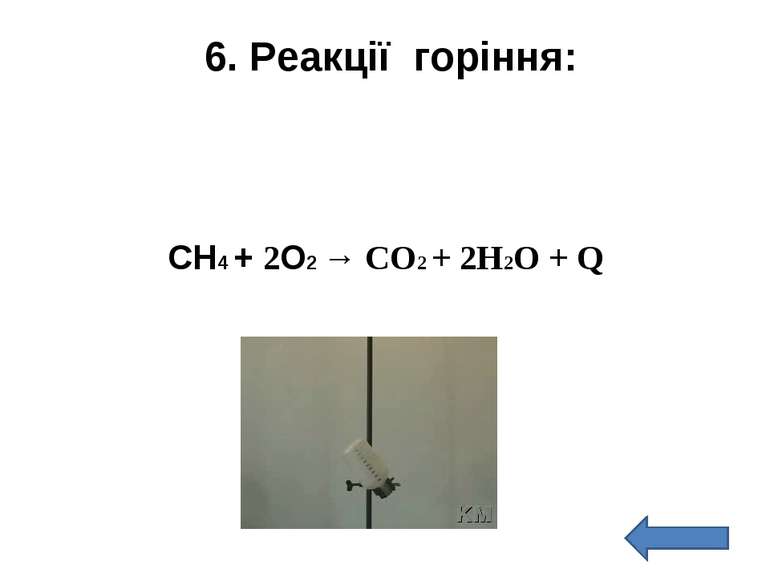
Добування метану при взаємодії ацетату натрію з лугом: t C CH3COONa + NaOH CH4 + Na2CO3 ацетат натрію метан Властивості метану: 1) метан не знебарвлює водний розчин KMnO4; 2) метан не знебарвлює бромну воду; 3) горіння метану: CH4 + 2О2 СО2 + 2Н2О + Q
Синтез Вюрца здійснюють для отримання вуглеводнів з більш довгими ланцюгами Приклад: добування етану з метану 1 етап. Галогенування відповідного вуглеводню СН4 + Сl2 = CH3Cl + HCl 2 етап. Взаємодія з натрієм 2CH3Cl + 2Na = C2H6 + 2NaCl
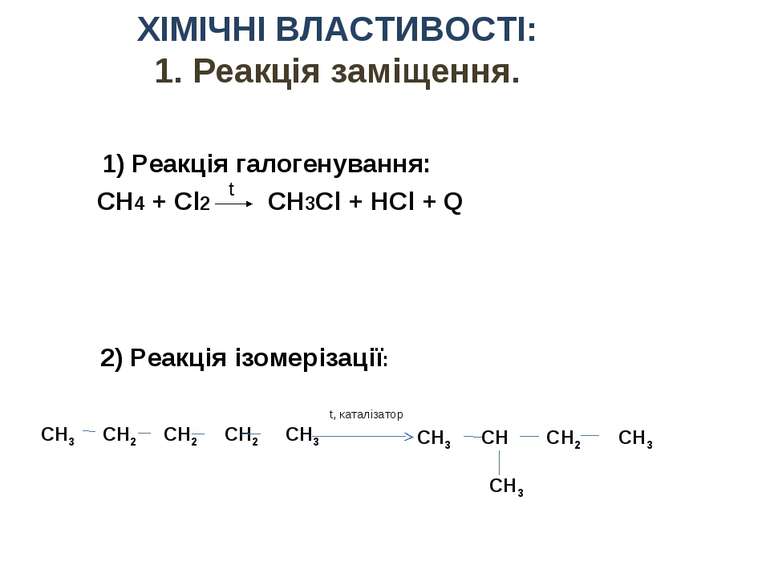
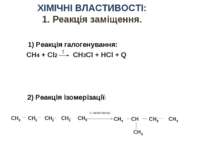
СН4 + Сl2 CH3Cl + HCl + Q t ХІМІЧНІ ВЛАСТИВОСТІ: 1. Реакція заміщення. 1) Реакція галогенування: 2) Реакція ізомерізації: СН3 СН СН2 СН3 СН3 t, каталізатор
СН4 + Н2О СО + 3Н2 800°С синтез-газ 2СН4 Н С ≡ С Н + 3Н2 + Q 1500°С СН3 СН3 Н2С = СН2 + Н2 + Q С3Н8 + 5О2 3СО2 + 4Н2О + Q В присутності каталізаторів окиснюються: СН4 + О2 500°С, каталізатор Н С О Н + Н2О + Q
Добування ацетилену Паливо для дизельних та турбореактивних двигунів Добування розчинників В металургії А також як сировина для синтезу спиртів, альдегідів і кислот.
Застосування ненасичених вуглеводнів 1-3 – виробництво сажі; (1 – картриджі; 2 – гума; 3 – друкарська фарба; 4-7 – добування органічних речовин (4 – розчинників; 5 – холодагентів, для холодильних установок; 6 – метанолу; 7 - ацетилену).
Які вуглеводні відносяться до алканів? Запишіть можливі ізомери гексану, назвіть їх. Напишіть рівняння реакції ізомерізації гептану. 4. В якому співвідношенні суміш метану і кисню стає вибухонебезпечною? 5. Які природні джерела добування насичених вуглеводнів? 6. Назвіть галузі застосування насичених вуглеводнів.
Схожі презентації
Категорії