Презентація на тему:
"Металічні елементи та їхні сполуки"
Завантажити презентацію
"Металічні елементи та їхні сполуки"
Завантажити презентаціюПрезентація по слайдам:
Практична робота з хімії “Металічні елементи та їхні сполуки” Виконала учениця 10-А класу Ковальова Анастасія
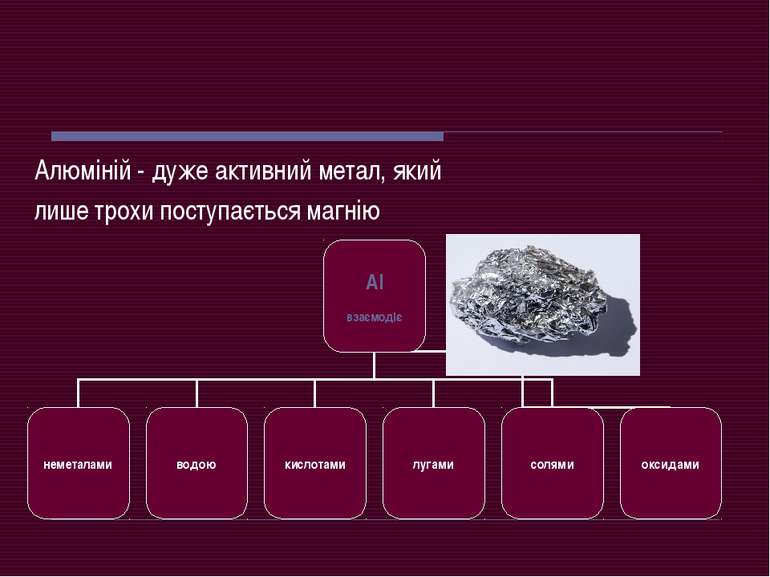
Реакції з неметалами Із більшістю неметалів алюміній взаємодіє при нагріванні, а з хлором і бромом – за звичайних умов (при нагріванні) (у дрібному стані та за високою температурою) (за звичайних умов)
Реакція з водою Алюміній не взаємодіє з водою ( навіть киплячою) через наявність на поверхні металу щільної плівки оксиду. Якщо цю плівку зруйнувати (нанесенням ртуті), то починається реакція алюмінію з водою:
Реакції з кислотами Взаємодіє з більшістю кислот, крім дуже слабких (карбонатної, сульфідної, силікатної) (за звичайних умов) при нагріванні
Реакції з лугами Алюміній – амфотерний метал, він легко реагує з лугами: у розчинні з утворенням тетрагідроксодіакваалюміната натрію при розплаві з утворенням алюмінатів
Реакції з оксидами Алюміній взаємодіє з оксидами багатьох металічних елементів. Реакції починаються за високої температури й супроводжуються виділенням великої кількості теплоти. У кожному випадку утворюються алюміній оксид та інший метал
За допомогою цих реакцій на металургійних заводах добувають манган, хром, ванадій, кальцій. Такий метод називається – алюмотермія
Висновок Отже, Алюміній – це дуже активний метал, який реагує з:неметалами, водою, кислотами, лугами, солями, оксидами. Хімічні властивості алюмінію дуже широко використовують у металургії, а його сплави у авіаційній і космічній техніці. А за обсягом виробництва він посідає 2 місце після заліза
Схожі презентації
Категорії