Презентація на тему:
кристали
Завантажити презентацію
кристали
Завантажити презентаціюПрезентація по слайдам:
дати поняття про кристалічні ґратки познайомити з різними типами кристалічних ґраток (атомні, молекулярні, йонні) розкрити зв'язок між типом хімічного зв’язку, типом кристалічних ґраток і фізичними властивостями речовин визначити особливості будови твердих речовин та встановити залежність властивостей речовин від їхньої будови
Знати: поняття кристалічні гратки,типи кристалічних ґраток Уміти: визначати типи кристалічних краток, прогнозувати властивості речовин залежно від виду хімічного зв'язку і типу кристалічних ґраток. Розуміти: залежність фізичних властивостей речовин від їх кристалічної будови;
У кристаллической решётки свой секрет: Она строга, математически стройна и поэтична. На все вопросы у неё всегда готов ответ: Строенье – главное, а свойства вещества – вторичны.
1. Йонний зв’язок виникає між йонами. 2. Йони – це нейтральні частинки. 3. Йони – це заряджені частинки. 4. Ковалентний зв’язок буває двох типів – полярний і неполярний. 5. Ковалентний полярний зв’язок утворюється між атомами з однаковою електронегативністю. 6. Ковалентний неполярний зв’язок утворюється між атомами одного і того ж неметалу. 7. Ковалентний неполярний зв’язок утворюється між атомами з різною електронегативністю. 8. NaCl – сполука з йонним зв’язком. 9. О2 – сполука з ковалентним полярним зв’язком. 10. HCl –сполука з йонним зв’язком.
1. Йонний зв’язок виникає між йонами (так). 2. Йони – це нейтральні частинки (ні). 3. Йони – це заряджені частинки (так ). 4. Ковалентний зв’язок буває двох типів – полярний і неполярний (так). 5. Ковалентний полярний зв’язок утворюється між атомами з однаковою електронегативністю (ні). 6. Ковалентний неполярний зв’язок утворюється між атомами одного і того ж неметалу (так). 7. Ковалентний неполярний зв’язок утворюється між атомами з різною електронегативністю (ні). 8. NaCl – сполука з йонним зв’язком (так). 9. О2 – сполука з ковалентним полярним зв’язком (ні). 10. HCl –сполука з йонним зв’язком (ні).
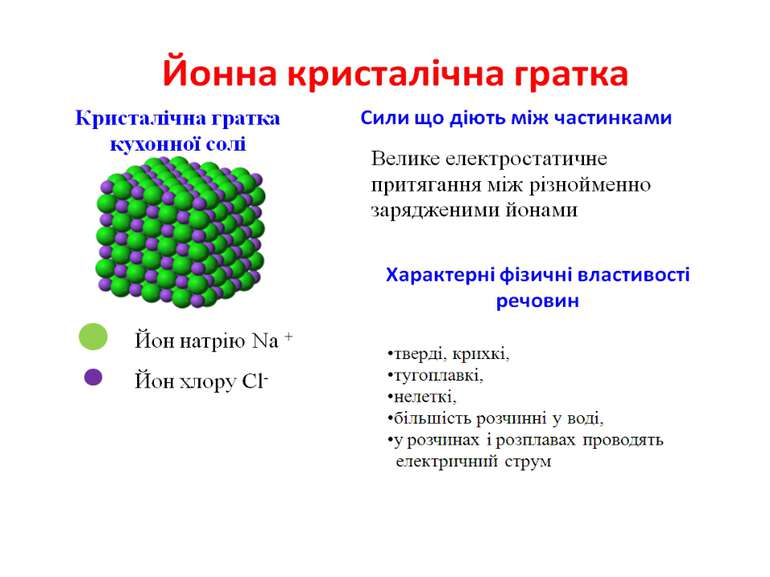
Моделі кристалічних ґраток різних типів Натрій хлорид — твердий, кристалічний, тугоплавкий, добре розчинний у воді. Хімічний зв’язок — йонний, у вузлах кристалічних ґраток знаходяться йони Натрію і Хлору, які утримуються силами кулонівського притягання. Такий тип кристалічних ґраток називається йонний.
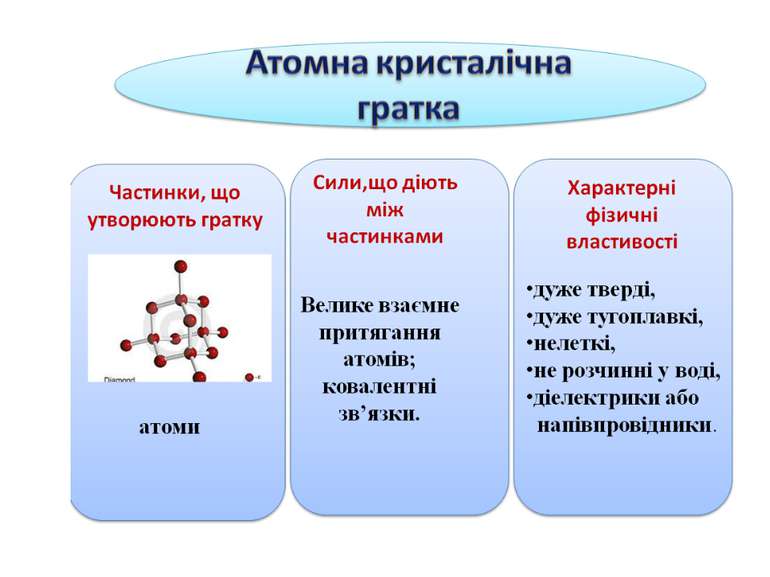
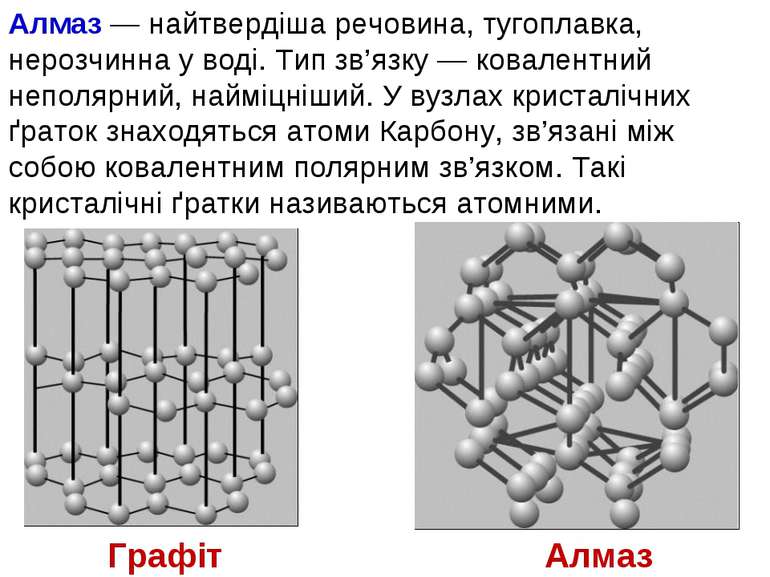
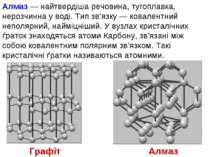
Алмаз — найтвердіша речовина, тугоплавка, нерозчинна у воді. Тип зв’язку — ковалентний неполярний, найміцніший. У вузлах кристалічних ґраток знаходяться атоми Карбону, зв’язані між собою ковалентним полярним зв’язком. Такі кристалічні ґратки називаються атомними. Алмаз Графіт
Карбон (IV) оксид — за нормальних умов газ, низькі температури плавлення й кипіння, розчинний у воді. У твердому стані у вузлах кристалічних ґраток знаходяться молекули вуглекислого газу. Зв’язок між вузлами кристалічних ґраток — міжмолекулярна взаємодія. Такі кристалічні ґратки називаються молекулярними.
Практика без теорії сліпа, теорія без практики мертва. . Кожна гіпотеза тільки тоді стає теорією, коли вона перевірена практикою.
Інструкція з визначення типу кристалічної ґратки Визначити до якої групи відноситься дана речовина: Проста речовина – визначити метал чи неметал: Ме – мають металічну кристалічну гратку; неМе – мають молекулярну кристалічну гратку; винятки – деякі неМе мають атомну кристалічну гратку. Складна речовина – визначити клас речовини: МехОу – йонну кристалічну гратку; неМехОу – молекулярну кристалічну гратку; Ме(ОН)х – йонну кристалічну гратку НхAn – йонну кристалічну гратку; MeхAnу – йонну кристалічну гратку.
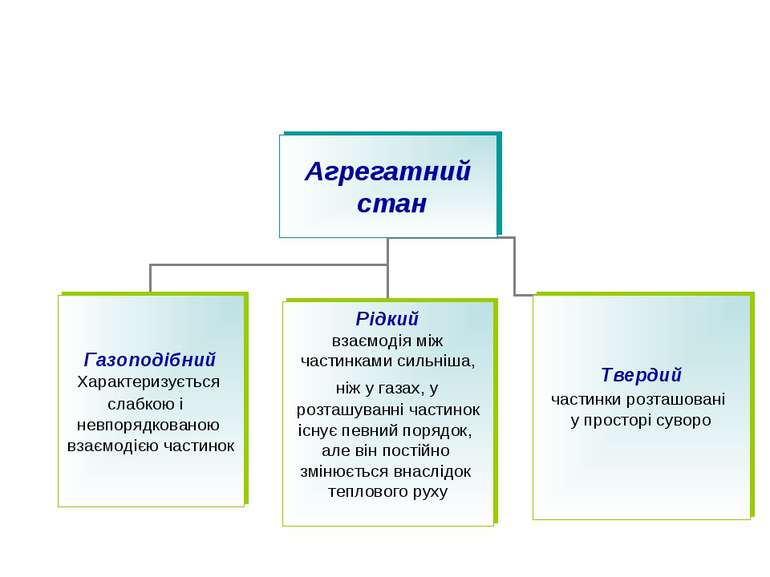
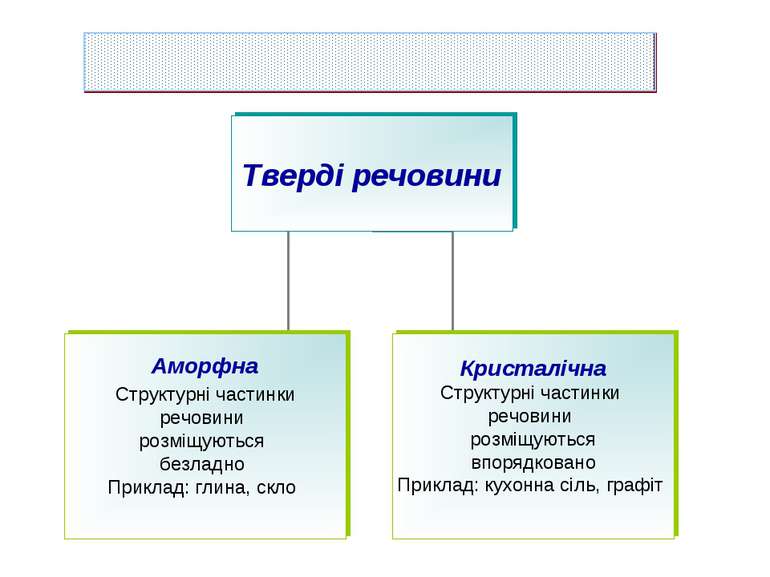
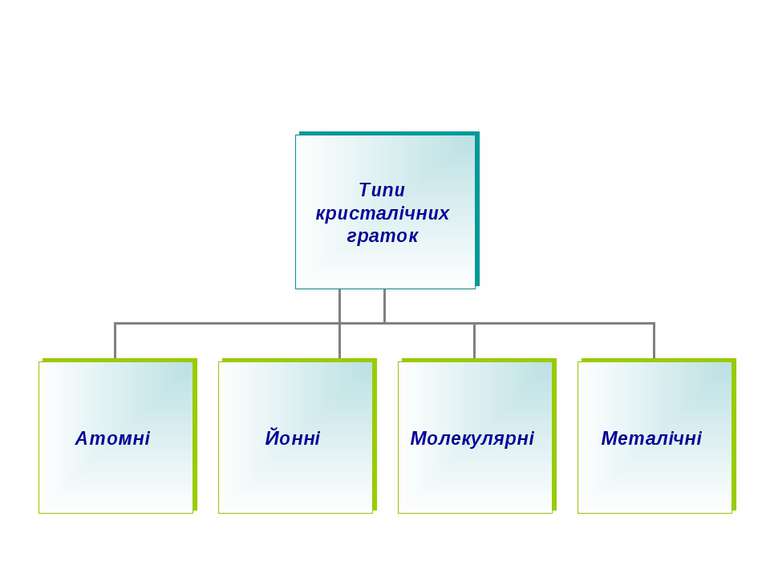
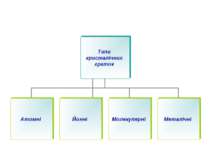
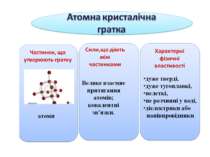
У кристалічних речовинах атоми, молекули, йони розміщуються в певному порядку, утворюючи кристалічні ґратки. Кристалічні ґратки – модель, за допомогою якої описують внутрішню будову кристалів. Розрізняють атомні, молекулярні, йонні та металічні кристалічні ґратки.
Між будовою речовини, яка визначається типом хімічного зв'язку і типом кристалічних ґраток, та її властивостями існує певна залежність: чим міцніший хімічний зв'язок, що утримує частинки у вузлах кристалічних ґраток, тим міцніші кристали, тим твердіша речовина, тим вищі її температури плавлення і кипіння. А тому, якщо відома будова речовини, можна прогнозувати її властивості, і навпаки – якщо відомі властивості речовини, можна зробити висновок про її можливу будову.
Схожі презентації
Категорії