Презентація на тему:
Корозія металів, захист від корозії
Завантажити презентацію
Корозія металів, захист від корозії
Завантажити презентаціюПрезентація по слайдам:
1) Корозія металів та захист від неї; 2) Дослідження корозії сталі в різних умовах; 3) Засоби боротьби з корозією.
Одну з найважливіших проблем, яку покликана розв’язувати хімія, - руйнування металевих конструкцій унаслідок корозії
Метали в природі найчастіше зустрічаються лише у зв’язаному стані (в окисленій формі). Це оксиди, сульфіди, хлориди, карбонати тощо. А це значить, що на їх відновлення треба витратити енергію, оскільки метали у відновленій формі характеризуються більшим запасом енергії. Таким чином, відновлена форма – це нестійкий стан для більшості металів, вони будуть самочинно переходити у свій природний стан, тобто окиснюватися.
Ми маємо уявлення про окиснення металів, з яких виготовлені апарати хімічних виробництв, нам також відомо, що окисненню піддаються металеві частини двигунів внутрішнього згорання, сопла літаків, ракет, а в побуті – труби водопостачальних мереж та опалювальних систем, крани, металеві предмети тощо. Звідси робимо висновок: руйнування металів унаслідок їх окиснення завдає великих збитків народному господарству. Розглядаємо види корозії:
Корозійне руйнування може охоплювати всю поверхню металу - суцільна (загальна) " корозія або окремі ділянки - місцева (локальна) корозія. Залежно від механізму процесу розрізняють хімічну й електрохімічну корозію
1) хімічна корозія – це окиснення металів, вищих за температуру конденсації води, коли на поверхні металу немає водної плівки. Цей тип корозії в природі практично не зустрічається, але спостерігається в апаратах на різноманітних хімічних виробництвах. Як приклад демонструємо окиснення мідного дроту киснем і згоряння заліза в хлорі. Рівняння окисно-відновних процесів: 2Cu + O2 = 2CuO; 2Fe + 3Cl2 = 2FeCl3;
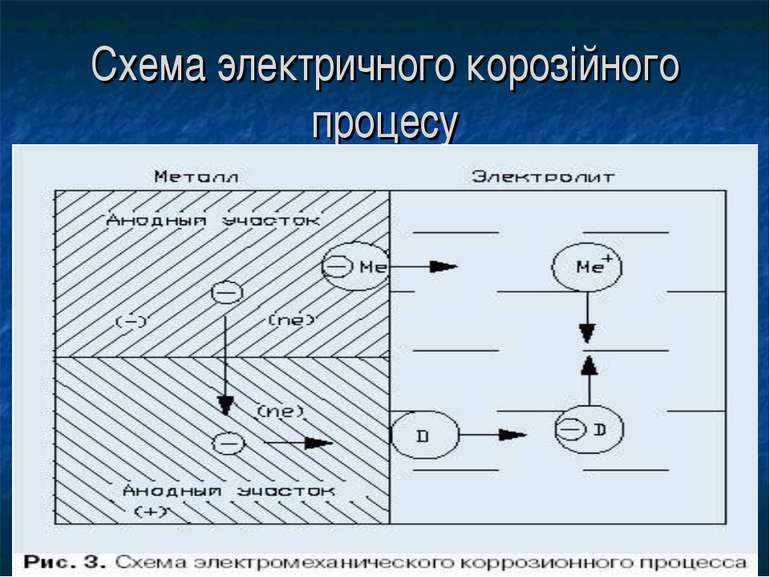
2) електрохімічна корозія – це окиснення металів за температур, нижчих за температуру конденсації води; за таких умов на поверхні металу завжди є плівка води. У цьому випадку поряд з хімічними процесами (відщеплення електронів) відбуваються й електричні процеси (перенесення електронів від однієї ділянки до іншої). Як приклад процеси корозії, які відбуваються при контакті заліза із цинком та при контакті заліза із міддю.
Хімічна корозія має місце при безпосередній взаємодії металу з агресивними газами і рідинами: 2Fe + 3Cl2 = 2FeCl3; Zn + 2 HCl = ZnCl2 + H2; 3Fe + 2O2 = Fe3O4; Fe + H2SO4 = FeSO4 + H2.
У кислому середовищі: 2HCl = H2 + Cl2 A: Zn – 2e = Zn. K: 2H + 2e = H2. У розчині нагромаджуються іони Zn+2, Cl-. У нейтральному середовищі на катоді відбувається відновлення молекули води за схемою: O2 + 2H2O + 4e = 4OH-.
2. Кисле середовище – HCl = H+ +Cl-. На аноді (Fe): Fe – 2e = Fe2+. На катоді (Cl): 2H++ 2e = H2. У розчині: Fe2+,Cl-. Сумарне рівняння: Fe + 2HCl = FeCl2 + H2.
Захист від корозії Для уповільнення корозії металевих виробів до електроліту вводять речовини інгібітори, які називають уповільнювачами корозії, їх застосовують у тих випадках, коли метал необхідно захищати від роз'їдання кислотами. Інгібітори широко застосовують при хімічному очищенні від накипу парових котлів, зніманні окалини з оброблених дета лей, а також при зберіганні та перевезенні хлоридної кислоти у стальній тарі.
Протекторний захист і електрозахист. Протекторний за хист застосовують у тому разі, коли захищається конструкція (підземний трубопровід, корпус судна), яка перебуває в середовищі електроліту (морська вода, підземні ґрунтові води та ін.). Суть такого захисту поля гає в тому, що конструкцію сполучають з протектором — більш активним металом, ніж метал конструкції, яку захищають. Як протектор для захисту стальних виробів звичайно використовують магній, алю міній, цинк та їх сплави. У про цесі корозії протектор є анодом і руйнується, запобігаючи тим самим руйнуванню конструкції У міру руйну вання протекторів їх замінюють новими. Електрозахист має перевагу над протекторним захистом: радіус дії першого близько 2 000 м, другого — близько 50 м.
Висновок 1 Електрохімічну корозію викликають, головним чином, домішки інших металів та неметалічних речовин, а також неоднорідність поверхні металу. При електрохімічній корозії (як у випадку контакту різнорідних металів, так і в разі утворення мікро гальванічних елементів на поверхні одного металу) потік електронів направлений від більш активного металу до менш активного (провідника), і більш активний метал ко родує. Швидкість корозії тим більша, чим далі розташовані один від одного в ряду стандартних електродних потенціалів ті, метали, з яких утворився гальванічний елемент(гальванічна пара).
Висновок 2 Біологічна корозія – це окиснення металу під впливом мікроорганізмів або продуктів їх метаболізму. Цей вид корозії відбувається в ґрунті, застійній та гнилісний воді. Її механізм зводиться до того, що самі мікроорганізми та продукти їх метаболізму провокують електрохімічну корозію.
Схожі презентації
Категорії