X
Код для використання на сайті:
X
Для завантаження презентації, скористайтесь соціальною кнопкою для рекомендації сервісу SvitPPT
Завантажити собі цю презентацію
Презентація на тему:
Гідро
Завантажити презентацію
Гідро
Завантажити презентаціюПрезентація по слайдам:
Слайд 4
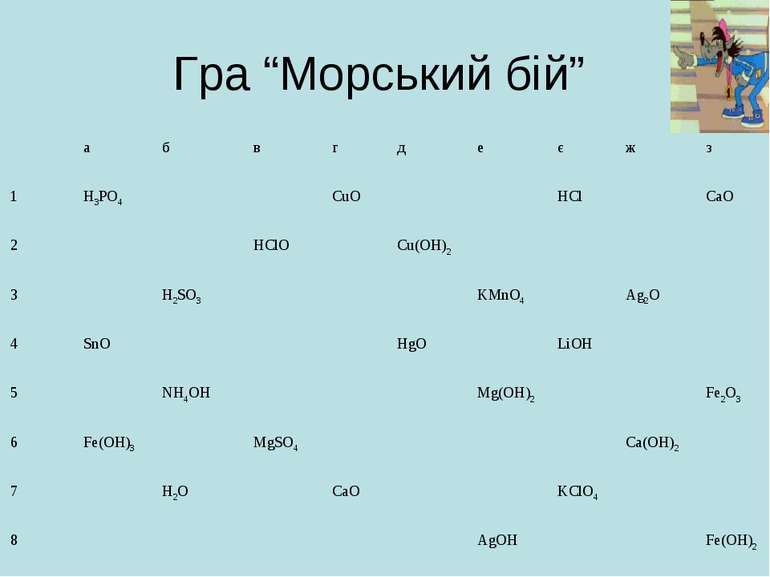
Гра “Морський бій” Наступне завдання нашої гри: треба «знешкодити» луги. а б в г д е є ж з 1 Ca(OH)2 Ba(OH)2 2 SiO2 ZnO NH4OH Fe(OH)2 3 Co(OH)2 PbO2 4 NaNO3 NH4Cl 5 Ca(NO3)2 H3PO4 NaOH 6 Al(OH)3 7 Al2(SiO3)3 KOH MgSO4 8 Fe(OH)3 LiOH 9 Zn(OH)2 MgO
Слайд 9
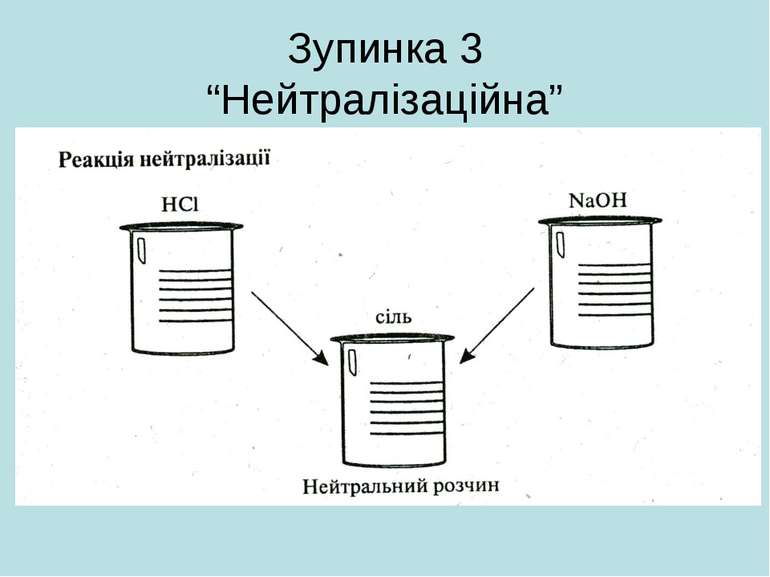
Зупинка 4 “Реакційна” *Гідроксиди реагують з кислотними оксидами: Ca(OH)2 + CO2 = CaCO3 +H2O *Розчинні гідроксиди – луги – реагують із солями при умові, що метал в результаті реакції утворює нерозчинну основу: CuSO4 + 2NaOH =Cu(OH)2+ Na2SO4
Схожі презентації
Категорії