Презентація на тему:
Фізична хімія
Завантажити презентацію
Фізична хімія
Завантажити презентаціюПрезентація по слайдам:
Література 1.Б.Б.Дамаскин, О.А.Петрий, «Электрохимия», Издательство «Высшая школа», М., 1987 г. 2.Б.Б.Дамаскин, О.А.Петрий, «Введение в электрохимическую кинетику», издательство «Высшая школа», М., 1983 г. 3.А.Н.Фрумкин, В.С.Багоцкий, З. А. Иофа, Б. Н. Кабанов, «Кинетика электродных процессов», издательство МГУ, 1952 г. 4.В.С.Багоцкий, «Основы электрохимии», издательство «Химия», Л., 1988 г. 5.И.Корыта, И.Дворжак, В.Богачкова, «Электрохимия», издательство «Мир», М., 1977 г. 6.Дж.Ньюмен, «Электрохимические системы», издательство «Мир», М., 1977 г. 7.К.Феттер, «Электрохимическая кинетика», издательство «Химия», М., 1967 г. 8. Б.Б.Дамаскин, О.А.Петрий, Г.А.Цирлина, «Электрохимия», Издательство «Химия», М., 2001 г.; второе издание «КолосС-Химия», М., 2006 г.
Електрохімія – це розділ хімічної науки, в якому вивчаються фізико-хімічні властивості конденсованих іонних систем, а також процеси та явища на межі розділу фаз за участю заряджених частинок (електронів або іонів).
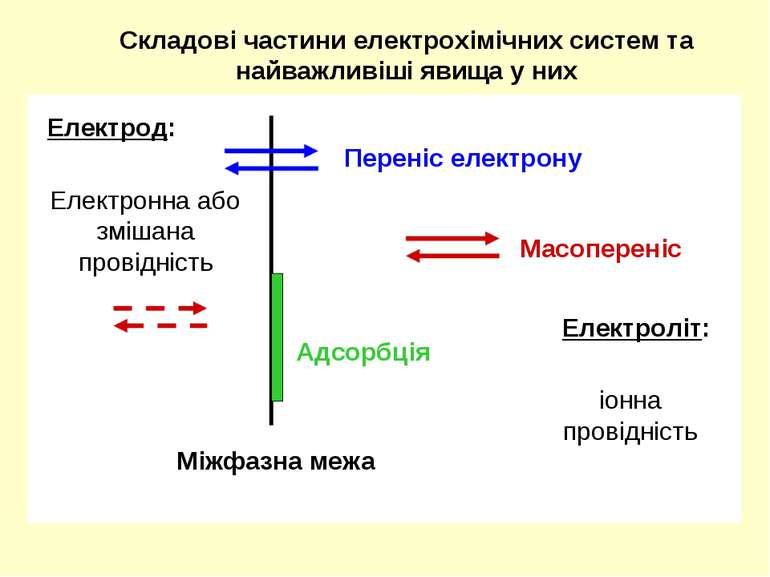
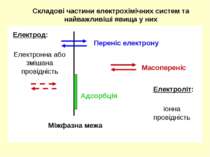
Складові частини електрохімічних систем та найважливіші явища у них Електрод: Переніс електрону Масопереніс Міжфазна межа Адсорбція Електроліт: іонна провідність Електронна або змішана провідність
Найважливіші вимірювані величини Струм I (А) Площа поверхні S (м2) Густина струму i (А/м2) (швидкість електродного процесу) Напруга U (В) Потенціал електроду Е (В) + спектральні та дифракційні методи
Рівновага на межі електрод-розчин Електрохімічна вільна енергія Гіббса Гальвані-потенціал Вольта-потенціал Поверхневий потенціал Рівняння Нернста, 1889 Е. Гуггенгейм, 1929: Фаза, в якій знаходиться частинка i
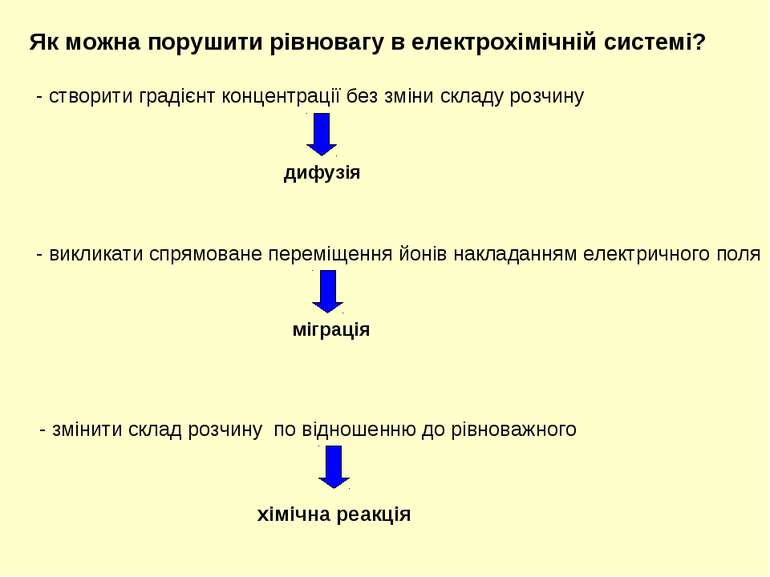
- створити градієнт концентрації без зміни складу розчину - змінити склад розчину по відношенню до рівноважного хімічна реакція Як можна порушити рівновагу в електрохімічній системі? міграція - викликати спрямоване переміщення йонів накладанням електричного поля дифузія
Вступ Історія Рівень Фермі Контактна різниця потенціалів Фарадеївські та нефарадеївські процеси Наслідок теореми Гауса: надлишковий заряд на металі може розташовуватися лише на поверхні
Пристрої, у яких здійснюються окисно-відновні реакції за рахунок переносу електронів через зовнішній контакт. Поділяються на гальванічні та електролітичні комірки У гальванічних елементах за рахунок перебігу самочинної окисно-відновної реакції ( G0). Електрохімічні комірки
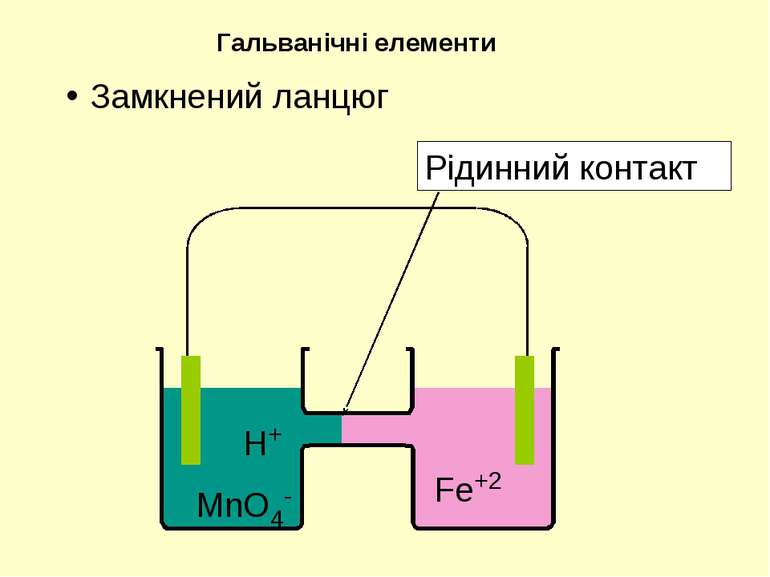
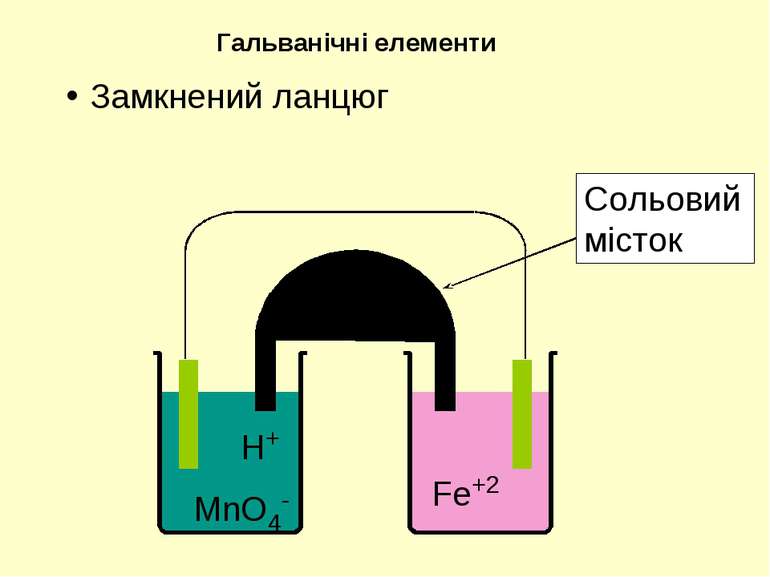
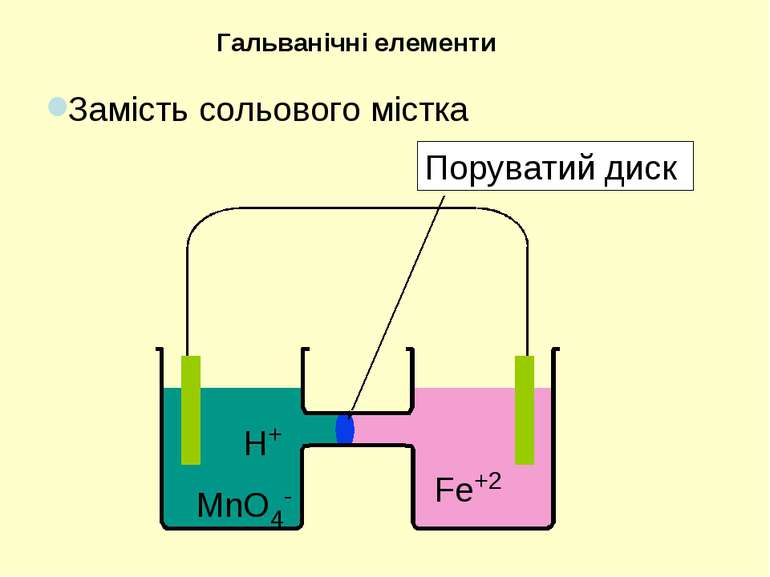
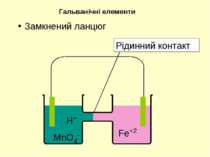
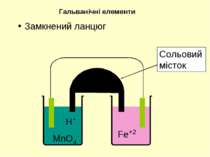
Тв. фаза | Рідка фаза | | Рідка фаза | Тв. фаза Анод ліворуч | | Катод праворуч | - Міжфазна межа Три вертикально розташовані крапки – рідинний контакт | | - сольовий місток або поруватий диск Якщо усі речовини з однієї сторони знаходяться у водному розчині, мається на увазі платиновий електрод. Позначення у діаграмах електрохімічних комірок
Правила складання схем електрохімічних комірок (елементів, ланцюгів, кіл) Електрод, на якому відбувається окиснення, називається анодом. Електрод, на якому відбувається відновлення, називається катодом. • анод записують ліворуч, а катод - праворуч. • якщо у цій конфігурації комірка працює самочинно, то кажуть, що вона має додатній потенціал. • при з’єднанні з вольтметром позитивну клему останнього приєднують до позитивного електроду. Якщо при цьому вольтметр указує позитивний потенціал, клеми приєднані коректно. Якщо вольтметр указує негативний потенціал, клеми потрібно підключити навпаки і змінити віднесення відповідних електродів до катоду та аноду. • у гальванічній комірці катод має більш позитивний потенціал (+) • в електрохімічній комірці катод має більш негативний потенціал (-)
ЗАПАМ’ЯТАТИ ! Електроліз Система споживає енергію G>0 АНОД + КАТОД - Хімічні джерела струму Система виробляє енергію G
Гальванічні елементи Гальванічний елемент – це електрохімічна комірка, яка виробляє електрику в результаті самочинного перебігу в ній хімічної реакції
Класифікація гальванічних елементів Фізичні (алотропічні та гравітаційні): електроди однакової хімічної природи в одному і тому ж самому розчині Концентраційні: ідентичні за природою та станом електроди електролітно-концентраційні елементи: гальванічні елементи, у яких обидва електродні відділення ідентичні, але концентрації електролітів (окисненої або відновленої форм) відрізняються (ланцюги з переносом – є дифузійний стрибок потенціалу) електродно-концентраційні елементи: гальванічні елементи, у яких самі електроди мають різні концентрації в одному і тому ж самому розчині електроліту (ланцюги без переносу – наприклад, з газовими електродами при різних тисках або з амальгамними електродами різної концентрації) (у фізичних та концентраційних ланцюгах хімічні реакції не перебігають!!) Хімічні (з переносом та без переносу): у ланцюгу перебігає хімічна реакція
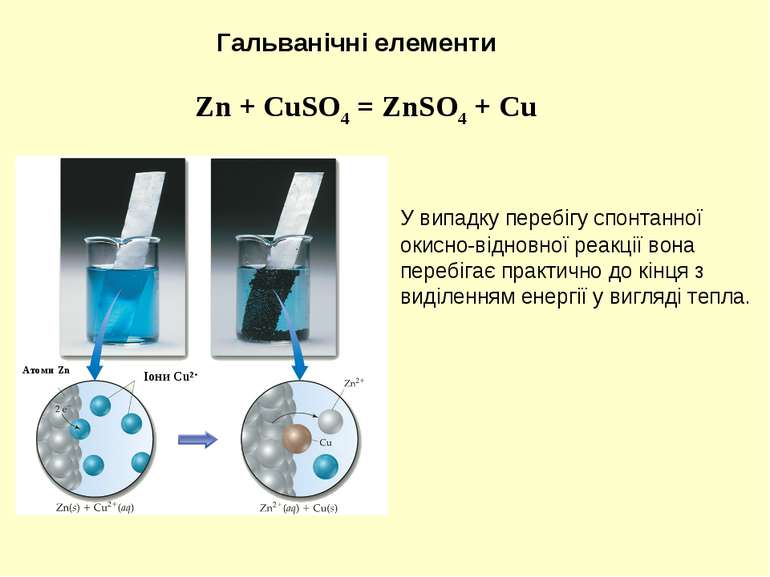
У випадку перебігу спонтанної окисно-відновної реакції вона перебігає практично до кінця з виділенням енергії у вигляді тепла. Zn + CuSO4 = ZnSO4 + Cu Гальванічні елементи Іони Cu2+ Атоми Zn
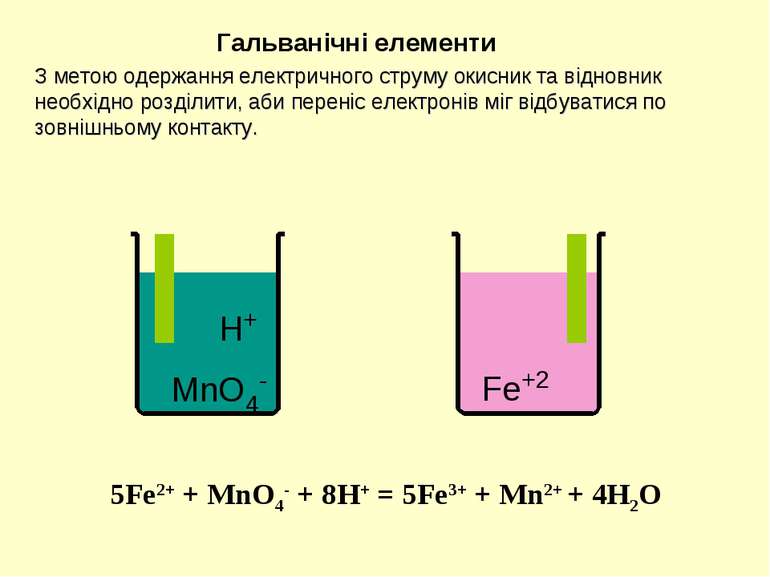
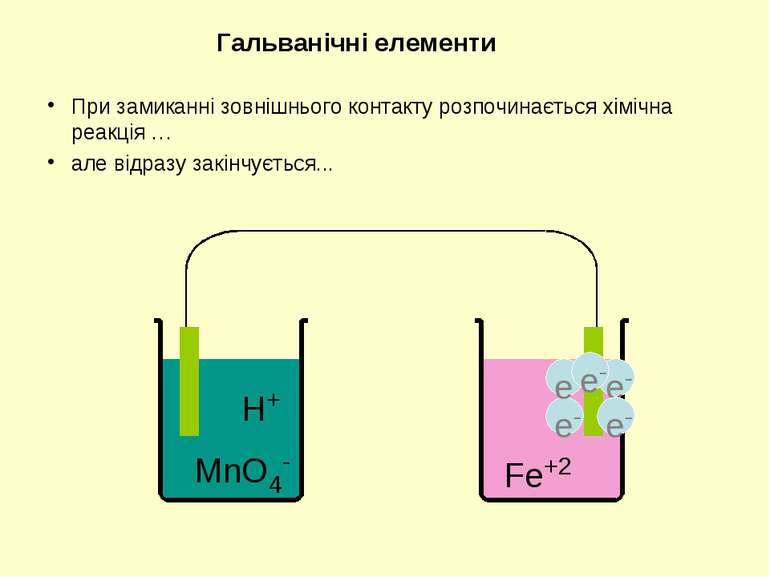
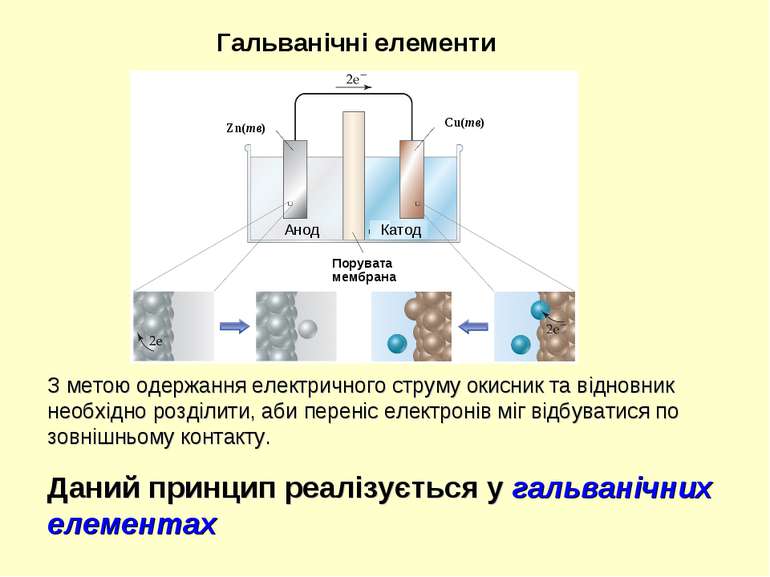
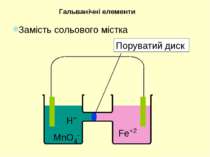
H+ MnO4- Fe+2 Гальванічні елементи З метою одержання електричного струму окисник та відновник необхідно розділити, аби переніс електронів міг відбуватися по зовнішньому контакту. 5Fe2+ + MnO4- + 8H+ = 5Fe3+ + Mn2+ + 4H2O
При замиканні зовнішнього контакту розпочинається хімічна реакція … але відразу закінчується... Гальванічні елементи H+ MnO4- Fe+2
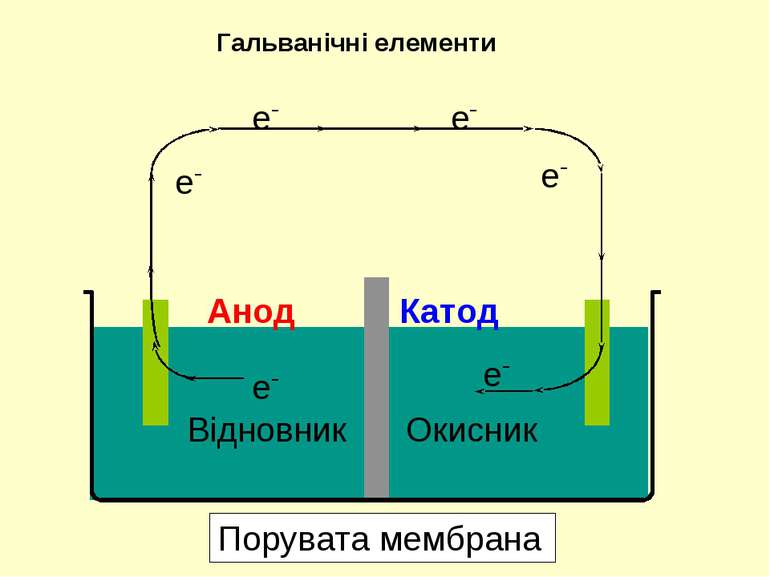
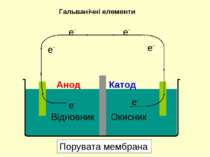
З метою одержання електричного струму окисник та відновник необхідно розділити, аби переніс електронів міг відбуватися по зовнішньому контакту. Даний принцип реалізується у гальванічних елементах Гальванічні елементи Порувата мембрана Cu(тв) Zn(тв) Анод Катод
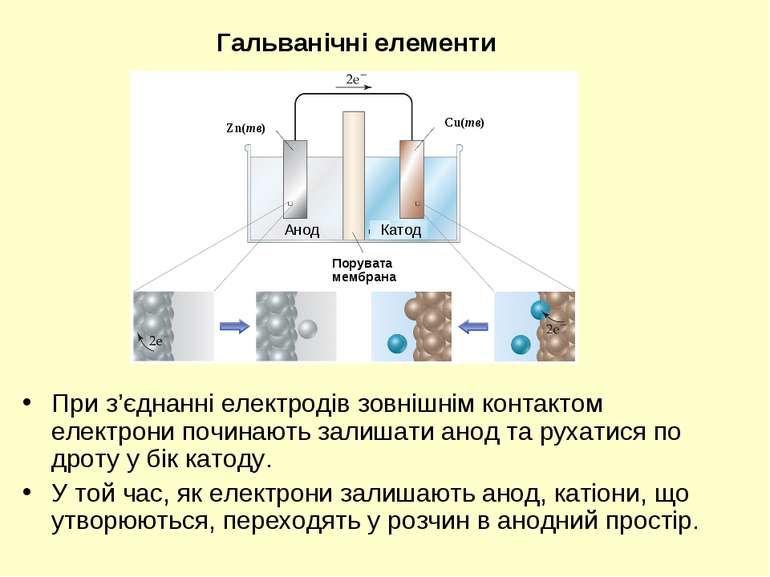
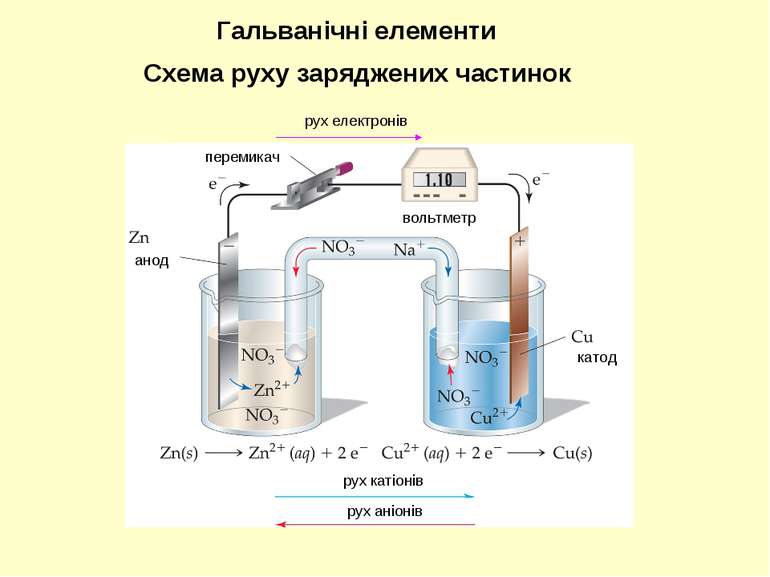
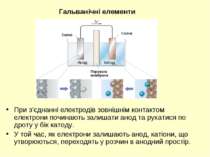
При з’єднанні електродів зовнішнім контактом електрони починають залишати анод та рухатися по дроту у бік катоду. У той час, як електрони залишають анод, катіони, що утворюються, переходять у розчин в анодний простір. Гальванічні елементи Порувата мембрана Cu(тв) Zn(тв) Анод Катод
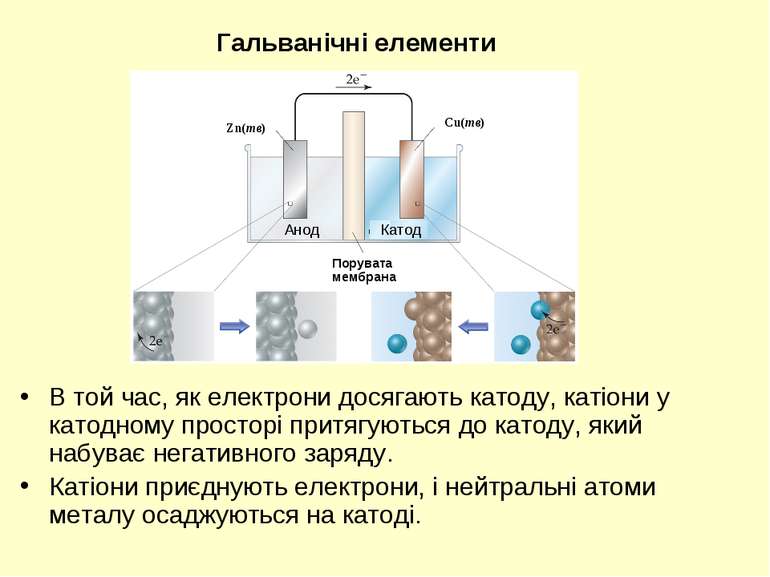
В той час, як електрони досягають катоду, катіони у катодному просторі притягуються до катоду, який набуває негативного заряду. Катіони приєднують електрони, і нейтральні атоми металу осаджуються на катоді. Гальванічні елементи Порувата мембрана Cu(тв) Zn(тв) Анод Катод
катод анод вольтметр рух катіонів рух аніонів перемикач Гальванічні елементи рух електронів Схема руху заряджених частинок
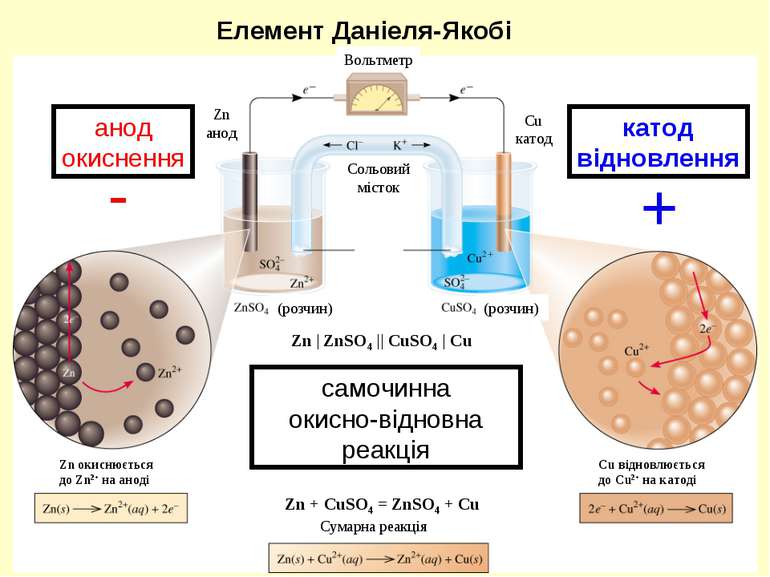
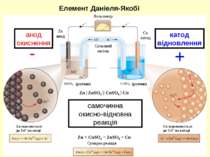
самочинна окисно-відновна реакція анод окиснення катод відновлення - + Елемент Даніеля-Якобі Сумарна реакція Zn окиснюється до Zn2+ на аноді Cu відновлюється до Cu2+ на катоді Вольтметр Сольовий місток (розчин) (розчин) Zn анод Cu катод Zn | ZnSO4 || CuSO4 | Cu Zn + CuSO4 = ZnSO4 + Cu
Різниця у величинах електричних потенціалів між анодом і катодом називається: напругою комірки електрорушійною силою (ЕРС) потенціалом комірки [Cu2+] = 1 M та [Zn2+] = 1 M Zn (тв) | Zn2+ (1 M) || Cu2+ (1 M) | Cu (тв) анод катод Zn (тв) + Cu2+ (водн) Cu (тв) + Zn2+ (водн) Елемент Даніеля-Якобі ЕРС вимірюється у вольтах (В) 1 Вольт = 1 Джоуль роботи / кулон заряду
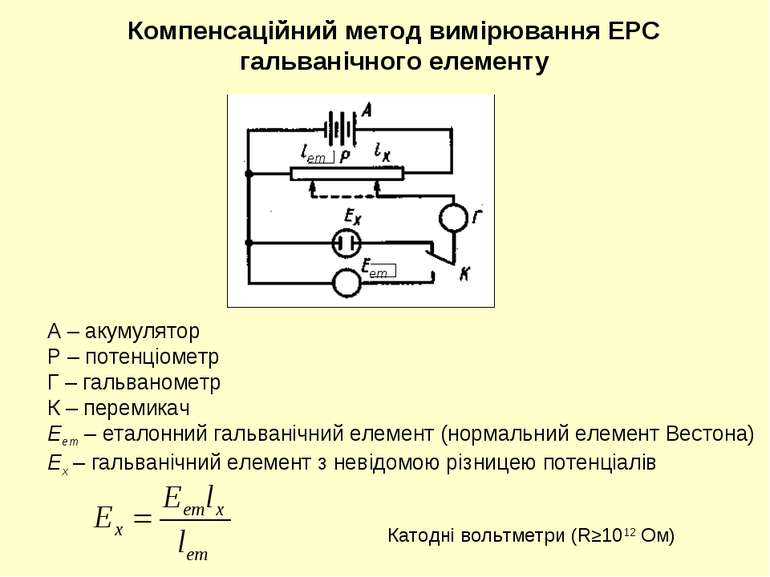
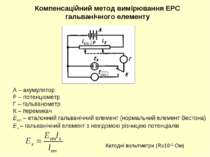
Компенсаційний метод вимірювання ЕРС гальванічного елементу А – акумулятор Р – потенціометр Г – гальванометр К – перемикач Еет – еталонний гальванічний елемент (нормальний елемент Вестона) Ех – гальванічний елемент з невідомою різницею потенціалів ет ет Катодні вольтметри (R≥1012 Ом)
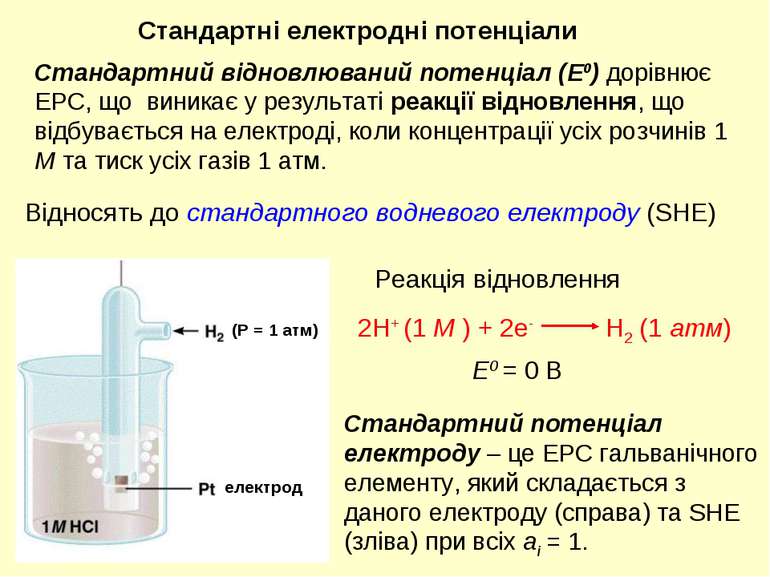
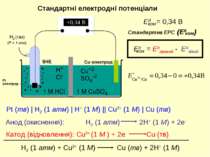
E0 = 0 В Відносять до стандартного водневого електроду (SHE) Реакція відновлення Стандартні електродні потенціали електрод (Р = 1 атм) Стандартний відновлюваний потенціал (E0) дорівнює ЕРС, що виникає у результаті реакції відновлення, що відбувається на електроді, коли концентрації усіх розчинів 1 M та тиск усіх газів 1 атм. Стандартний потенціал електроду – це ЕРС гальванічного елементу, який складається з даного електроду (справа) та SHE (зліва) при всіх ai = 1.
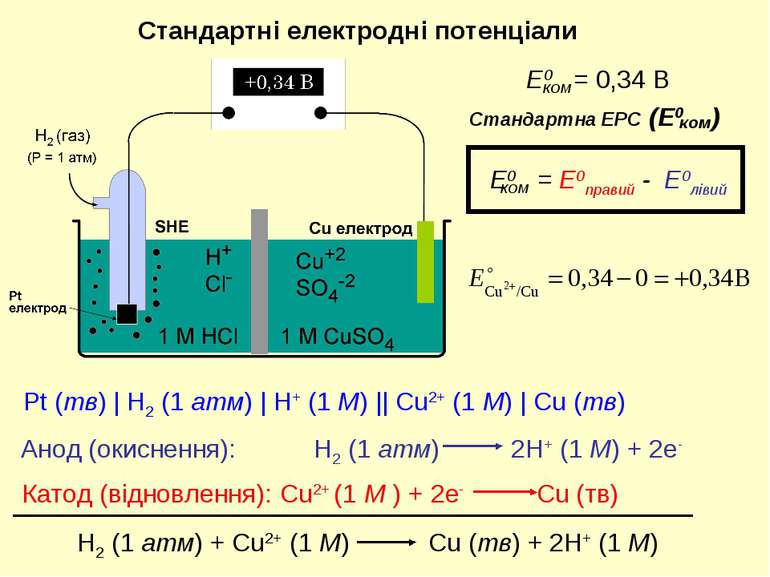
Pt (тв) | H2 (1 атм) | H+ (1 M) || Cu2+ (1 M) | Cu (тв) Стандартні електродні потенціали Анод (окиснення): Катод (відновлення):
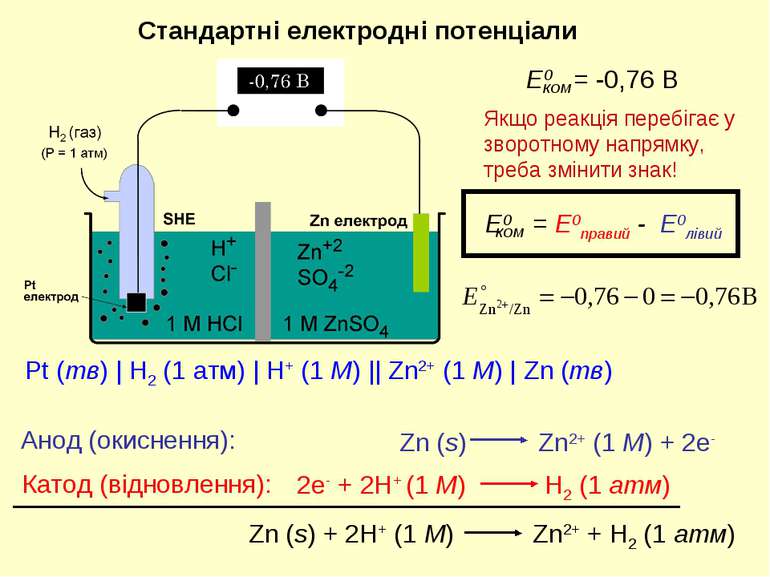
Стандартні електродні потенціали Якщо реакція перебігає у зворотному напрямку, треба змінити знак! Pt (тв) | H2 (1 атм) | H+ (1 M) || Zn2+ (1 M) | Zn (тв) Анод (окиснення): Катод (відновлення):
Стандартні електродні потенціали SHE Pt електрод Zn електрод H2 (Р = 1 атм) Zn (тв) | Zn2+ (1 M) || H+ (1 M) | H2 (1 атм) | Pt (тв) 2 +2
Потенціал електрохімічної комірки катод анод вольтметр перемикач Eком = +0,34 В − (−0,76 В) = +1,10 В Для процесу окиснення Zn2+ + 2e Zn0 Для процесу відновлення Cu2+ + 2e Cu0 Eком = E(катод) – E(анод) Eком = E(правий) – E(лівий)
Zn(тв) + Cu+2 (aq) ® Zn+2(aq) + Cu(тв) Потенціал комірки дорівнює різниці потенціалів відновлення правого та лівого електродів Eком = ECu+2 ® Cu - E Zn+2®Zn Величини електродних потенціалів можна знайти у таблицях. При зміні напрямку процесу на зворотній знак електродного потенціалу змінюється на протилежний. Якщо потенціали катоду та аноду представляти як потенціали процесів відновлення та окиснення, що відбуваються на відповідних електродах, потенціал комірки буде дорівнювати сумі даних потенціалів Eком = EZn® Zn+2 + ECu+2 ® Cu Потенціал електрохімічної комірки
Стандартні електродні потенціали у водних розчинах при 25 оС Напівреакція відновлення Збільшення окислювальної здатності Збільшення відновлювальної здатності
E0 для напівреакцій відновлення (так, як вони записані) Чим більш позитивне E0, тим більш виражена тенденція речовини до відновлення Електродні напівреакції оборотні Знак E0 змінюється на протилежний для зворотних реакцій Зміна стехіометричних коефіцієнтів напівреакцій не призводить до зміни величини E0 Стандартні електродні потенціали у водних розчинах при 25 оС
Більш позитивне Eº більш легко приймає електрони більш легко відновлюється кращий окиснюючий агент Більш негативне Eº більш легко віддає електрони більш легко окиснюється кращий відновлюючий агент Відновлювальні потенціали
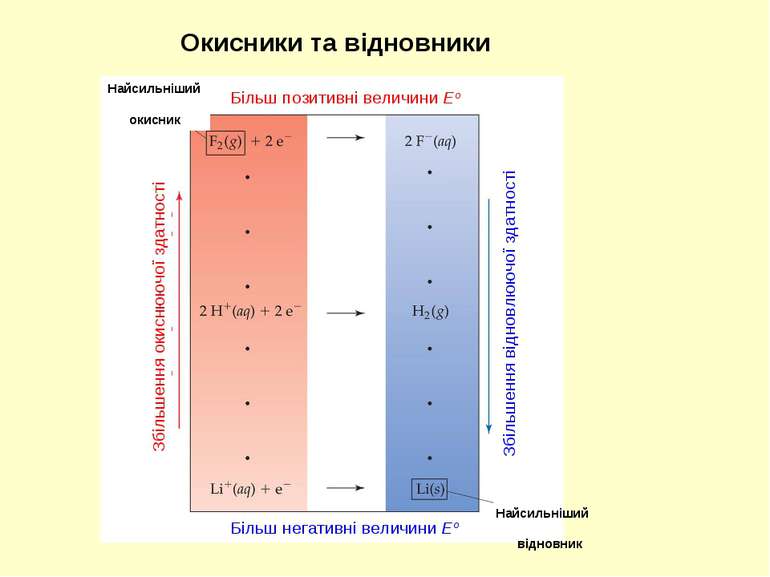
Окисники та відновники Збільшення відновлюючої здатності Збільшення окиснюючої здатності Більш негативні величини Eo Більш позитивні величини Eo Найсильніший окисник Найсильніший відновник
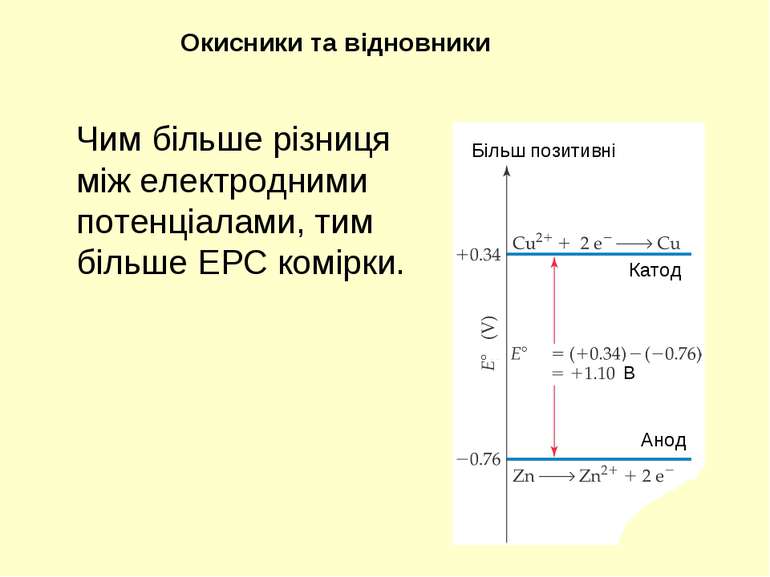
Чим більше різниця між електродними потенціалами, тим більше ЕРС комірки. Окисники та відновники Більш позитивні Катод Анод В
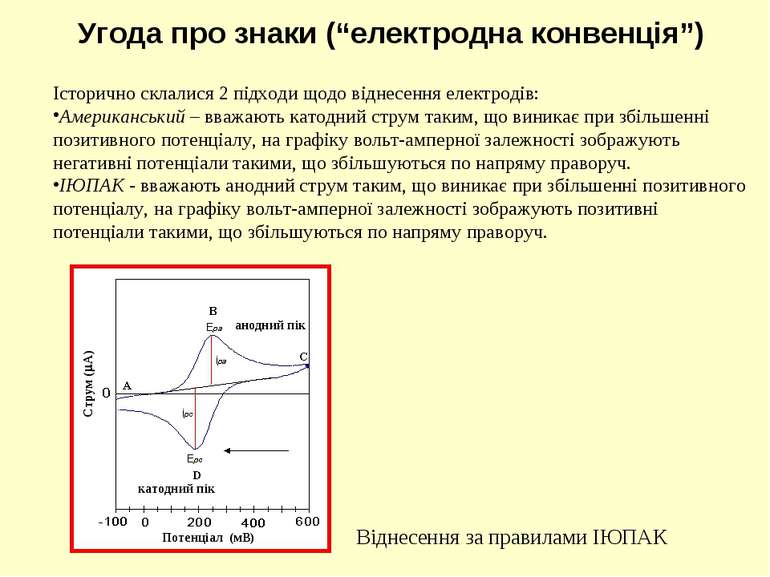
Історично склалися 2 підходи щодо віднесення електродів: Американський – вважають катодний струм таким, що виникає при збільшенні позитивного потенціалу, на графіку вольт-амперної залежності зображують негативні потенціали такими, що збільшуються по напряму праворуч. ІЮПАК - вважають анодний струм таким, що виникає при збільшенні позитивного потенціалу, на графіку вольт-амперної залежності зображують позитивні потенціали такими, що збільшуються по напряму праворуч. Угода про знаки (“електродна конвенція”) анодний пік Віднесення за правилами ІЮПАК катодний пік Струм ( А) Потенціал (мВ)
Схожі презентації
Категорії