Презентація на тему:
Електронна оболонка атома(конфігурація)
Завантажити презентацію
Електронна оболонка атома(конфігурація)
Завантажити презентаціюПрезентація по слайдам:
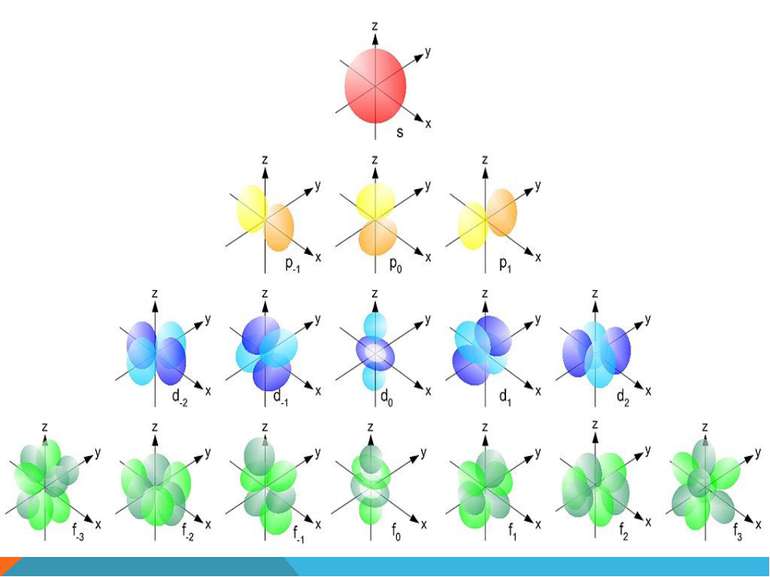
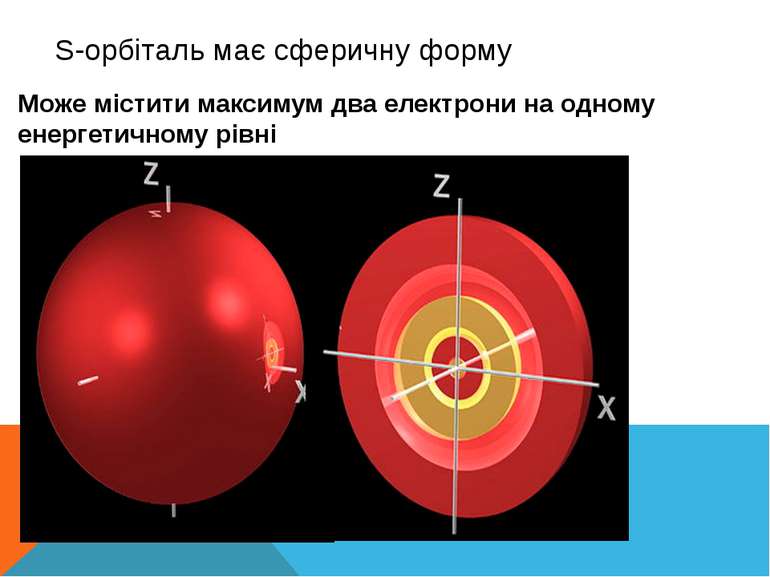
S-орбіталь має сферичну форму Може містити максимум два електрони на одному енергетичному рівні
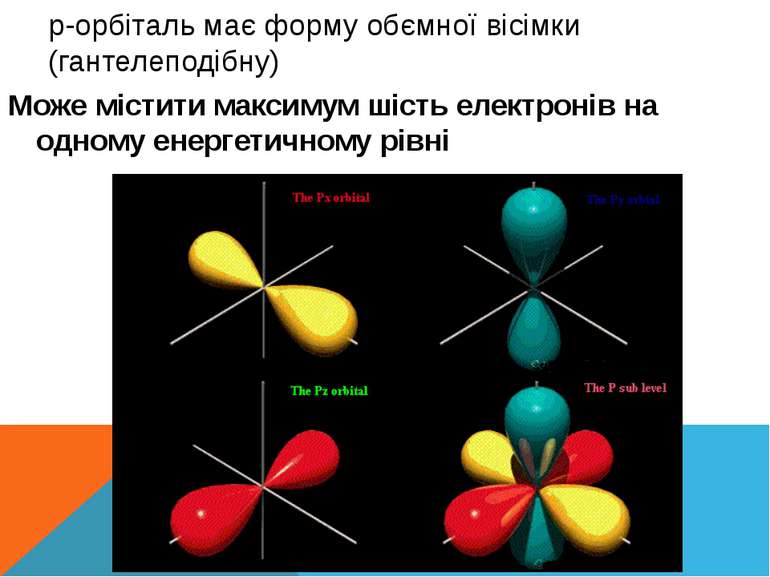
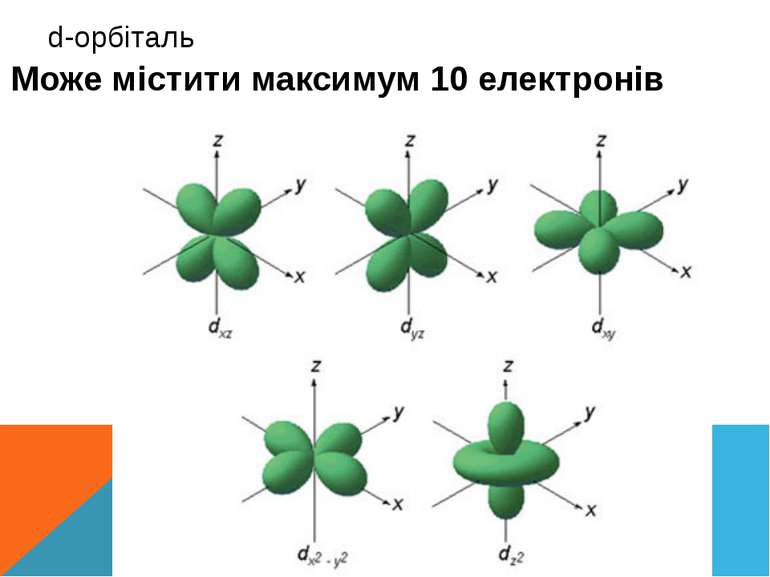
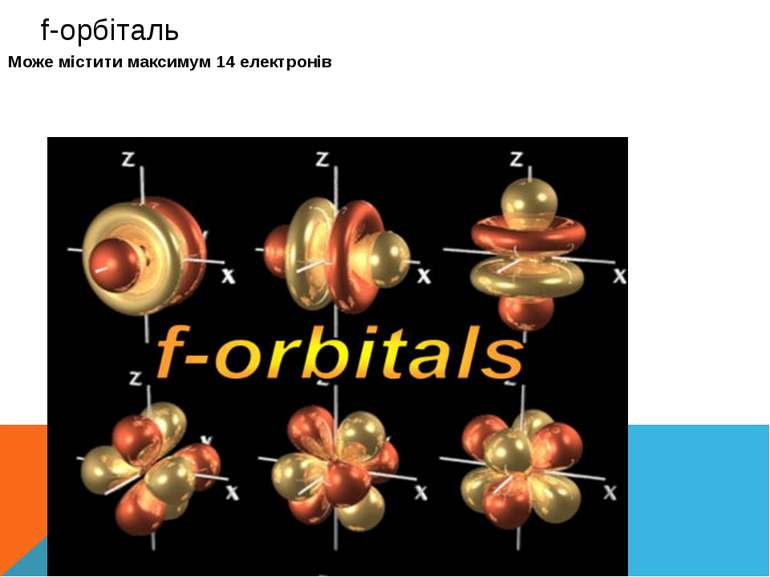
p-орбіталь має форму обємної вісімки (гантелеподібну) Може містити максимум шість електронів на одному енергетичному рівні
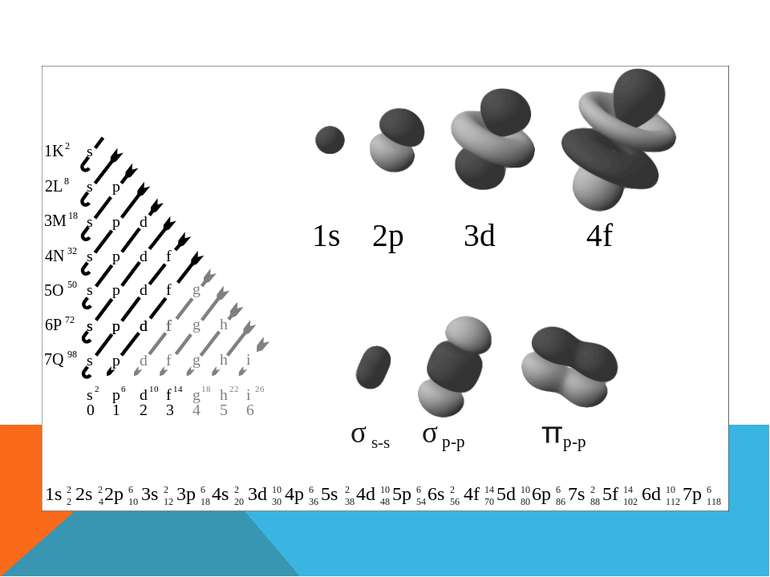
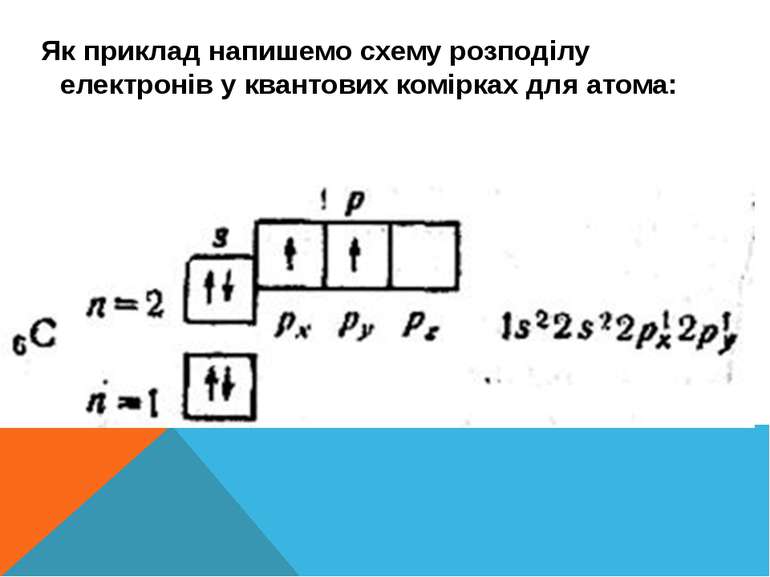
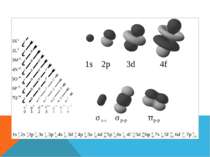
Структуру електронних оболонок зображують також за допомогою енергетичних, або квантових, комірок — це так звані графічні електронні формули. Комірка позначається клітиною: клітина — орбіталь, стрілка — електрон, напрям стрілки — напрямленість спіну, яку може займати електрон під час збудження В комірці може перебувати один або два електрони (якщо два електрони, то вони спарені).
Оскільки s-електрона орбіталь може містити максимум два електрони, а інших енергетичних рівнів окрім s немає період буде складатися із двох хімічних елементів, а саме Гідрогену і Гелію 1 період
Атом гідрогену H1s1 1s1 Найпростіших із всіх атомів складається з ядра(протон) навколо якого обертається один електрон, тому електрона конфігурація його:
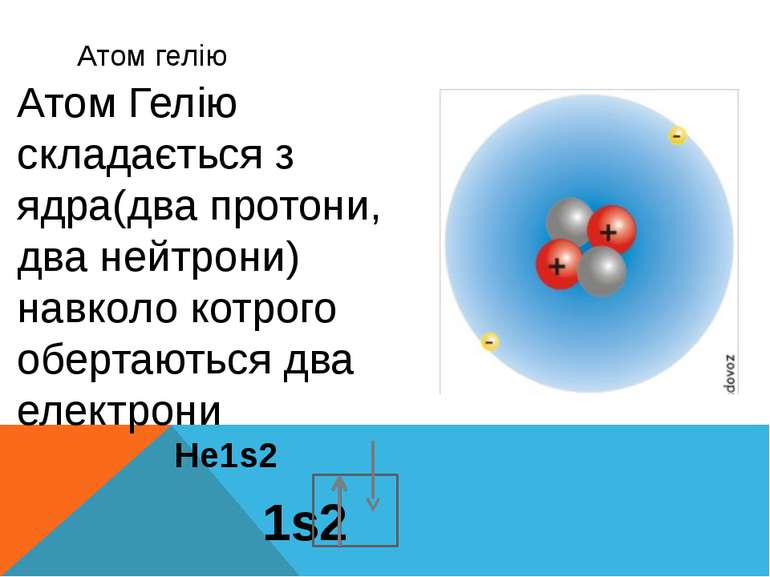
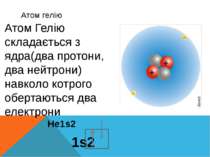
Атом гелію He1s2 1s2 Атом Гелію складається з ядра(два протони, два нейтрони) навколо котрого обертаються два електрони
Складається із двох енергетичних під рівнів S- і p На S- підрівні як було сказано раніше максимум два електрони, на p їх може бути до шести. Таким чином період складається із восьми хімічних елементів 2 період Внутрішній енергетичний рівень буде стабільний, і у міру збільшення порядкового номер не буде мінятись залишаючи електрону конфігурацію, як у Гелія, зовнішній буде поступово заповнювати S у перших двох елементів, а згодом і p у решти.
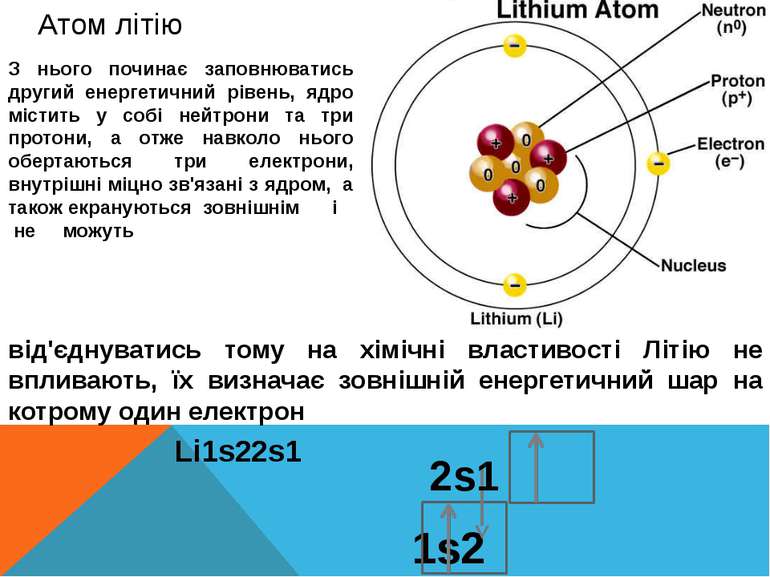
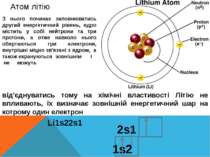
Атом літію З нього починає заповнюватись другий енергетичний рівень, ядро містить у собі нейтрони та три протони, а отже навколо нього обертаються три електрони, внутрішні міцно зв'язані з ядром, а також екрануються зовнішнім і не можуть від'єднуватись тому на хімічні властивості Літію не впливають, їх визначає зовнішній енергетичний шар на котрому один електрон Li1s22s1 1s2 2s1
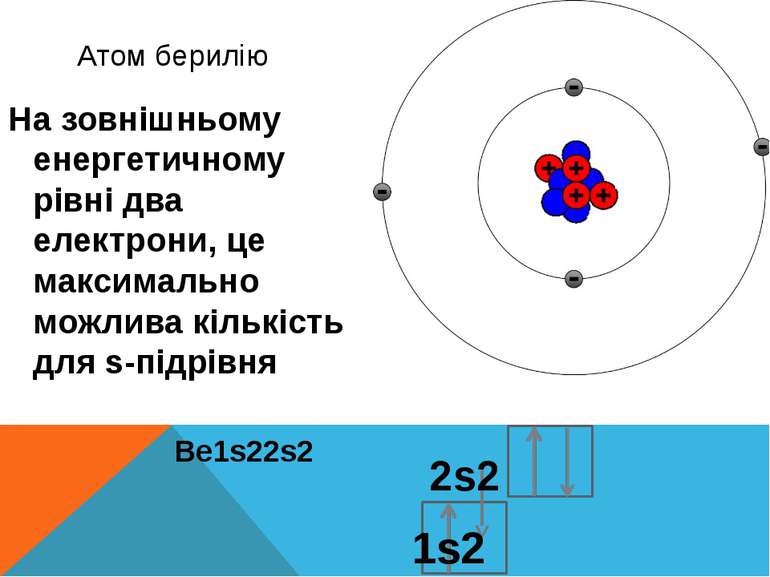
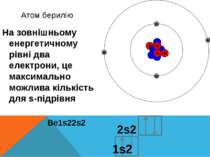
Атом берилію На зовнішньому енергетичному рівні два електрони, це максимально можлива кількість для s-підрівня 2s2 Be1s22s2 1s2
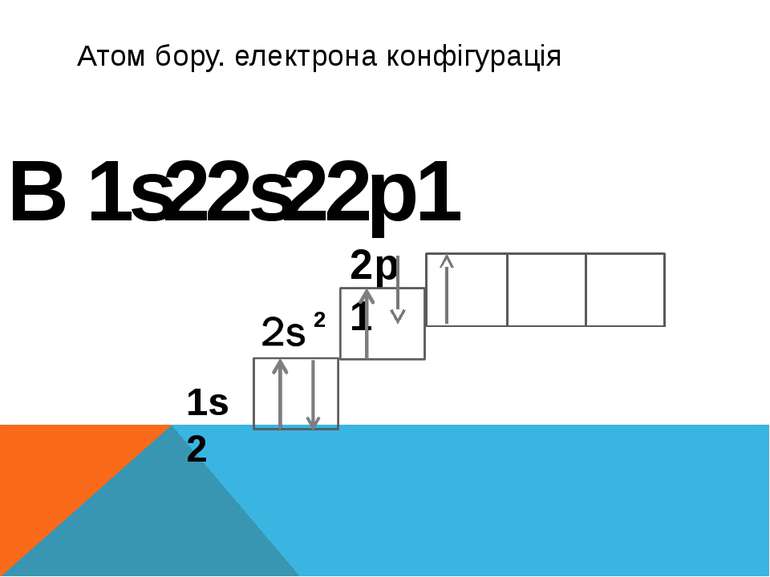
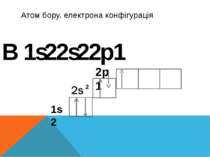
Наступний хімічний елемент Бор у Бора заповнюється вже p-підрівень він складається із двох електронів котрі обертаються по сферичній S- орбіталі та одно що обертається по p-орбіталі
Схожі презентації
Категорії