Презентація на тему:
будова атома
Завантажити презентацію
будова атома
Завантажити презентаціюПрезентація по слайдам:
Дмитро Іванович Менделєєв Пригадайте: Яку дату вважають “Днем народження” періодичного закону? Що було взято вченим за основу при створенні періодичного закону? Сформулюйте визначення періодичного закону.
Відповіді на запитання хімічного диктанту Період Малі періоди Металічні властивості послаблюються Групи Головна і побічна підгрупи Металічні властивості посилюються За номером групи Від 8 слід відняти номер групи
Будова атома. Склад атомних ядер. Ви зможете: зрозуміти зміст понять: радіоактивність, випромінювання, протонне та нуклонне числа; дізнатися про: короткі відомості з історії розвитку наукових знань про будову атомів хімічних елементів, про фізичний зміст періодичного закону; вдосконалити навички: визначати елементарний склад атомів хімічних елементів відповідно до їх положення в періодичній системі.
Атом Пригадайте: Яке визначення атома ви знаєте з уроків фізики, хімії, природознавства? Яке походження має слово “атом”? Що було відомо про будову атома за часи Д.М.Менделєєва?
Антуан Анрі Беккерель У 1896 році під час одного зі своїх чисельних дослідів французький фізик Антуан Беккерель загорнув кристали сульфата ураніл-калію K2(UO2)(SO4)2 в чорний світлонепроникаючий папір і поклав на фотоплівку. Після проявки на ній з’явилися силуети кристалів. Так була відкрита здатність сполук урану випромінювати іонізуючі промені, які засвітлюють в темряві фотоплівку та спричиняють світіння речовин в темряві.
П’єр Кюрі і Марія Склодовська-Кюрі Фанатично віддані своїй справі вчені, не маючи навіть лабораторії, працюючи в невеличкому сараї на вулиці Ломон в Парижі з 1898 по 1902 роки переробили понад 8 тонн уранової руди, щоб добути одну соту грама нової речовини — Радію. У 1903 році за відкриття радіоактивності подружжя отримало Нобелівську премію з фізики. Пізніше був відкритий новий елемент названий на честь батьківщини Марії - Полонієм. У 1911 році, вже після смерті чоловіка, Марія Кюрі здобула Нобелівську премію вдруге – за відкриття нових хімічних елементів: Полонію та Радію.
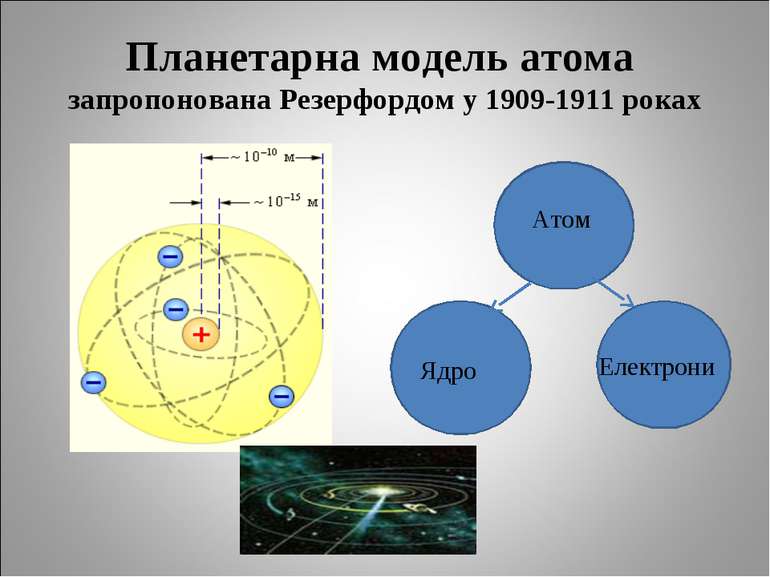
Джозеф Джон Томсон Американський вчений Джозеф Томсон у 1906 році також отримав Нобелівську премію за відкриття електрона, існування якого передбачив ще у 1897 році. Але модель атома, запропонована вченим у 1903 році, в якій «електрони, наче родзинки в кексі, рівномірно розподіляються в позитивно зарядженій субстанції», не була досконалою.
Ернест Резерфорд Ернест Резерфорд вважається найбільшим фізиком-експериментатором двадцятого сторіччя. Він є людиною, яка поклала початок ядерній фізиці. Крім свого величезного теоретичного значення, його відкриття отримали широкий спектр застосування, включаючи, ядерну зброю, атомні електростанції, радіоактивні обчислення і дослідження радіації. Вплив праць Резерфорда на світ величезний. Воно продовжує рости і, схоже, ще збільшиться в майбутньому. У 1908 р. ученого нагородили Нобелівською премією за дослідження різних видів радіоактивності.
Будова атомних ядер У 1920 році Резерфорд ввів поняття про позитивно заряджену частинку у складі ядра атома - протон У 1932 році Джеймс Чедвік виявив в ядрі атома нейтральну частинку - нейтрон
Генрі Мозлі У 1910-1914 працював в лабораторії Е. Резерфорда в Манчестерському університеті, в 1914 р. повернувся до Оксфордського університету. У 1913 в серії блискучих експериментів встановив залежність між частотою спектральних ліній характеристичного рентгенівського випромінювання і атомним номером випромінюючого елемента. Це фундаментальне відкриття мало величезне значення для встановлення фізичного сенсу періодичної системи елементів і атомного номера, і для підтвердження правильності концепції планетарного атома.
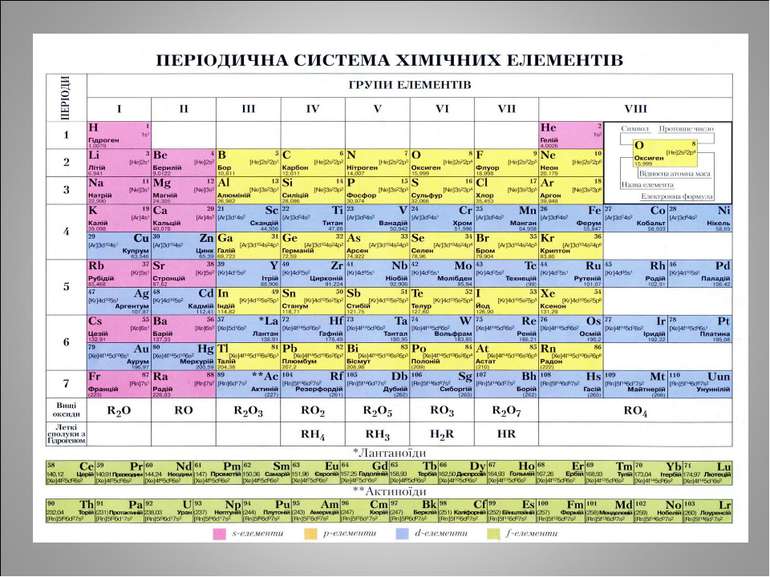
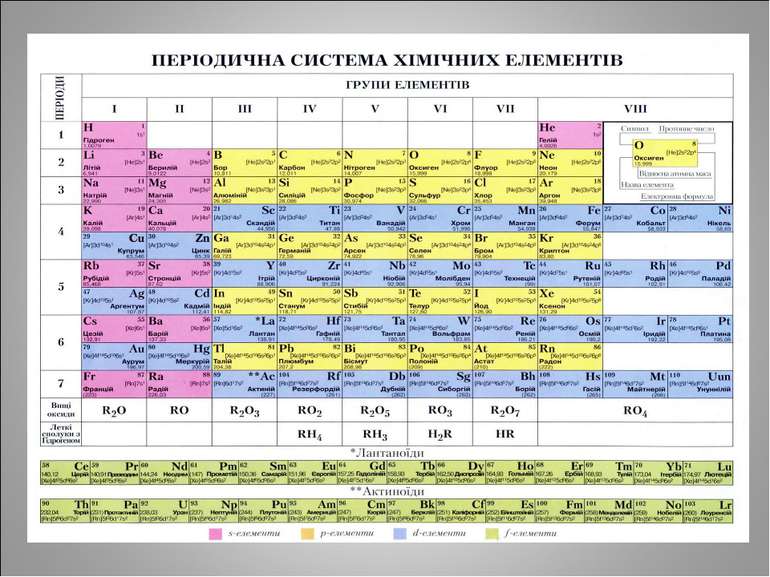
Алгоритм визначення елементарного складу атомів Відносна атомна маса хімічного елемента – нуклонне число (масове число) Порядковий номер хімічного елемента – протонне число Заряд ядра атома співпадає з порядковим номером хімічного елемента (протонним числом) і обумовлений числом протонів Число електронів = числу протонів, оскільки атом – електронейтральна частинка Щоб обчислити число нейтронів, слід відняти від нуклонного числа кількість протонів
Самостійна робота Назва, символ № періоду № групи заряд ядра нукл. число число p число e число n прот. число Нітроген Кальцій Цинк Сульфур Арсен Ферум
Схожі презентації
Категорії