Презентація на тему:
Бром
Завантажити презентацію
Бром
Завантажити презентаціюПрезентація по слайдам:
Бром належить до головної підгрупи сьомої групи періодичної системи. Маючи в зовнішньому електронному шарі сім електронів, його атоми легко віднімають валентні електрони від атомів інших елементів і перетворюються в негативно одновалентні іони Br−. Цим самим проявляються його різко виражені окисні властивості. Реакції з неметалами реаеагує з воднем Br2+Н2 → 2HBr . Не реагує з киснем, але відомі його оксиди отримані іншими шляхами : Дає сполуки з фтором Хімічні властивості
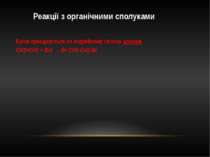
Реакції з органічними сполуками Бром приєднується по подвійному зв'язку алкенів CH2=CH2 + Br2 → Br-CH2-CH2-Br
Реакції з органічними сполуками Заміщення Алкани реагують з бромом при нагріванні, реакція проходить по радикальному механізму CH3-CH3 + Br2 → C2H6−xBrx + HCl Ароматичні сполуки реагують по іонному механізму, в присутності каталізаторів (напр. AlBr3): C6H6 + Br2 → C6H5Br + HBrФенол бромується в водному розчині й без каталізатора Кетони бромуються набагато легше за відповідні алкани Ph-CO-CH2-CH3 + Br2 -H+→ Ph-CO-CHBr-CH3 + HBrПриєднання Бром приєднується по подвійному зв'язку алкенів CH2=CH2 + Br2 → Br-CH2-CH2-BrОкиснення З Оксигеном в реакцію не вступає.
Схожі презентації
Категорії