Презентація на тему:
"Ацетилен"
Завантажити презентацію
"Ацетилен"
Завантажити презентаціюПрезентація по слайдам:
Ацетиле н — найпростіший і найважливіший представник ненасичених вуглеводнів з одним потрійним зв'язком (алкінів). Фізичні властивості Ацетилен — безбарвний газ без запаху і смаку. У воді погано розчиняється . При сильному охолодженні переходить відразу в білу кристалічну речовину, минаючи рідкий стан. При температурі +83,6°С випаровується (сублімує), не плавлячись. Будова Молекулярна формулаC2Н2. Структурна і електронна формули: Структурна Електорна
Хімічні властивості У хімічному відношенні ацетилен більш активний, ніж етилен. Висока хімічна активність ацетилену обумовлюється наявністю в його молекулі потрійного зв'язку. Для ацетилену, як і етилену, характерні реакції окиснення, приєднання і полімеризації. Так, ацетилен легко знебарвлює бромну воду, приєднуючи при цьому бром за місцем розриву спочатку одного, а потім і другого зв'язку з утворенням відповідно диброметилену С2Н2Br2, а потім тетраброметану С2Н2Br4:
У присутності порошку нікелю, як каталізатора, ацетилен легко вступає і в реакцію гідрогенізації. При цьому, як і в попередньому випадку, реакція відбувається у дві стадії. Спочатку утворюється етилен, а потім етан: При взаємодії з хлороводнем у присутності каталізатора ацетилен утворює хлорвініл СН2=CHCl: Ця реакція має велике практичне значення, оскільки хлорвініл широко використовується для одержання полімерних матеріалів. Ацетилен вступає також у реакцію гідратації з утворенням ацетальдегіду і реакції полімеризації з утворенням бензолу. На повітрі ацетилен горить чадним полум'ям, а в атмосфері кисню — сліпучо-яскравим полум'ям з виділенням значної кількості тепла. З повітрям ацетилен утворює вибухову суміш.
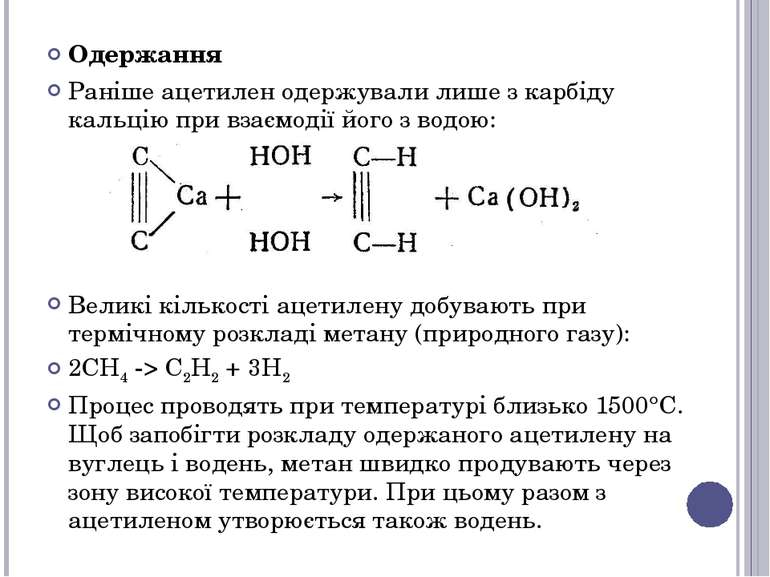
Одержання Раніше ацетилен одержували лише з карбіду кальцію при взаємодії його з водою: Великі кількості ацетилену добувають при термічному розкладі метану (природного газу): 2СН4 -> С2Н2 + 3Н2 Процес проводять при температурі близько 1500°C. Щоб запобігти розкладу одержаного ацетилену на вуглець і водень, метан швидко продувають через зону високої температури. При цьому разом з ацетиленом утворюється також водень.
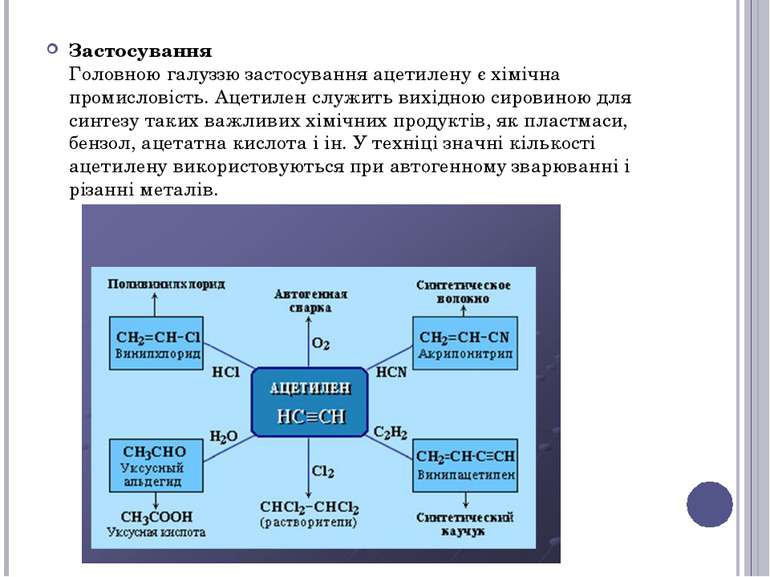
Застосування Головною галуззю застосування ацетилену є хімічна промисловість. Ацетилен служить вихідною сировиною для синтезу таких важливих хімічних продуктів, як пластмаси, бензол, ацетатна кислота і ін. У техніці значні кількості ацетилену використовуються при автогенному зварюванні і різанні металів.
Схожі презентації
Категорії