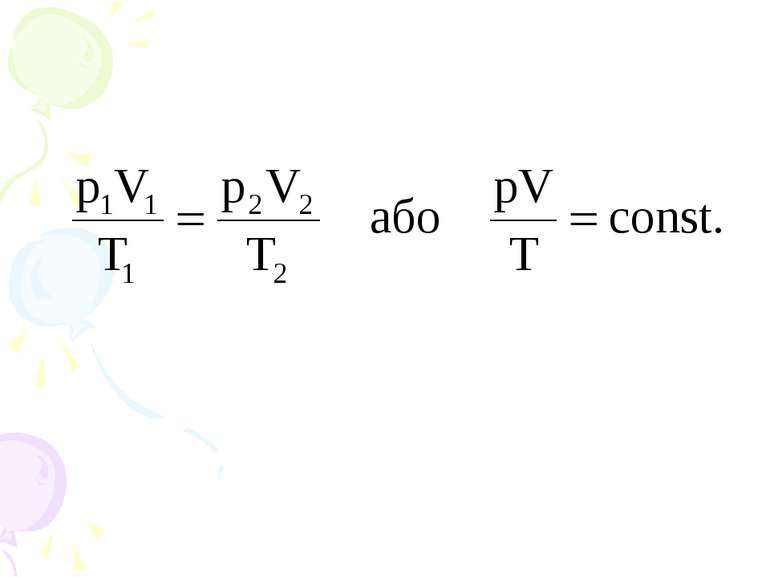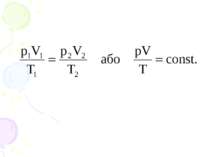Презентація на тему:
Модель ідеального газу. Рівняння стану газу. Газові закони
Завантажити презентацію
Модель ідеального газу. Рівняння стану газу. Газові закони
Завантажити презентаціюПрезентація по слайдам:
Для пояснення властивостей речовини в газоподібному стані в фізиці введемо модель ідеального газу. Подібно до використання в механіці ідеалізованого поняття матеріальної точки, в молекулярній фізиці використовують поняття ідеального газу як величезної сукупності матеріальних точок, які не взаємодіють одна з одною на відстані. За умови достатньо низького тиску і високої температури реальні гази (азот, кисень та ін.) за своїми властивостями близькі до моделі ідеального газу.
Ідеальний газ - це газ, в якому молекули можна вважати матеріальними точками, а силами притягання й відштовхування між молекулами можна знехтувати. У природі такого газу не існує, але близькими за властивостями можна вважати реальні розріджені гази, тиск в яких не перевищує 200 атм і які перебувають при не дуже низькій температурі, оскільки відстань за таких умов між молекулами набагато перевищує їх розміри.
Ідеальний газ – це газ, взаємодія між молекулами якого така мала, що нею можна знехтувати. Об’єм і тиск – механічні величини, які описують стан газу. Температура характеризує внутрішній стан газу. Температура характеризує ступінь нагрітості тіла (холодне, тепле, гаряче). Тепловою рівновагою називають такий стан, коли всі макроскопічні параметри як завгодно довго лишаються незмінними.
Основне рівняння МКТ газів Основне рівняння МКТ газів встановлює зв’язок між мікроскопічними величинами і макроскопічною величиною – тиском. - густина газу
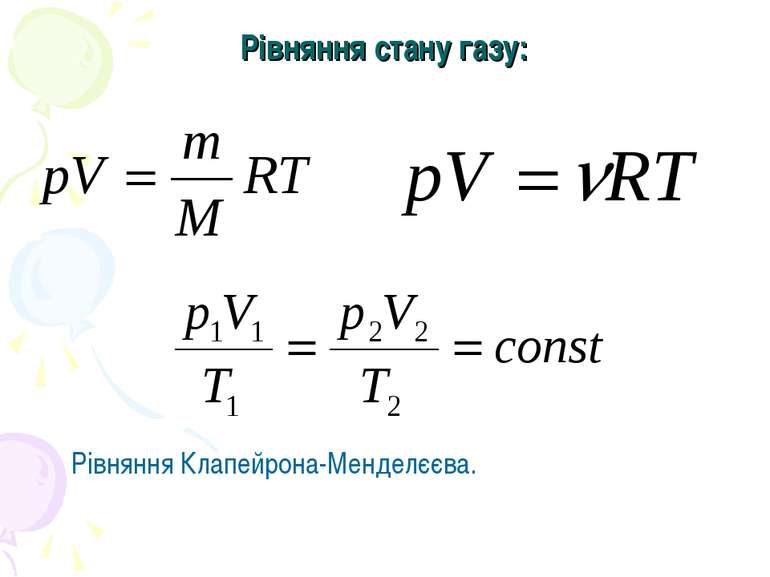
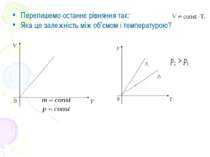
Закон Бойля-Маріотта. Перехід газу з одного стану в інший при сталій температурі називають ізотермічним процесом. Добуток тиску даної маси газу на його об’єм при сталій температурі є величина стала.
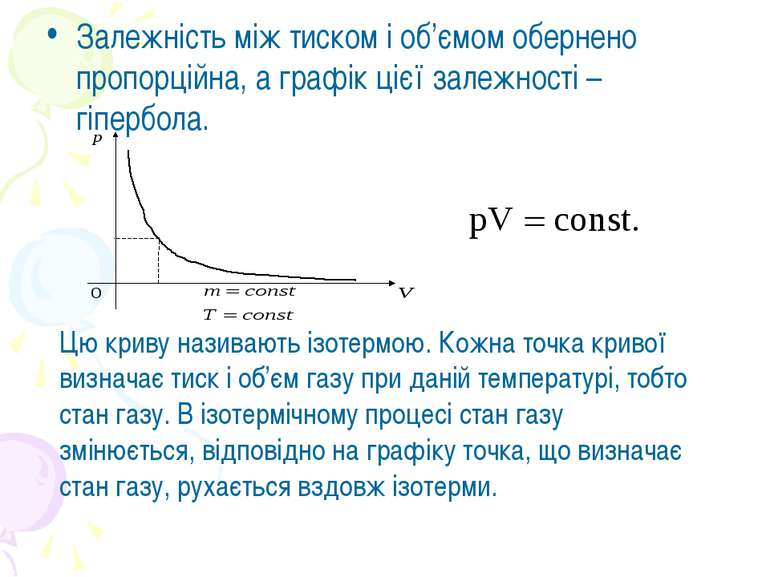
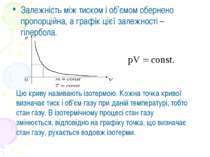
Залежність між тиском і об’ємом обернено пропорційна, а графік цієї залежності – гіпербола. Цю криву називають ізотермою. Кожна точка кривої визначає тиск і об’єм газу при даній температурі, тобто стан газу. В ізотермічному процесі стан газу змінюється, відповідно на графіку точка, що визначає стан газу, рухається вздовж ізотерми.
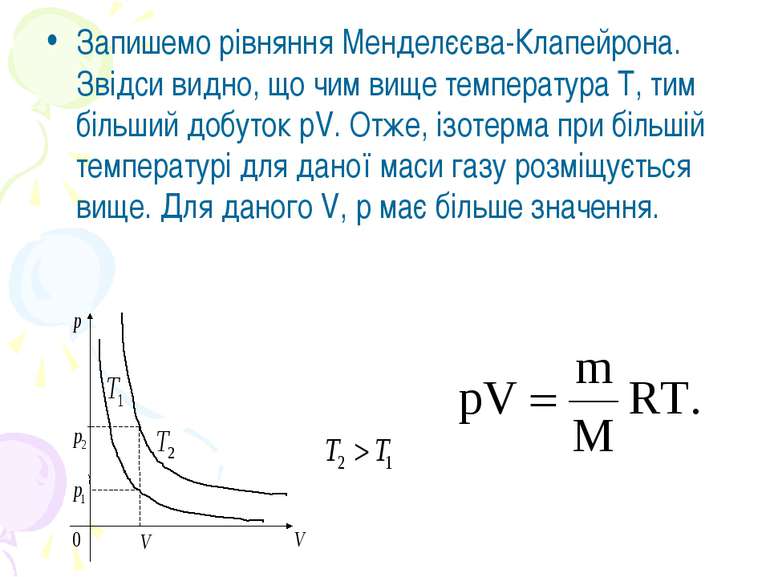
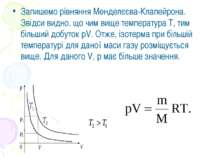
Запишемо рівняння Менделєєва-Клапейрона. Звідси видно, що чим вище температура Т, тим більший добуток pV. Отже, ізотерма при більшій температурі для даної маси газу розміщується вище. Для даного V, р має більше значення.
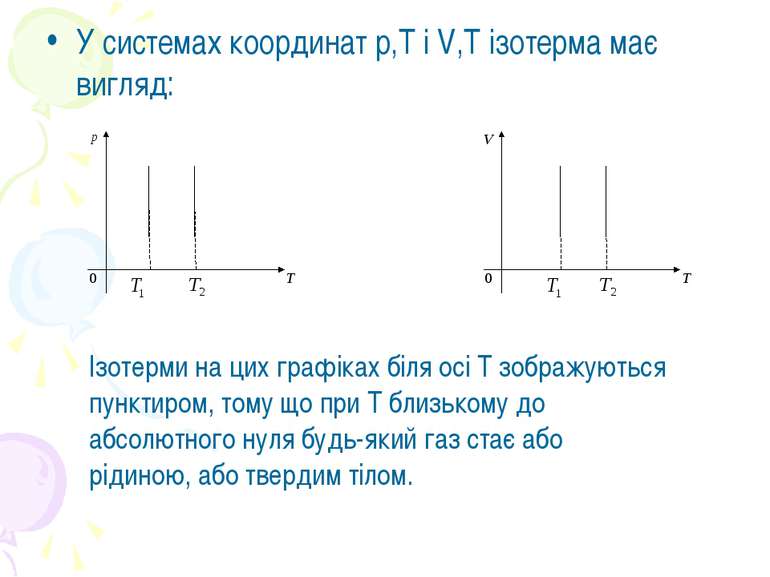
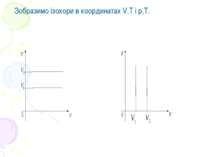
У системах координат р,Т і V,T ізотерма має вигляд: Ізотерми на цих графіках біля осі Т зображуються пунктиром, тому що при Т близькому до абсолютного нуля будь-який газ стає або рідиною, або твердим тілом.
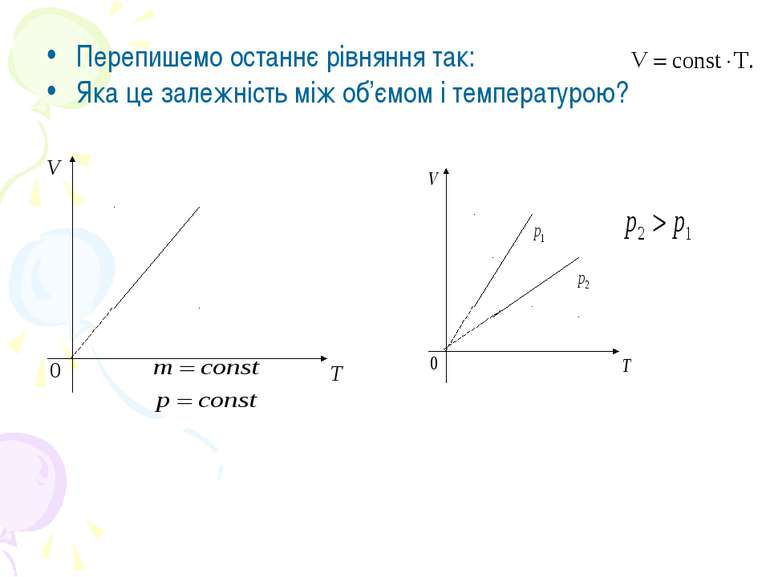
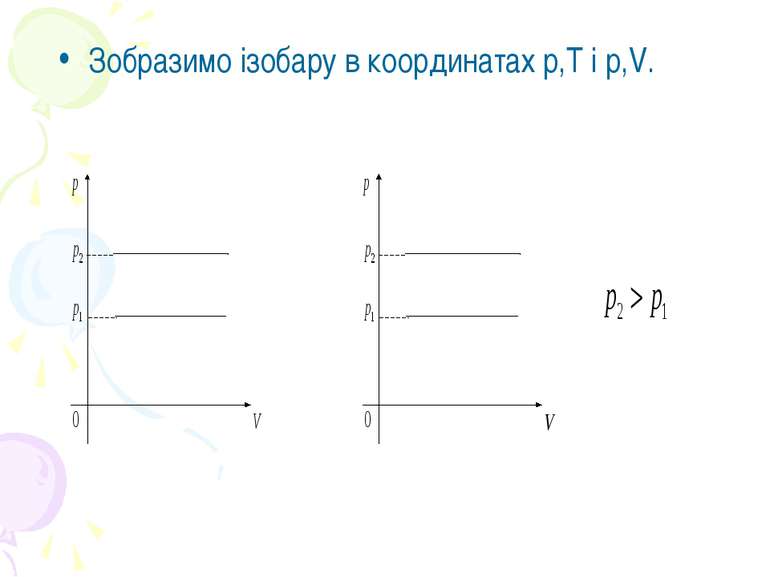
Законом Гей-Люссака. Перехід газу з одного стану в інший при сталому тиску називається ізобарним. При незмінній масі газу і сталому тиску об’єм газу прямо пропорційний його абсолютній температурі.
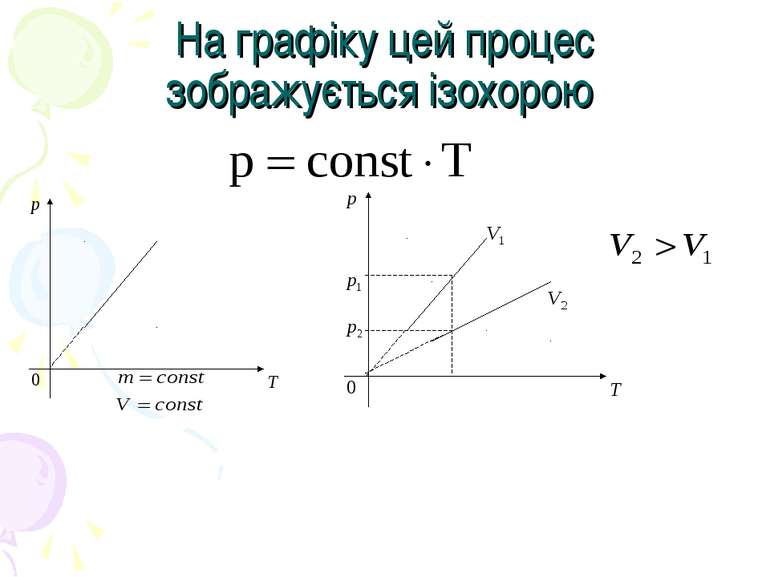
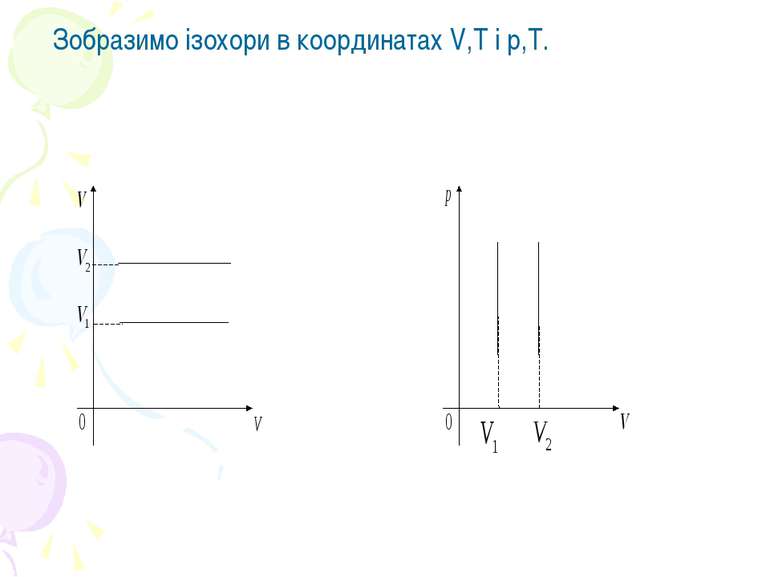
Закон Шарля. Для даної маси газу при сталому об’ємі тиск газу прямо пропорційний його абсолютній температурі.
– Який процес називають ізотермічним? – Записати закон Бойля-Маріотта. – Який процес називають ізобарним? – Записати закон Гей-Люссака. – Який процес називають ізохорним? – Записати закон Шарля.
Схожі презентації
Категорії