Презентація на тему:
Квантово-механічні методи вивчення біооб’єктів
Завантажити презентацію
Квантово-механічні методи вивчення біооб’єктів
Завантажити презентаціюПрезентація по слайдам:
План лекції Елементи квантової оптики 1. Особливості вимірювання і поглинання енергії атомами і молекулами. 2. Явище люмінесценції 3. Лазери та їх використання в медицині 4. Електронний парамагнітний резонанс. 5. Ядерний магнітний резонанс. ЯМР – томографія.
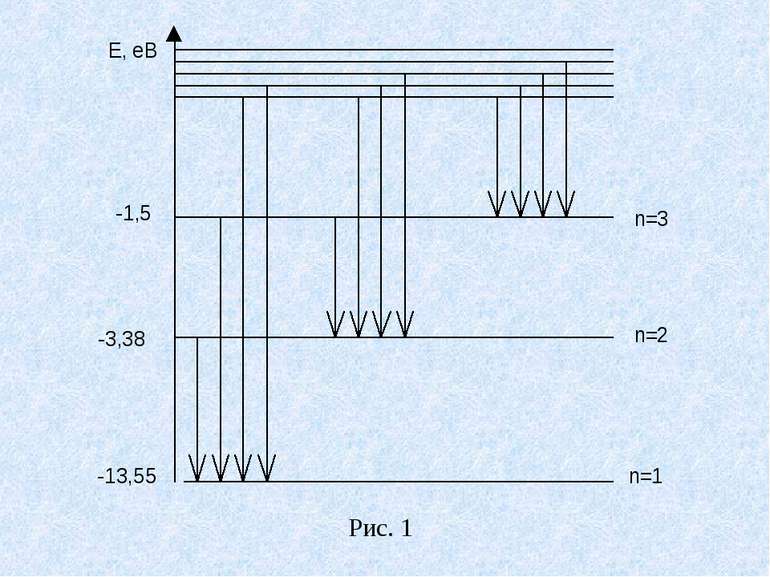
Елементи квантової оптики 1. Особливості вимірювання і поглинання енергії атомами і молекулами. Енергетичні стани атома і молекули схематично зображаються у вигляді рівнів(рис.1). Найнижчий рівень енергії – основний – відповідає основному стану (стаціонарному). При квантових переходах атоми і молекули стрибкоподібно переходять з одного стаціонарного стану в другий, з одного енергетичного рівня на другий. Зміна стану атома зв’язана з енергетичними переходами електронів. В молекулах енергія змінюється також і за рахунок зміни коливань атомів та переходів між обертовими рівнями.
При переході з більш високих енергетичних рівнів на нижчі атом або молекула віддає енергію, при зворотних переходах поглинає. Розрізняють два типи квантових переходів: а) без випромінювання або поглинання електромагнітної енергії. Такий перехід відбувається при зіткненнях атомів і молекул та інших частинок. Розрізняють непружне зіткнення, при якому змінюється внутрішній стан атома і відбувається перехід без випромінювання енергії, і пружне – із зміною кінетичної енергії атома або молекули, але із збереженням внутрішнього стану. б) випромінюванням або поглинанням фотона. Енергія фотона дорівнює різниці енергій початкового і кінцевого стаціонарних станів атома або молекули (1) Формула (1) виражає закон збереження енергії.
В залежності від причин, які зумовлюють квантовий перехід з випромінюванням фотона, розрізняють два види випромінювання: Спонтанне випромінювання, при якому внаслідок внутрішніх причин збуджена частинка самостійно переходить на нижчий енергетичний рівень. Вимушене, або індуковане випромінювання, яке виникає при взаємодії фотона із збудженою частинкою, якщо енергія фотона дорівнює різниці енергій рівнів частинки. В результаті вимушеного переходу в одному напрямі випромінюються два фотона: один первинний, вимушуючий, а другий – вторинний, індукований. Енергія, яка випромінюється атомами або молекулами формує спектр випромінювання, а поглинута енергія – спектр поглинання.
Енергетичні рівні більшості атомів і молекул досить складні. Структура рівнів, а отже і спектрів, залежить не тільки від будови атомів і молекул, але і від зовнішніх умов. Електромагнітна взаємодія електронів приводить до тонкого розщеплення енергетичних рівнів. Вплив магнітних моментів ядер викликає надтонке розщеплення енергетичних рівнів. Зовнішнє електричне і магнітне поле також викликає розщеплення енергетичних рівнів (явища Штарка і Зеємана). Спектри є джерелом різноманітної інформації. Перш за все по виду спектра можна ідентифікувати атоми і молекули, що входить в завдання якісного спектрального аналізу. По інтенсивності спектральних ліній визначають кількість випромінюючих (поглинаючих) атомів – кількісний спектральний аналіз.
Інтенсивність спектральних ліній визначається числом однакових переходів, які відбуваються в секунду, і тому залежить від кількості випромінюючих (поглинаючих) атомів і ймовірності відповідного переходу. При цьому порівняно легко визначають домішки в концентраціях 10-5 -- 10-6 % і склад зразків дуже малої маси – десятки мікрограм. Якщо враховувати, що по спектру речовини можна зробити висновок про її стан, температуру, тиск і т.п., то треба високо оцінити спектральний аналіз як метод дослідження. В залежності від енергії (частоти) фотона, що випромінюється або поглинається атомом (молекулою), розрізняють такі види спектроскопії: радіо -, інфрачервона, видимого випромінювання, ультрафіолетова і рентгенівська. По типу речовини (джерела спектру) розрізняють, атомні та молекулярні спектри і спектри кристалів.
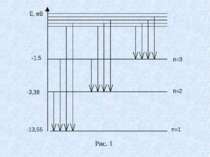
Під оптичними атомними спектрами будемо розуміти ті, які зумовлені переходами між рівнями зовнішніх електронів з енергією фотона порядку декількох електрон-вольт у вільних або слабо взаємодіючих атомах. Найбільший інтерес становлять оптичні атомні спектри випромінювання, які отримують від збуджених атомів. Збудження досягається електричним розрядом в газі, нагріванням у полум’ї газових горілок, електричною дугою або іскрою. Розглянемо, як наприклад спектр атома водню. З формули (1), можна отримати формулу для частоти світла яка випромінюється(поглинається) атомами водню: (2) де і та k – порядкові номери рівнів, між якими відбувається квантовий перехід, R – стала Рідберга.
В спектрі можна виділити групи ліній, які називаються спектральними серіями. Кожна серія відповідає переходам з різних рівнів на один той самий кінцевий. В ультрафіолетовій області розташована серія Лаймана, яка утворюється при переході з вищих енергетичних рівнів на основний рівень. З формули (2) для серії Лаймана отримаємо: (3) Лінія з найбільшою довжиною хвилі має найбільшу інтенсивність. У видимій і близькій ультрафіолетовій ділянках спектра розташована серія Баммера, яка виникає при переходах з вищих рівнів на перший збуджений рівень ( ).
З формули (3) , для серії Баммера отримаємо: (4) В інфрачервоній ділянці спектра розташована серія Пашена, що виникає при переходах з вищих енергетичних рівнів на другий збуджений рівень ( ). З формули (3), для серії Пашена отримаємо: (5)
В інфрачервоній ділянці спектра існують серії Брекмана і Пфунда. Які не показані на рис.(6.6) Для атомного електронного аналізу використовують як спектри випромінювання (емісійний спектральний аналіз) так і спектри поглинання (адсорбційний спектральний аналіз). Поглинання світла – процес, протилежний випромінюванню. Атом, поглинаючи світло, переходить з нижчих енергетичних станів на вищі. При цьому він поглинає кванти енергії тих самих частот які випромінює під час переходу з вищих енергетичних рівнів на нижчі. В медицині атомний спектральний аналіз використовується для визначення мікроелементів в тканинах організму.
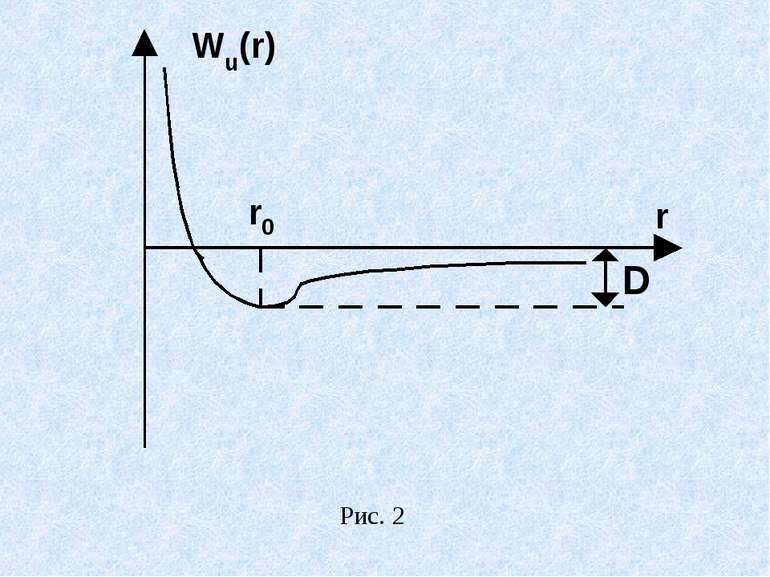
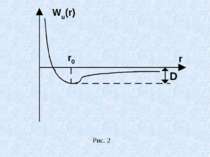
Молекулою називається найменша частинка даної речовини, яка володіє її основними хімічними властивостями. Молекула складається з однакових чи різних атомів, сполучених в одне ціле міжатомними (хімічними) зв`язками. На деякій відстані r0 між атомами в двохатомній молекулі протилежно направлені сили притягання і відштовхування зрівноважуються. Відстані r0 відповідає найменша взаємна потенціальна енергія Wn (r) атомів двохатомної молекули (рис.6.7). Рівноважна міжатомна відстань r0 в молекулі називається довжиною зв`язку. Величина D називається енергією дисоціації або енергією зв`язку. Вона чисельно дорівнює роботі, яку треба виконати, щоб роз`єднати молекулу на атоми і розвести їх на нескінчену відстань один від одного.
Енергія дисоціації чисельно рівна енергії, що виділяється при утворенні молекули, але протилежна їй за знаком (D - від`ємна) D і r0 - кількісні характеристики хімічних зв`язків, незалежно від їх природи. Іонними (гетерополярними) називаються молекули, які утворюються в результаті перетворення взаємодіючих атомів у протилежно електрично заряджені іони, що притягаються. Приклад Na Cl (Na +Cl-), CsI (Cs+ I-) та ін. Метали І групи мають малий потенціал іонізації, а атоми VII групи характеризуються великою електронною спорідненістю – кількістю енергії, що виділяється при приєднанні електрона до нейтрального атома металоїду.
Атомними (гомеополярними) називаються молекули, які виникають в результаті взаємного притягання нейтральних атомів. Такий хімічний зв`язок називається ковалентним. Він має властивість насичення, яка виражається в певній валентності атомів. Так атом водню може бути зв`язаний лише з одним атомом водню, атом вуглецю може зв’язати чотири атоми водню, але не більше. Властивість насичення – це істотно не класичний ефект - виключає можливість пояснення хімічних зв`язків гравітаційними силами. Приклад Н2 . В основі квантомеханічного пояснення ковалентного зв`язку лежить принципова неможливість розрізнити тотожні частинки – електрони в молекулі Н2. Це приводить до існування особливої квантомеханічної обмінної взаємодії, що виникає між двома тотожними електронами .
Молекулярні спектри вже за зовнішнім виглядом значно відрізняються від атомних. Це сукупність більш або менш широких смуг, утворених тісно розміщеними спектральними лініями. Всередині кожної смуги лінії біля одного з її країв розміщуються так тісно, що вони зливаються, і край смуги має розмитий вигляд. Молекулярні спектри за їх характерний вигляд називають смугастими спектрами. З того, що нам відомо про механізм виникнення спектральних ліній, можна зробити висновок, що й у молекулах окрема спектральна лінія повинна виникнути внаслідок зміни енергії молекули.
Повну енергію молекули можна розглянути як таку, що складається з кількох частин : - енергія поступального руху її центра інерції ; - енергія руху електронів в атомах молекули ; - енергія коливального руху ядер атомів молекули ; - енергія обертального руху молекули як цілого і - ядерна енергія атомів у молекулах: (6) Енергія не квантова на і її зміни не можуть привести до створення молекулярного спектра. Якщо не цікавитись оптичними явищами зумовленими ядерними частинками (надтонкою структурою ), то можна знехтувати у виразі (6) . Отже, енергія молекули, яка визначає її оптичні властивості, складається з суми трьох доданків:
За правилом Бора частота кванта, який випромінює молекула при зміні її енергетичного стану, дорівнює: (7) де зміни відповідних частин енергії молекули. Вивчення спектра молекул повинно ґрунтуватися на розгляді кожного з доданків (7). Як показують дослід і теоретичні дослідження, ці доданки мають різну величину : чим і пояснюється наявність частот молекулярних спектрів у різних діапазонах електромагнітних хвиль.
, при цьому виникає електронно-коливально-обертовий спектр. Він складається з різних смуг, а смуги з тісно розташованих ліній, які відповідають обертальним переходам. Якщо , то отримують обертові молекулярні спектри, що складаються з окремих ліній, яким відповідають довжини хвиль порядку 0,1 1 мм Вони спостерігають в далекій інфрачервоній і мікрохвильовій ділянках спектра. При , як правило одночасно і У цьому випадку виникає коливально-обертальний спектр. Він складається з коливальних смуг, які при достатній роздільній здатності спектрального приладу розпадається на окремі обертові лінії. Коливально-обертальний спектр розташований у близькій інфрачервоній ділянці спектра. Якщо , то одночасно і
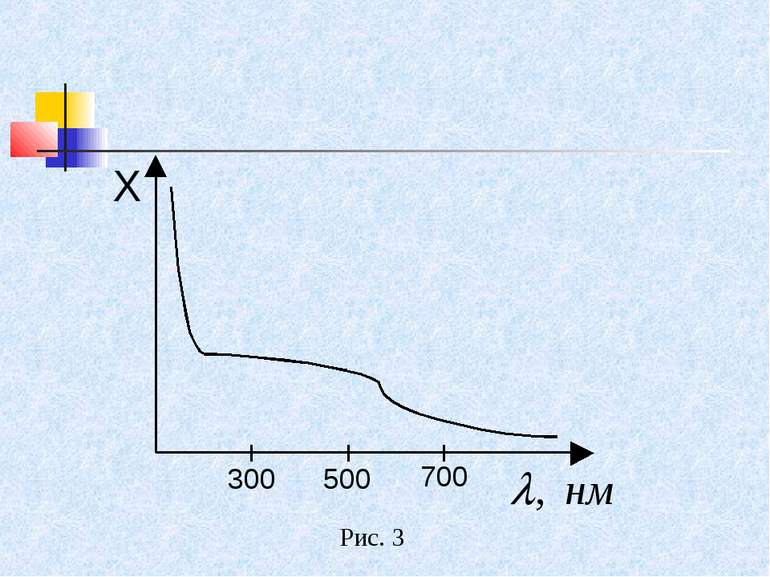
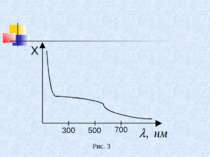
Електронно-коливальні спектри розташовані у видимій і ультрафіолетовій ділянках спектра. У багатьох випадках, зокрема в медицині, молекулярні спектри реєструють як суцільні, не розділяючи ті деталі, які були описані вище. На рисунку 3 зображено спектр поглинання шкіри людини Як бачимо, в ультрафіолетовій ділянці спектра коефіцієнт поглинання Х великий. Шкіра поглинає ультрафіолет у верхніх шарах. У видимій ділянці коефіцієнт поглинання зменшується і залишається сталим у інфрачервоній. Аналіз молекулярних спектрів, особливо в інфрачервоній області широко використовується при вивченні будови молекул.
4. Явище люмінесценції Крім теплового випромінювання тіл при температурі Т, є ще один вид випромінювання тіл, надлишкового над тепловим. Воно називається люмінесценцією і має тривалість понад с, що значно перевищує період ( c ) світлових хвиль. Люмінесценцію можна спричинити бомбардуванням тіл електронами, пусканням крізь речовину електричного струму або дією електричного поля, освітленням видимим світлом, рентгенівськими і гамма-променями, а також деякими хімічними реакціями в речовині. Залежно від способів збудження люмінесцентного світіння розрізняють, відповідно, катодолюмінесценцію, електролюмінесценцію, фотолюмінесценцію, рентгенолюмінесценцію, хемілюмінесценцію.
Люмінесценцію з часом затухання порядку с називають звичайно флуоресценцією. Такий час затухання характерний для рідин і газів. Люмінесценція, яка зберігається тривалий час після припинення дії збудника світіння, називають фосфоресценцією. Таке тривале висвічування мають тверді тіла здатні люмінесценціювати. Розглянемо явище фотолюмінесценції, яке збуджується електромагнітним випромінюванням видимого або ультрафіолетового діапазону. Фотолюмінесценцію вивчав ще Д.Стокс, який встановив, що фотолюмінесценціююча речовина випромінює як правило, світло, що має більшу довжину хвилі, ніж те випромінювання, яке спричиняє люмінесценцію. Це правило Стокса обґрунтоване в квантовій оптиці.
, яка за законом збереження енергії, частково витрачається на створення кванта люмінесцентного випромінювання з енергією , і на різні неоптичні процеси: Справді, фотон світла, збуджує фотолюмінісценцію, має енергію (8) де Е - енергія, витрачена на різні процеси, крім фотолюмінесценції. Звичайно Е>0 і , тобто , що відповідає правилу Стокса. У деяких випадках фотолюмінесцентне випромінювання має довжину хвилі меншу за довжину хвилі збуджуючого світла (так зване антистоксове випромінювання).
Це явище пояснюється тим, що до енергії кванта збуджуючого випромінювання додається енергія теплового руху атомів (молекул або іонів) люмінесціюючої речовини: (9) де а- коефіцієнт, що залежить від природи люмінесціюючої речовини; k- стала Больцмана; Т- абсолютна температура. Антистоксове випромінювання проявляється дедалі чіткіше з підвищенням температури.
На явищі люмінесценції ґрунтується люмінесцентний аналіз, принцип якого такий, Речовина або сама по собі, або після відповідної дії дає характерне люмінесцентне свічення. За характером цього свічення можна, визначаючи інтенсивність лінії у спектрі, визначити не лише якісний, а й кількісний вміст досліджуваної речовини. Люмінесцентний аналіз дозволяє виявити наявність мізерних домішок порядку 10-11 г в 1 г досліджуваної величини. Його успішно застосовують в біології і медицині. Ряд біологічно функціональних молекул, наприклад молекули мембранних білків, володіє флуоресценцією. Параметри флуоресценції чутливі до структури оточення флуоресціюючої молекули, тому по люмінесценції можна вивчати хімічні перетворення і міжмолекулярну взаємодію.
Явище люмінесценції дає змогу створити джерела світла, які мають значні переваги перед лампами розжарювання, що випромінюють у діапазоні видимої ділянки спектра лише 3-5% витрачуваної енергії. Для виготовлення ламп з випромінюванням близьким за складом до денного світла, застосовують ртутні лампи низького тиску (0,01-1,0 мм. рт. ст.) у формі трубок, внутрішню поверхню яких покривають сумішшю люмінесціюючих речовин. Поглинаючи ультрафіолетове випромінювання ртутної пари, ці речовини дають люмінісцентне випромінювання у видимій області, близьке за складом до денного світла. Люмінесцентні лампи не потребують нагрівання, дають випромінювання у вузькій спектральній області і дуже економічні.
Люмінесцентний аналіз мікроскопічних об’єктів проводять з допомогою спеціальних люмінесцентних мікроскопів, в яких замість звичайних джерел світла, використовуються ртутні лампи високого (150-400 мм. рт. ст.) і надвисокого (вище атмосферного) тиску і які мають два світлофільтри. Один з них, розташований перед конденсором, виділяє ту частину спектра джерела світла, яка спричиняє люмінесценцію об’єкта. Другий, розташований між об’єктивом і окуляром, виділяє світло люмінесценції
Люмінесценція, що спричинюється екзотермічними (з виділенням тепла) хімічними процесами в речовині називається хемілюмінесценцією. Окремим випадком хемілюмінесценції є біохемілюмінесценція – свідчення, що супроводжує хімічні реакції біологічних об’єктів ( свідчення гнилих дерев, світлячків та ін.). Доведено, що біохемілюмінесценція виникає при рекомбінації перекисних вільних радикалів ліпідів: RO2+RO2 збуджений продукт продукт + квант біохемілюмінесценції. Інтенсивність біохемілюмінесценції значно зростає при внесенні досліджувані системи солей двохвалентного заліза. Наприклад, якщо внести солі двохвалентного заліза в плазму крові при апендициті і холециститі, то свічення в першому випадку значно слабшає. Отже, біохемілюмінесценція може використовуватися як діагностичний метод. При опроміненні сиворотки крові ультрафіолетом, біохемілюмінесценція зростає для здорових людей і спадає для онкологічних хворих.
5. Лазери та їх використання в медицині Лазер – це термін, що утворився із скороченої фрази: “підсилення світла” за допомогою індукованого випромінювання (в англійській мові). Під індукованим (вимушеним) випромінюванням розуміють випромінювання збуджених атомів під впливом світла, яке на них падає. Особливістю цього випромінювання є те, що світлова хвиля, яка виникає при цьому, не відрізняється від хвилі, що падає на атом, ні за частотою, ні за фазою, ні за поляризацією.
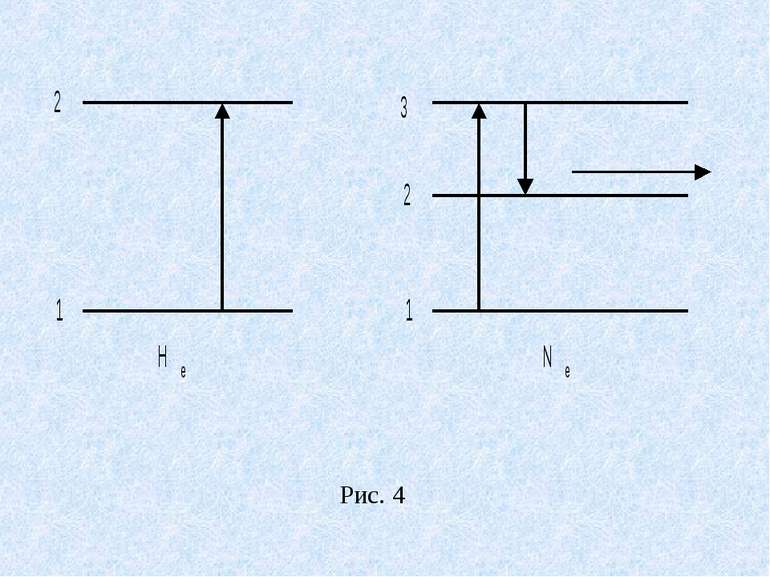
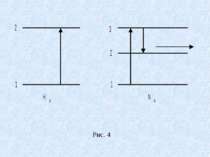
Мовою квантової теорії вимушене випромінювання означає перехід атома з вищого енергетичного стану до нижчого, але не самовільно, як при звичайному випромінюванні, а від зовнішнього впливу. Зрозуміло, що для того, щоб проходив процес підсилення світла, необхідно, щоб концентрація атомів на енергетичних рівнях, які відповідають збудженому стану, була більшою ніж на нижчих рівнях. Такий стан називається інверсною заселеністю. Розглянемо будову і принцип роботи газового гелій неонового лазера. Основним його елементом є розрядна трубка заповнена сумішшю газів гелію і неону. Парціальний тиск гелію – 1мм.рт.ст. , неону – 0,1 мм. рт. ст. Атоми неону є випромінюючими (робочими) атомами гелію допоміжними, які необхідні для створення інверсної заселеності атомів неону. На рис. 4 схематично зображені енергетичні рівні атомів гелію і неону.
При електричному розряді в трубці збуджуються атоми гелію, які переходять в стан 2. перший збуджуючий рівень гелію 2 співпадає з енергетичним рівнем 3 атомів неону. Співударяючись з атомами неону атоми гелію передають їм свою енергію і переводять їх в збуджений стан 3. Таким чином, в трубці створюється активне середовище, яке складається з атомів неону з інверсною заселеністю. Спонтанний перехід окремих атомів неону з рівня 3 на рівень 2 викликає появу окремих фотонів, які взаємодіючи із збудженими атомами неону викликають індуковане когерентне випромінювання. Для збільшення потужності трубку поміщають в дзеркальний резонатор. Відбиваючись від дзеркал, потік фотонів багаторазово проходить вздовж осі трубки, при цьому в процес індукованого випромінювання включається все більше число збуджених атомів і інтенсивність індукованого випромінювання зростає.
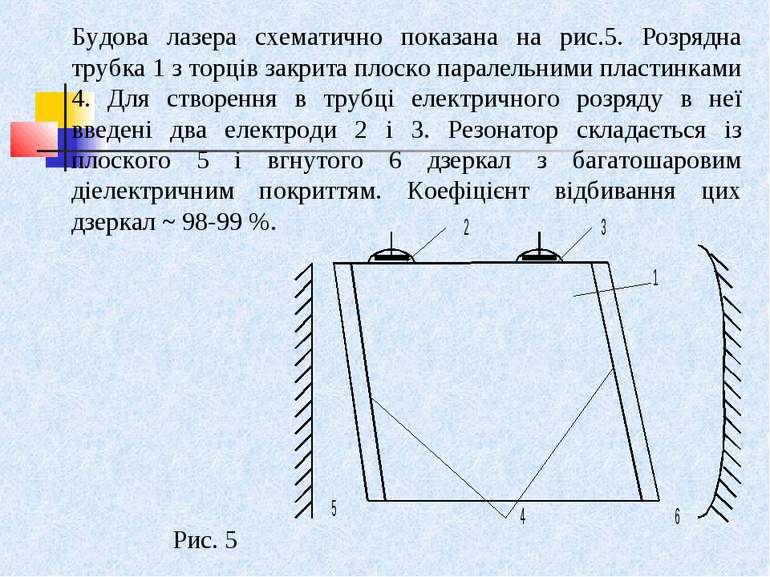
Будова лазера схематично показана на рис.5. Розрядна трубка 1 з торців закрита плоско паралельними пластинками 4. Для створення в трубці електричного розряду в неї введені два електроди 2 і 3. Резонатор складається із плоского 5 і вгнутого 6 дзеркал з багатошаровим діелектричним покриттям. Коефіцієнт відбивання цих дзеркал ~ 98-99 %. Рис. 5
Величезну потужність лазерного променя використовують для випаровування матеріалів у вакуумі, для зварювання і обробки надтвердих матеріалів. Застосовуючи лазери, дістають кольорові об’ємні зображення предметів у фотографії, кіно-і телебаченні ( так звана голографія ). Перспективним є застосування лазерного проміння в засобах зв’язку і наукових дослідженнях. Розглядаючи біологічну дію лазерного випромінювання, можна виділити три напрямки використання його в медицині. До першого напрямку відноситься дія на тканини імпульсним або безперервним випромінюванням з невеликою енергією, коли ще не відбувається зневоднення та випаровування тканин. Це, переважно, застосування лазерної радіації в дерматології та онкології.
Лазерна радіація застосовується у дерматології для лікування бородавок, гнійних гранульом, доброякісних новоутворень шкіри. Лазерний промінь вибірково поглинається забарвленими структурами. Він руйнує лише пігментні ділянки тканини. Ця його здатність використовується для лікування захворювань шкіри, наприклад, для виведення вроджених плям, татуювання. Донедавна вважали невиліковними вроджені червоно – сині плями на шкірі. У таких плямах епідерміс має нормальну структуру, а лише порушена структура сітки кровоносних судин під епідермісом. Для лікування використовують синьо – зелене випромінювання від аргонового лазера, яке проходить через прозорий для нього епідерміс практично не пошкоджуючи його. А далі це випромінювання поглинається гемоглобіном кровоносних судин, зумовлюючи їх термічне пошкодження та закупорку. На цьому місці утворюється безбарвний рубець.
Якщо потужність випромінювання висока, то його можна використати в хірургії як скальпель. Лазерний промінь направляють гнучким світловодом на тканину. Світловод закінчується лінзою та ручкою. Промінь фокусується в точку з діаметром у декілька десятимільярдних часток метра. Таким “скальпелем” розтинають тканину тіла, забезпечуючи стерильність. Розтин проводиться дуже точно і швидко, не має кровотечі, бо висока температура на місці розтину зумовлює миттєву коагуляцію білків і просвіт кровоносних судин закривається.
Лазери використовують в офтальмонології для лікування глаукоми, катаракти, відшарування сітківки тощо. Глаукома – підвищення внутрішньо очного тиску, зумовлене порушенням відтоку внутрішньо очної рідини. Причиною цього є пошкодження початкового відрізку системи відтоку. Створено лазерну установку, яка дає модульований світловий імпульс, енергія в одному імпульсі виділяється за мільйонні долі секунди. При модульованому імпульсі потужність зростає дуже швидко і термічний ефект не встигає розвинутись. Лазерна дія стає холодною, в точці фокусування променя утворюється отвір. Під час відшаровування сітківки використовується лазерне випромінювання з невеликою енергією. Промінь проходить через прозорі тканини ока, не пошкоджуючи їх, фокусується на очному дні у місці відшарування сітківки і там виникає точковий опік. Потім утворюється рубець, що приварює сітківку до розміщеної над нею судинної оболонки, і зір відновлюється.
Використовують лазерний “скальпель” у нейрохірургії, тому що патологічне вогнище можна видалити без механічного контакту з ніжними тканинами нервової системи. Сфокусований до мінімуму лазерний промінь використовують для зшивання судин мозку як на поверхні мозкової тканини, так і в глибині. Зшивають судини діаметром, меншим від 0,5 мм, звичайна хірургічна техніка не дає таких можливостей. Лазерним випромінюванням можна припинити кровотечу (коагуляцію) зі шлунку та дванадцятипалої кишки за допомогою фіброгастроскопії. Використовуються методи оперативного лікування за допомогою лазера у легеневій, серцево – судинній хірургії, у стоматології, отоляритології, урології та інших галузях.
Низько енергетичне лазерне випромінювання не пошкоджує клітини і тканини, створює біостимулюючий ефект, активізує найважливіші процеси життєдіяльності організму. У клітині підвищується активність важливих біоенергетичних ферментів, при цьому посилюється енергетичний обмін у клітинах, зростає біосинтетична активність, тбто збільшується вміст вуглеводів, білків, нуклеїнових кислот тощо. Лазерне випромінювання стимулює поділ клітин, прискорює регенерацію кісткової, сполучної, епітеліальної та м’язової тканини, підвищує здатність до приживлення трансплантатів шкіри, стимулює імунну систему (підсилюється функціональна активність лімфоцитів, лейкоцитів, збільшується вміст білка у крові).
У практичній медицині використовують також лазеропунктуктуру як аналог голкотерапії. для лазерної пункції (ЛП) найчастіше використовують малопотужні лазери, які генерують випромінювання в червоній області спектру (гелій – неонові з =632,8 нм). зручно підводити лазерне випромінювання за допомогою світло волоконної оптики (світловодів). Низькоенергетичне випромінювання не викликає морфологічних змін, але зумовлює певні біохімічні та фізіологічні зсуви в організмі, тобто створює фізіотерапевтичний ефект. Велика різноманітність лазерів, що дають світло усіх кольорів та відтінків, дає можливість діяти на окремі хімічні інградієнти клітин і тканин.
6. Електронний парамагнітний резонанс. Магнітним резонансом називають вибірне поглинання енергії змінного електромагнітного поля речовини, яка перебуває в постійному магнітному полі. Важливим випадком резонансного поглинання є електронний парамагнітний резонанс відкритий у 1945році Є.К. Завойським. Явище електронного парамагнітного резонансу (ЕПР) полягає в поглинанні парамагнітною речовиною мікрохвильового радіовипромінювання за рахунок переходів між підрівнями зееманівського розщеплення енергетичних рівнів. Розщеплення енергетичних рівнів зумовлене дією постійного магнітного поля на магнітні моменти частинок речовини.
Як відомо, магнетон Бора Б є одиницею вимірювання електронних магнітних моментів: (10) де е – заряд, m – маса електрона, відповідно, - стала Дірака-Планка. Подібно до цього величина Б q В є одиницею для вимірювання розщеплення енергетичних рівнів електронів в атомах, які перебувають у магнітному полі. Тут q – фактор Ланде, безрозмірний коефіцієнт q=1, якщо спіновий момент атома дорівнює нулю, і q=2, якщо орбітальний момент атома дорівнює нулю. При ЕПР розглядають лише спіновий магнітний момент атома. Коли атом з магнітним моментом відмінним від нуля, помістити в магнітне поле, то кожен енергетичний рівень цього атома розщеплюється. Розщеплення енергетичних рівнів приводить і до розщеплення спектральних ліній атомів, що знаходяться в магнітному полі. Це явище називають ефектом Зеємана.
Відстань між сусідніми підрівнями визначається за формулою: (11) Розщеплення енергетичних рівнів зумовлене дією постійного магнітного поля на магнітні моменти електронів, які визначають парамагнітні властивості речовини. У зовнішньому магнітному полі магнітні моменти атомів прагнуть орієнтуватися вздовж поля. Водночас відбувається зеєманівське розщеплення енергетичних рівнів і перерозподіл за цими рівнями атомів. Виявляється що заселеність атомами підрівнів зееманівського розщеплення не однакова. Існує переважна орієнтація магнітних моментів атомів уздовж напряму магнітного поля, що відповідає намагніченому стану парамагнітної речовини.
При накладанні на речовину змінного магнітного поля з частотою: (12) яка збігається з частотою переходу між підрівнями зеєманівського розщеплення, відбуватиметься резонанс поглинання електромагнітних хвиль. Воно зумовлене переважанням числа переходів з більш заселених нижніх енергетичних рівнів на менш заселені верхні рівні. Поглинання пропорційне числу поглинаючих атомів в одиниці об’єму речовини. При індукції В=103 мТл резонансна частота v=1011 Гц, що відповідає радіодіапазону шкали електромагнітних хвиль.( =3см)
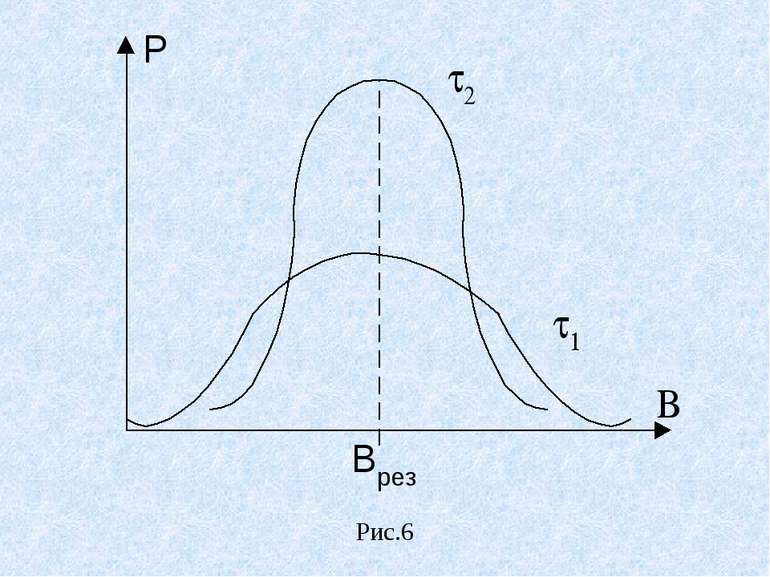
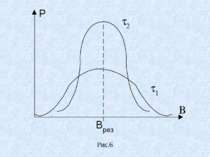
Графік залежності потужності Р поглинутої електромагнітної енергії від індукції магнітного поля В називають спектром ЕПР.(рис.6) При ЕПР поряд з поглинанням енергії має місце зворотній процес. Відбуваються переходи атомів на нижчі енергетичні рівні, а їх енергія передається кристалічній гратці. Цей процес називають спін – гратковою взаємодією і характеризують часом релаксації . Отже резонансне поглинання відбувається в деякому інтервалі В (рис.6). чим менший час спін – Гнаткової релаксації, тим більша ширина лінії ( 1
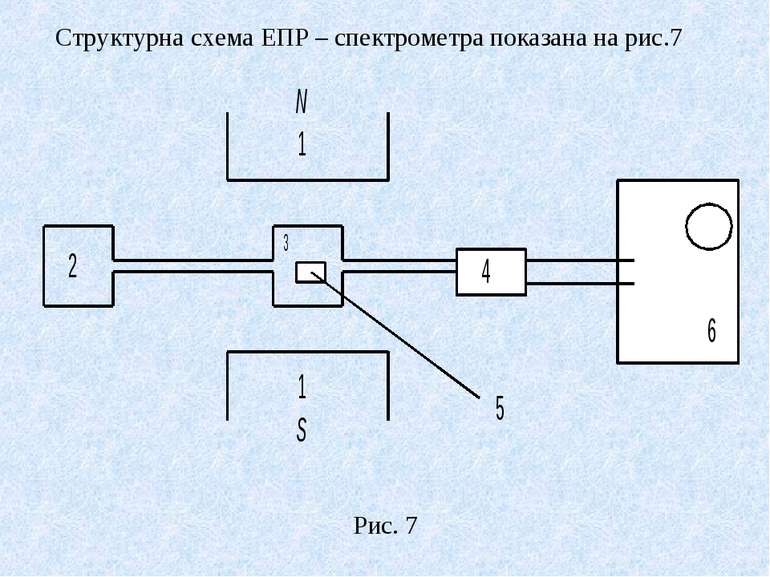
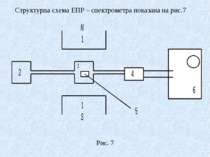
Тут 1 – електромагніт; 2 – генератор електромагнітних хвиль; 3 – об’ємний резонатор, який концентрує падаючу енергію на досліджуваному зразуку5; 4 – приймач; 6 – реєструючий пристрій. В медико – біологічних дослідженнях метод ЕПР використовується для виявлення і дослідження вільних радикалів, фотохімічних процесів, зокрема фотосинтезу, канцерогенності деяких речовин. Якщо досліджувані об’єкти мають діамагнітні властивості, то використовують парамагнітні мітки (радикали кисню), які зв’язуються з молекулами досліджуваного об’єкта. По спектрам ЕПР знаходять положення такої мітки в молекулі. Таким способом можна виявляти розташування різноманітних груп атомів, їх взаємодію і рух. Також використовуються спінові зонди – парамагнітні частинки, які нековалентно зв’язані з молекулами. Зміна ЕПР – спектра спінових зондів дає інформацію про стан оточуючих його молекул. Основними параметрами ЕПР спектра є інтегральна інтенсивність, півширина ліній і q – фактор. Чим більша в’язкість середовища тим важче зонду змінити напрям свого магнітного момента. При онкологічних захворюваннях в’язкість мембран клітин зменшується, що діагностується методом ЕПР.
7. Ядерний магнітний резонанс. ЯМР – томографія. Ядерним магнітним резонансом (ЯМР) називають вибіркове поглинання електромагнітних хвиль певної частоти речовиною у постійному магнітному полі, зумовлене переорієнтацією магнітних моментів ядер. ЯМР є окремим випадком явища магнітного резонансу як і ЕПР, тому між ними існують певні аналогії. Магнітні моменти ядер є сумою магнітних моментів нуклонів. Одиницею вимірювання магнітних моментів нуклонів є ядерний магнетон я (13) де е і mр – заряд і маса протона.
Магнітний момент протона дорівнює 2,79 я , а нейтрона - 1,91 я. Знак “-” означає, що магнітний момент нейтрона або ядра напрямлений протилежно до його спіну. Магнітний момент ядра у постійному магнітному полі може приймати лише дискретну орієнтацію. ЯМР відбувається на ядрах, які мають спін ½. Вони орієнтуються у напрямі поля або проти нього. Це означає, що енергії ядра будуть відповідати підрівні енергії, відстань між якими залежить від індукції магнітного поля В (14) де qя – ядерний фактор Ланде. Якщо в цих умовах на ядро подіяти електромагнітним полем, то можна викликати переходи між підрівнями.
Щоб здійснити ці переходи, а також поглинання енергії електромагнітного поля, необхідно щоб його частота задовольняла умову: (15) ЯМР можна спостерігати при виконанні умови (6.6) лише на вільних атомних ядрах. Експериментальне значення v ядер в атомах і молекулах не відповідає(6.39). необхідно враховувати локальне магнітне поле оточення ядер. Тому повне ефективне магнітне поле, що діє на ядро, характеризується функцією: (16) де - стала екранування, яка по порядку величини рівна10-6 і залежить від електронного оточення ядер.
Отже для даного типу ядер, що перебувають у різному оточенні, резонанс спостерігається при різних частотах, що і визначає хімічний зсув. Якщо ядра в молекулі екрановані по різному, то вони займають хімічно не еквівалентні положення. Спекр ЯМР такої молекули містить стільки резонансних ліній, скільки хімічно не еквівалентних груп ядер даного типу є в молекулі. Інтенсивність кожної лінії пропорційна числу ядер в даній групі. Спектри твердих тіл мають більшу ширину а ніж спектри рідини. По числу і положенню спектральних ліній можна встановити структуру молекул. ЯМР спостерігають за допомогою радіоспектроскопів, що складаються з таких основних частин:
катушка зі зразком; полюси магніту; ВЧ-генератор;; підсилювач і детектор; генератор моделюючої напруги; катушка модуляції поля В; осцилограф. Генератор створює поле з індукцією В1, а перпендикулярне поле В створене постійним магнітом. При відбувається резонансне поглинання, внаслідок чого у контурі падає напруга. Слід напруги реєструється детектором, підсилюєтьсяі подається на осцилограф. Поле В1 підібране так, що воно змінюється на 10-3 Тл з частотою від 50 Гц до 1 кГц і таку саму частоту має горизонтальна розгортка осцилографа. На екрані дістаємо смугу поглинання.
З усіх видів комп’ютерних томографів найбільш перспективною є система, де використовується явище ядерного магнітного резонансу. Ця система дає змогу одержати зображення будь-яких перерізів людського організму. Для розуміння принципу дії томографа ще раз коротко пригадаємо суть самого явища ЯМР. Якщо ядра фосфору, фтору, водню та інших елементів, що містяться в організмі людини, подібні до “дзиги”, яка обертається навколо своєї осі, помістити в постійне магнітне поле, то осі “дзиг” орієнтуються в напрямі ліній індукції поля: одні вздовж поля, інші-проти нього. Якщо перпендикулярно прикласти змінний високочастотний сигнал ( радіохвилі ), то “ядерні дзиги” отримують енергію і обертаються навколо силових ліній магнітного поля на чітко визначеній резонансній частоті ( звідси і назва-ядерний магнітний резонанс ).
У певний момент вимикаємо струм, який створював радіовипромінювання, і дія його на ядра припиняється. Однак ядра за інерцією ще деякий час продовжують прецесію. Поступово цей рух послаблюється, але весь час кажуть, що “звучить” спінове ехо. За значенням та швидкістю його спаду можна судити про властивості речовини: чим більша густина, тим швидше затухає ехо. Нехай об’єкт знаходиться у магнітному полі певної форми та індукції. Розгойдавши “ядерні дзиги “, будемо реєструвати їх спінове ехо. Обробивши на ЕОМ результати вимірювань, отримаємо просторовий розподіл концентрації ядер, а також час, протягом якого заспокоюється спінове ехо- ЯМР- томограму. Вода-основна складова частина біологічних об’єктів, тому досліджуваним сигналом під час ЯМР- томографії є сигнал протонного магнітного резонансу молекул води.
Частота ЯМР пропорційна індукції зовнішнього магнітного поля і тому, створюючи градієнт поля у тканині, одержуємо спектр ЯМР, в якому інтенсивність сигналу за певної частоти буде характеризувати відносний вміст води у тій частині тканини, яка знаходиться в області певного значення магнітного поля. Досліджуваний біологічний об’єкт розглядають із різних сторін у магнітному полі. За одержаними проекціями, використовуючи комп’ютер, отримують зображення. У різних частинах зразка буде різна амплітуда ЯМР- сигналу, і це дає змогу досліджувати кожну точку біологічного об’єкта. Таким способом можна виявити розмір та положення пухлин в організмі. Тканинам пухлин властива більша намагніченість, тому сигнал ЯМР води пухлини насичується легше, ніж сигнал нормальної тканини. Такий метод дослідження можна використовувати для одержання зображень органів усередині грудної клітки або певних ділянок в області черепа. Окрім дослідження протонного резонансу, у біологічних дослідженнях використовують спектроскопію ЯМР на інших ядрах.
Якщо ЯМР- томограф встановити на певну частоту радіовипромінювання та індукцію поля, то відреагують ядра певного типу атомів, наприклад, водню, фосфору. Можна дослідити і ядра інших елементів. Таким чином, ЯМР- томографія дає можливість досліджувати тонкі хімічні процеси в біотканинах людини. ЯМР- томографія має не лише великі діагностичні можливості, але й гарантує повну безпеку для пацієнта. Це метод візуалізації та точних вимірювань внутрішніх структур складних об’єктів без їх руйнування.
Схожі презентації
Категорії