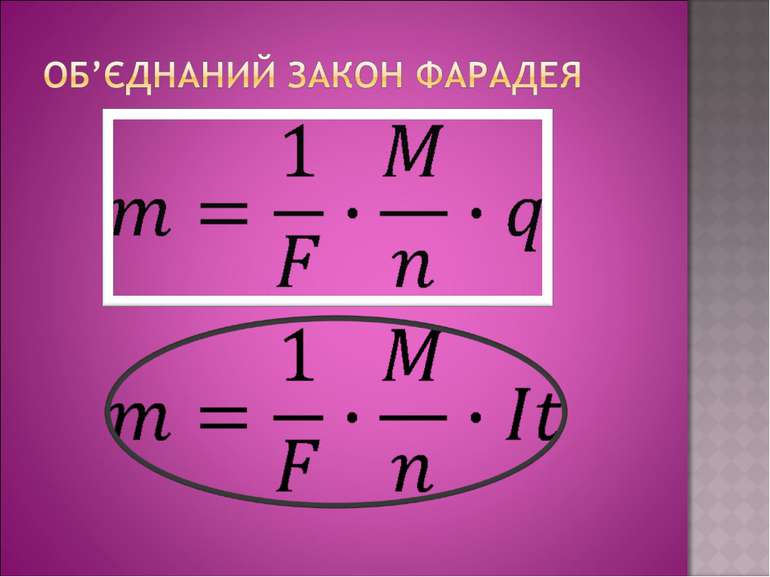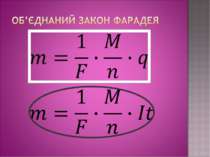Презентація на тему:
Електронний струм у розчинах
Завантажити презентацію
Електронний струм у розчинах
Завантажити презентаціюПрезентація по слайдам:
Ввести поняття електролітів, пояснити суть електролізу, сформувати закони Фарадея, ознайомити учнів із основними фізичними величинами, що входять до математичного апарату теми,розглянути застосування процесу електролізу в практиці. Розвивати логічне мислення, творчі та пошукові здібності учнів, вміння аналізувати та робити висновки, систематизувати знання. Актуалізувати вивчене з хімії. Виховувати уважність, креативність, нестандартний підхід до вирішення поставленого завдання.
Електроліз - фізико-хімічне явище, що полягає у виділенні на електродах складових частин розчинених речовин при проходженні електричного струму через розчин або розплав електроліту. Електроліз - окислювально-відновлювальна реакція. Над слайдом працював учень 9 класу Луцишин Петро.
міграція реагуючих частинок під дією електричного поля до поверхні електрода перехід заряду з частки на електрод або з електрода на частку Виконав Луцишин Петро.
Електро ліз – розклад речовин (напр., води, розчинів кислот, лугів, розчинених або розплавлених солей тощо) постійним електричним струмом.
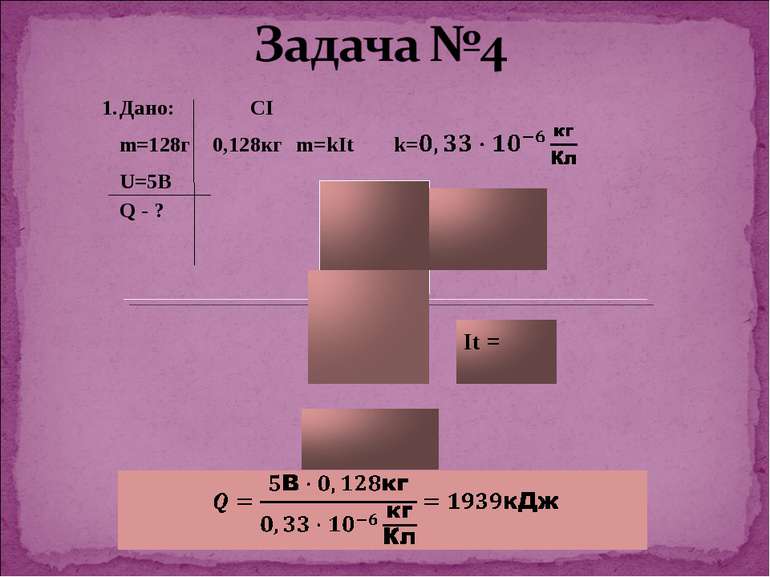
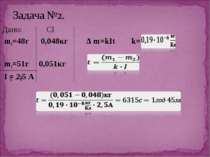
Дослід 3 Нікелювання З досліду видно, що чим більша сила струму в колі та довше триває процес, тим більша кількість речовини осідає на катоді. Звідси слідує 1-й закон Фарадея: маса виділеної речовини прямо пропорційна силі струму в колі та часу за який відбувається процес електролізу. Майкл Фарадей
K- електрохімічний еквівалент, величина, яка чисельно рівна масі речовини, що виділилась на електроді під час проходження крізь електроліт заряду в 1 Кл. Його знаходять з таблиці і в кожної речовини к має різне значення. Наприклад: алюміній – к=0,093*10-6 кг/Кл, Срібло к=1,12*10-6 кг/Кл. Звідси висновок: електрохімічний еквівалент, як і маса виділеної на катоді речовини буде залежати від самої речовини , а саме від молярної маси і валентності. Дослідним шляхом Фарадей встановив 2-й закон.
Електрохімічні еквіваленти різних речовин прямо пропорційні їхній молярній масі M та обернено пропорційні їх валентності n.
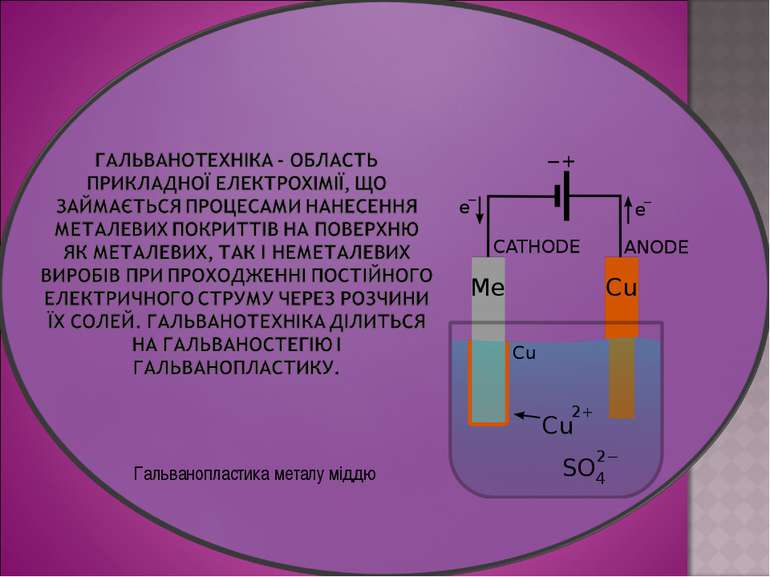
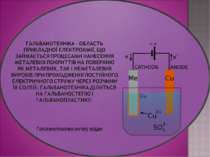
Електроліз широко застосовують у промисловості. Електролізом одержують найбільш активні метали (К, Na, Ca, Mg, Al) і найбільш активні неметали (фтор і хлор). Електроліз також використовують для синтезу деяких складних речовин — їдкого натрію (NaOH), їдкого калію (KOH), бертолетової солі (KClO3). Електроліз також використовують для покриття поверхні металевих виробів шаром більш стійкого металу з метою захисту від корозії, наприклад цинкування, хромування, нікелювання. Шляхом електролізу метали можна очищувати від домішок. Електроліз застосовують у гальванотехніці ― електролітичному осадженні металів на поверхню металевих і неметалевих виробів. Це дозволяє знімати з різних предметів точні копії, які легко відокремити від оригіналу. Такий метод репродукування називають гальванопластикою
отримання лужних, лужноземельних металів та алюмінію; отримання галогенів, водню і кисню; нанесення металевих покриттів на поверхню виробів - нікелювання, хромування, золочення (гальваностегія); виготовлення рельєфних металевих копій (гальванопластика); очищення кольорових металів від домішок (рафінування). підготував учень 9 класу Луцишин Петро
§ 27. Вправа12,ст. 108 (підручник). №11,41,11.46. Збірник задач. Цікаве запитання: Як залежить опір електролітичної ванни від температури?
Схожі презентації
Категорії