Презентація на тему:
Електричний струм в розчинах і розплавах електролітів. Закон Фарадея.
Завантажити презентацію
Електричний струм в розчинах і розплавах електролітів. Закон Фарадея.
Завантажити презентаціюПрезентація по слайдам:
план 1 Електричний струм. 2 Рідини за електричними властивостями . 3 Розчини лугів, солей у воді . 4 Електролітична дисоціація. 5 Електроліти та неелектроліти. 6 Електроліз. 7 Закон Фарадея.
Що таке електричний струм? Електри чний струм — впорядкований рух заряджених частинок у просторі. У металах це електрони, напівпровідниках - електрони та дірки, у електролітах - позитивно та негативно заряджені іони, у іонізованих газах — іони та електрони. За напрямок струму вибирають рух позитивно заряджених частинок. Таким чином, напрямок струму в металах протилежний напрямку руху електронів.
Електроліти — речовини, розчини яких проводять електричний струм. До електролітів належать водяні розчини солей, кислот і лугів. Електролітична дисоціація — розпад молекул електроліту на позитивні й негативні йони в розчині. Електроліз — зміна хімічного складу розчину або розплаву, зумовлена втратою або приєднанням електронів йонами. Закон Фарадея (закон електролізу) маса m речовини, що виділилась на електроді, пропорційна заряду q, що пройшов через електроліт
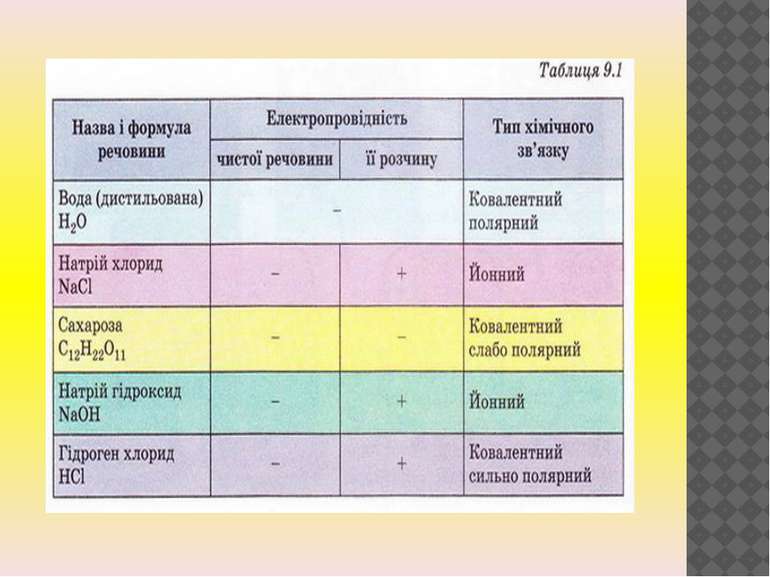
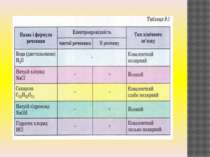
Розчини кислот, лугів, солей у воді. Здатність розчинів багатьох речовин проводити електричний струм була виявлена Майклом Фарадеєм на початку XIX століття. Дослідження електропровідності розчинів показало, що розчини та розплави багатьох речовин (наприклад, кухонної солі) проводять електричний струм. Натомість дистильована вода, кристалічні речовини та розчини деяких інших речовин (наприклад, цукрози) не проводить електрики, водні розчини або розплави яких проводять електричний струм, були названі електролітами. Було виявлено, що до електролітів належать розчинні солі, луги і кислоти — речовини з йонними та ковалентними полярними типами хімічного зв’язку.тричний струм.
Рідини за електричними властивостями На які групи діляться речовини за своїми електричними властивостями? Провідники та діелектрики (ізолятори) А рідини відносяться до провідників електрики або до діелектрика? Рідини за своїми електричними властивостями діляться на провідники (розчин солі, кислоти у воді і т.п. ) і діелектрики (дистильована вода, розчин цукру у воді). Речовини, водні розчини (або розплави) які є провідниками, називають електролітами.
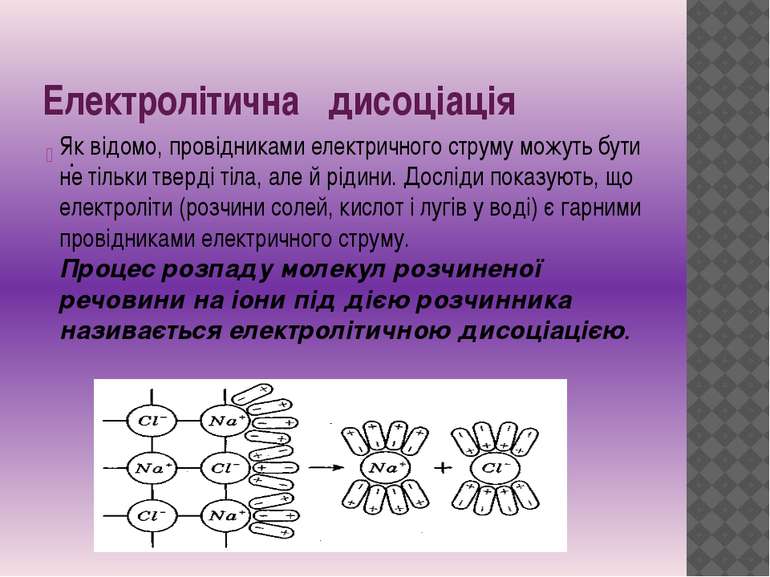
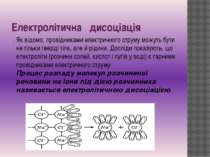
Електролітична дисоціація . Як відомо, провідниками електричного струму можуть бути не тільки тверді тіла, але й рідини. Досліди показують, що електроліти (розчини солей, кислот і лугів у воді) є гарними провідниками електричного струму. Процес розпаду молекул розчиненої речовини на іони під дією розчинника називається електролітичною дисоціацією.
рекомбінація Молекули речовин, що розчиняються, складаються із взаємозв'язаних іонів протилежних знаків (наприклад Na+Cl-, Н+ Cl-, К+ Cl-, Сu++SO4--). Сили тяжіння між іонами забезпечують цілісність таких молекул. Взаємодія цих молекул із полярними молекулами розчинника, наприклад води, приводить до послаблення взаємного тяжіння протилежно заряджених іонів. Із збільшенням температури ступінь дисоціації зростає, і, отже, збільшується концентрація позитивно й негативно заряджених іонів. У розчині може відбуватися також і процес, що називають рекомбінацією. Рекомбінація — процес об'єднання іонів у нейтральні молекули. Між процесами електролітичної дисоціації й рекомбінації іонів за незмінних умов встановлюється динамічна рівновага, коли число молекул, що розпадаються на іони в одиницю часу, дорівнює числу пар іонів, які за цей час об'єднуються в нейтральні молекули. Іони в електролітах рухаються хаотично до тих пір, поки в рідину не опускаються електроди (катод і анод). Тоді на хаотичний рух іонів накладається їx впорядкований рух до відповідних електродів і в рідині виникає електричний струм:
Електроліти та неелектроліти Неелектролітами називають речовини, водні розчини або розплави яких не проводять електричний струм. До таких речовин належать кисень, водень, цукроза, спирт. Для них характерним є ковалентний неполярний або слабополярний зв’язок. Наявність електричного струму в розчинах солей, лугів та кислот свідчить про існування в розчинах цих речовин заряджених частинок, які здатні переміщатися. Такими частинками в розчинах є йони. Під час розчинення йонних сполук (солей та лугів) під впливом електростатичних сил притягання між йонами кристалічних ґраток і диполями води утворюються зв’язки. Молекули води притягуються своїми негативними полюсами до позитивно заряджених йонів кристалічної ґратки, а позитивними полюсами – до негативно заряджених йонів. У результаті гідратації кристалічні ґратки руйнуються – утворюються гідратовані йони. Завдяки дифузії гідратовані йони переміщуються в об’єм розчину і вільно та хаотично рухаються.
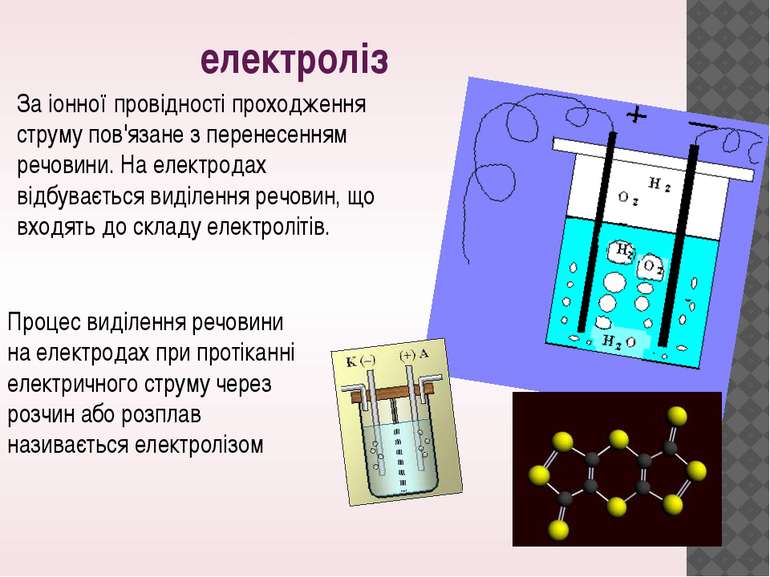
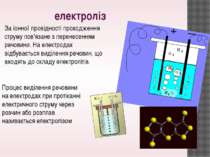
електроліз Процес виділення речовини на електродах при протіканні електричного струму через розчин або розплав називається електролізом За іонної провідності проходження струму пов'язане з перенесенням речовини. На електродах відбувається виділення речовин, що входять до складу електролітів.
Нехай за час t через електроліт буде перенесено заряд . Кількість іонів, які досягли електрода, дорівнюватиме: де q0 = Ze - заряд іона; Z - валентність іона; e - елементарний заряд. Кількість іонів N дорівнює кількості атомів речовини, що виділиться на електроді, а маса виділеної речовини Розглянемо явище електролізу на прикладі мідного купоросу. В результаті електролітичної дисоціації CuSO4 = Cu2 + + SO4 2 +. Позитивно заряджені іони міді під дією електричного струму будуть переміщуватися до катода, де отримають електрони і виділяться на ньому у вигляді нейтральних атомів міді (рис. 4.3.4). Негативно заряджені іони під дією електричного поля перемістяться до анода, де віддадуть вільні електрони і також виділяться на ньому.
Нехай за час t через електроліт буде перенесено заряд . Кількість іонів, які досягли електрода, дорівнюватиме: де q0 = Ze - заряд іона; Z - валентність іона; e - елементарний заряд. Кількість іонів N дорівнює кількості атомів речовини, що виділиться на електроді, а маса виділеної речовини де m0 - маса одного атома, ; m - молярна маса речовини. Для кожного хімічного елемента можна у виразі (4.3.3) виділити сталу величину k, яку називають електрохімічним еквівалентом речовини: . У СІ електрохімічний еквівалент вимірюють у кілограмах на кулон: [k] = кг/Кл. Виходячи з цього можна записати, що m = kq = kIDt. (4.3.5) Маса речовини, яка виділяється на катоді за час Dt, пропорційна силі струму і часу. Це твердження, встановлене експериментально Фарадеєм (1831 р.), має назву першого закону Фарадея для електролізу.
Закон Фарадея У 1834 р. він дослідним шляхом встановив, що за певний час даний струм завжди виділяє з розчину електроліту одну і ту ж кількість даного хімічного елемента.
Схожі презентації
Категорії