Презентація на тему:
"Електричний струм у розчинах і розплавах електролітів"
Завантажити презентацію
"Електричний струм у розчинах і розплавах електролітів"
Завантажити презентаціюПрезентація по слайдам:
Явища електролітичної дисоціації і електролізу Електричний струм у розчинах і розплавах електролітів
Електролітична дисоціація Із курсу хімії нам вже відоме таке явище як електролітична дисоціація. Це розпад електролітів (речовин, розплавів або розчинів, які проводять струм) на йони при розчиненні у полярному розчиннику.
Внаслідок взаємодії молекул розчинюваної речовини і розчинника послаблюється взаємодія між йонами розчинюваної речовини і молекула може розпастися на йони.
В електроліті з'являються вільні носії зарядів і він починає проводити струм. Оскільки заряд у водних розчинах чи розплавах електролітів переноситься йонами, то таку провідність називають йонною. За йонної провідності проходження струму пов'язано із перенесенням речовини. Процес, що відбувається далі називається електролізом.
Електроліз На електродах відбувається виділення речовин, які входять до складу електроліту. Цей процес і називають електролізом. На аноді негативно заряджені частинки віддають свої зайві електрони (окиснювальна реакція), а на катоді позитивні йони отримують електрони (реакція відновлення). У розчині може відбуватися процес об’єднання йонів у нейтральні молекули, такий процес називається рекомбінацією.
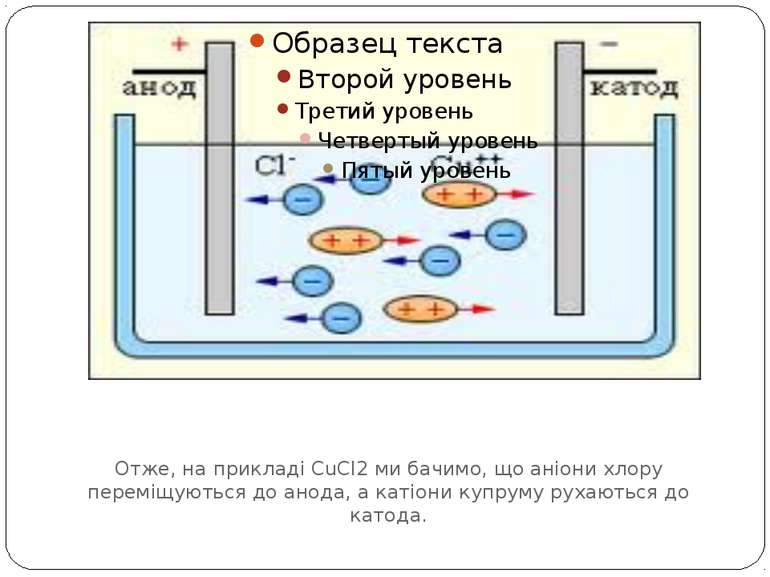
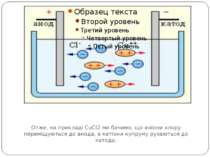
Елекроліз водного розчину хлориду Отже, на прикладі CuCl2 ми бачимо, що аніони хлору переміщуються до анода, а катіони купруму рухаються до катода.
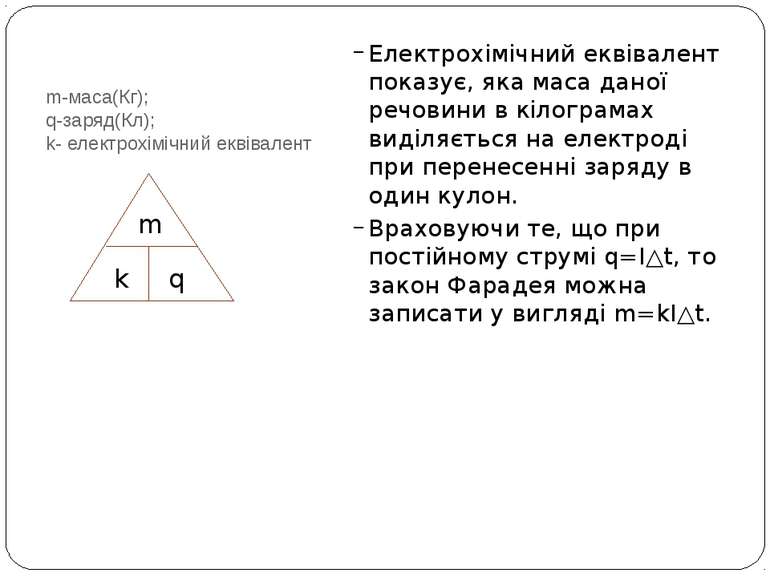
Після досліджень електролізу У.Нікольсона і А.Карлейла у 1833 році Майклом Фарадеєм був установлен закон, який дістав назву перший закон електролізу або закон Фарадея. Він звучить так: маса речовини m, що виділяється на аноді або катоді під час проходження електричного струму в електролітах, прямо пропорційна заряду q, який при цьому переноситься йонами через електроліт: m=kq. Майкл Фарадей
m-маса(Кг); q-заряд(Кл); k- електрохімічний еквівалент Електрохімічний еквівалент показує, яка маса даної речовини в кілограмах виділяється на електроді при перенесенні заряду в один кулон. Враховуючи те, що при постійному струмі q=I△t, то закон Фарадея можна записати у вигляді m=kI△t. m k q
Другий закон електролізу Другий закон Фарадея визначає величину електрохімічного еквівалента k. Електрохімічний еквівалент речовини прямо пропорційний молярній масі речовини M і обернено пропорційний її валентності n: Величина F називаеться числом (сталою) Фарадея: F=96 500 Кл/моль
Явище електролізу має широке застосування в електрометалургії (добування чистих металів); рафінуванні (очищенні) металів; у гальваностегії (нанесення металевих покриттів для запобігання корозії металів); у гальванопластиці (виготовлення копій з матриць) тощо. Будову хімічних джерел струму (гальванічних елементів та акумуляторів) також засновано на процесах взаємодії металів з електролітами.
Дякуємо вам за перегляд презентації на тему: «Електричний струм у розчинах і розплавах електролітів».
Схожі презентації
Категорії