Презентація на тему:
Електричний струм у розчинах і розплавах електролітів
Завантажити презентацію
Електричний струм у розчинах і розплавах електролітів
Завантажити презентаціюПрезентація по слайдам:
На які групи поділяються речовини за своїми електричними властивостями? провідники напівпровідники діелектрики А рідини належать до провідників електрики чи до діелектриків?
До якого класу речовин належать за своїми електричними властивостями рідини? діелектрики провідники напівпровідники
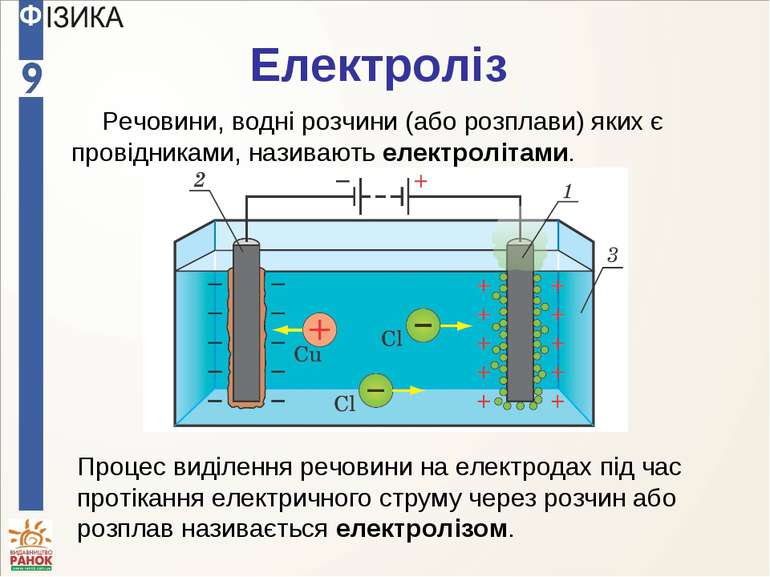
Електроліз Речовини, водні розчини (або розплави) яких є провідниками, називають електролітами. Процес виділення речовини на електродах під час протікання електричного струму через розчин або розплав називається електролізом.
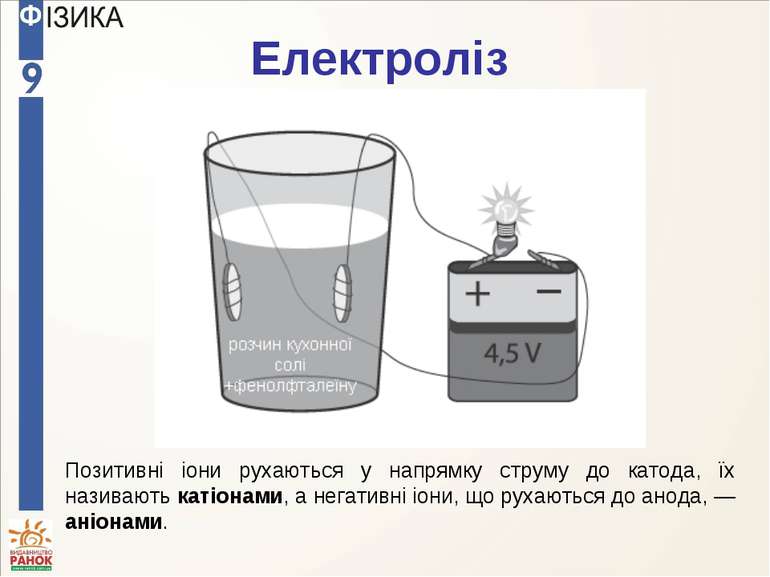
Електроліз Позитивні іони рухаються у напрямку струму до катода, їх називають катіонами, а негативні іони, що рухаються до анода, — аніонами.
Майкл Фарадей (1791–1867) — англійський фізик, засновник вчення про електромагнітне поле. Виявив хімічну дію електричного струму, встановив закони електролізу.
Перший закон Фарадея Кількість речовини, яка виділяється на електроді, прямо пропорційна електричному заряду, що пройшов через електроліт. Маса m речовини, яка виділяється на електроді під час електролізу, пропорційна силі струму I та часу t його проходження: де k — коефіцієнт пропорційності, який одержав назву електрохімічний еквівалент речовини.
Електрохімічний еквівалент речовини Електрохімічний еквівалент речовини чисельно дорівнює масі цієї речовини, яка виділяється на електроді за 1 с під час проходження через електроліт струму силою 1 А:
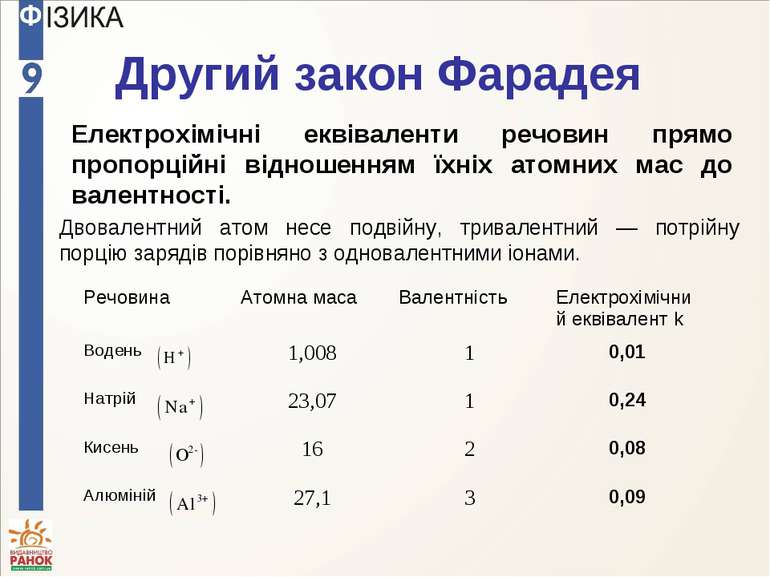
Другий закон Фарадея Електрохімічні еквіваленти речовин прямо пропорційні відношенням їхніх атомних мас до валентності. Двовалентний атом несе подвійну, тривалентний — потрійну порцію зарядів порівняно з одновалентними іонами. Речовина Атомна маса Валентність Електрохімічний еквівалент k Водень 1,008 1 0,01 Натрій 23,07 1 0,24 Кисень 16 2 0,08 Алюміній 27,1 3 0,09
Задача Під час сріблення виробу на катоді за 30 хв утворилося срібло масою 4,55 г. Визначте силу струму при електролізі. Дано Із таблиці: Відповідь:
Домашнє завдання 1. Вивчити теоретичний матеріал уроку. 2. Розв’язати задачі за посібником: Задача 11.7. Скільки срібла осіло на катоді електролізної установки, якщо процес електролізу тривав 10 хв при силі струму 25 А? Задача 11.24. За який час на катоді електролітичної ванни виділиться 40 г хрому, якщо електроліз проходить при силі струму 25 А? 3. Додаткове завдання. Підготувати повідомлення на тему «Електроліз і його практичне застосування».
Схожі презентації
Категорії