Презентація на тему:
Дослідженння реагетнтної утилізації високотоксичних сірковмісних речовин
Завантажити презентацію
Дослідженння реагетнтної утилізації високотоксичних сірковмісних речовин
Завантажити презентаціюПрезентація по слайдам:
ДОСЛІДЖЕННЯ РЕАГЕНТНОЇ УТИЛІЗАЦІЇ ВИСОКОТОКСИЧНИХ СІРКОВМІСНИХ РЕЧОВИН ВІННИЦЬКИЙ НАЦІОНАЛЬНИЙ ТЕХНІЧНИЙ УНІВЕРСИТЕТ Інститут ЕКОЛОГІЇ ТА ЕКОЛОГІЧНОЇ КІБЕРНЕТИКИ Кафедра ХІМІЇ ТА ХІМІЧНОЇ ТЕХНОЛОГІЇ Підготував: асп. Тітов Т. С. Науковий керівник: д. х. н., проф. Ранський А. П. ДОПОВІДЬ НА ТЕМУ:
Об’єкти, що підлягають утилізації: 1. Високотоксичні відпрацьовані лужні розчини від очищення сирої нафти, що містять меркаптани R-SH, сульфіди Na2S, гідросульфіди NaHS, полісульфіди Na2Sх; 2. Непридатні до цільового використання пестицидні препарати: Тіурам, Фентіурам; 3. Головна фракція сирого бензолу коксохімічних виробництв, що містить високотоксичний сірковуглець CS2.
Концепція реагентної утилізації сірковмісних речовин включає: 1. Дослідження кислотно-основної взаємодії; 2. Дослідження окисно-відновної взаємодії; 3. Дослідження реакції комплексоутворення в органічних та водно-органічних розчинниках.
Раніше нами досліджена реагентна переробка високотоксичних відпрацьованих сульфідно-лужних розчинів очищення сирої нафти [Пат. 34806 А, Україна, МПК6 В09В 3/00, Бюл. № 2, 2001 р.]: (1) (2) (3) з отриманням полісульфідів міді яу перспективних присадних матеріалів до високотемпературних консистентних мастил для високонавантажених вузлів тертя.
Так, в роботі [Пат. 20133 А, Україна, МПК6 В09В 3/00, Бюл. № 6, 1997 р.] була відпрацьована схема реагентної переробки пестицидних препаратів Тіурам та Фентіурам: (4) (5) При цьому натрієві солі N,N-діалкілдитіокарбамінової кислоти були модифіковані до відповідних метал-хелатів за схемою:
Практичне використання продуктів, виділених при сумісній утилізації високотоксичних сірковмісних сполук: 1. Інгібітори кислотної корозії чорних та кольорових металів; 2. Присадні матеріали до індустріальних олив И-20, И-20А, И-40, И-40А; 3. Перспективні присадні матеріали до високотемпературних консистентних мастил для високонавантажених вузлів тертя. 4. Термостабілізуючі добавки до пластичних композицій на основі поліетилену високого (ПЕВТ) та низького (ПЕНТ) тиску.
Об'єкт дослідження третього блоку сірковмісних речовин: Головна фракція сирого бензолу ВАТ «Ясинівський коксохімічний завод» (м. Макіївка, Донецька обл.) Мета дослідження: Розробити нові методи переробки сірковуглецю головної фракції сирого бен-золу, зокрема шляхом його хімічного модифікування реагентами з отриманням цінних хімічних продуктів, які б знайшли подальше використання в промисловос-ті та були б безпечними при використанні, зберіганні та транспортуванні.
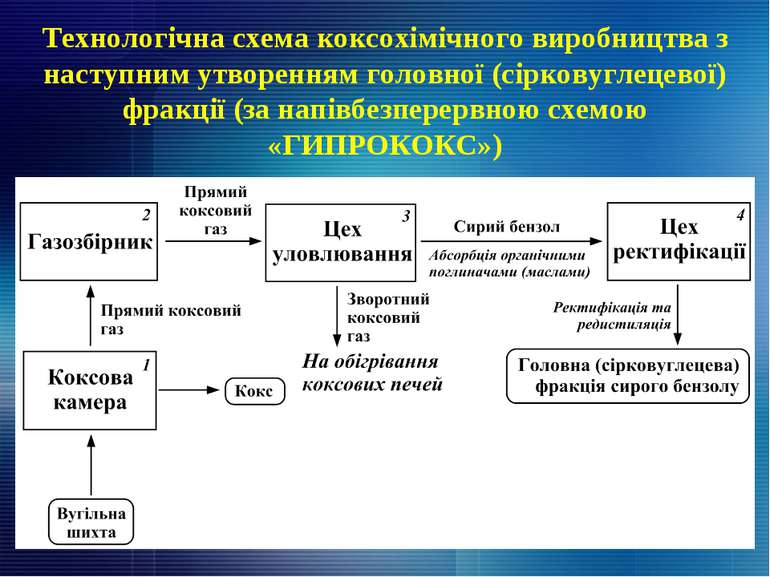
Технологічна схема коксохімічного виробництва з наступним утворенням головної (сірковуглецевої) фракції (за напівбезперервною схемою «ГИПРОКОКС»)
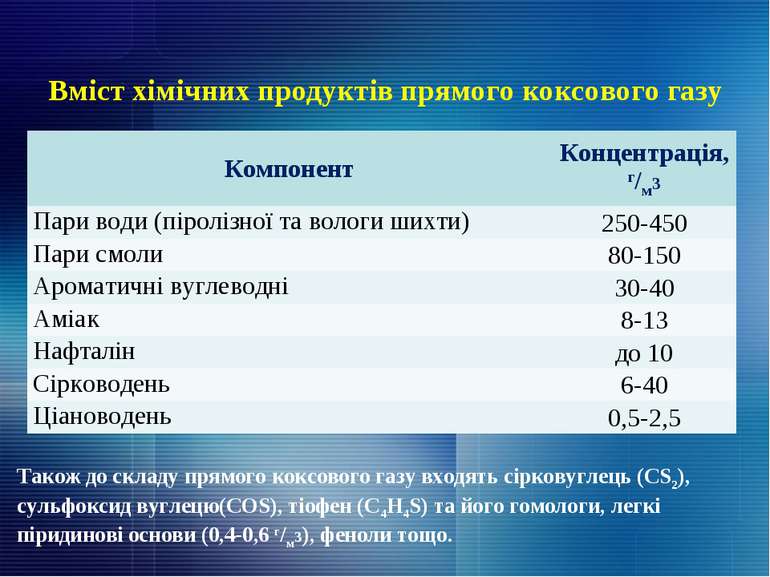
Вміст хімічних продуктів прямого коксового газу Також до складу прямого коксового газу входять сірковуглець (CS2), сульфоксид вуглецю(COS), тіофен (С4H4S) та його гомологи, легкі піридинові основи (0,4-0,6 г/м3), феноли тощо. Компонент Концентрація, г/м3 Пари води (піролізної та вологи шихти) 250-450 Пари смоли 80-150 Ароматичні вуглеводні 30-40 Аміак 8-13 Нафталін до 10 Сірководень 6-40 Ціановодень 0,5-2,5
Групи сполук низькокиплячої (відгін до 180 °С) фракції сирого бензолу Для очищення сирого бензолу та його фракцій від ненасичених та сірковмісних сполук в промисловості знайшли застосування сірчанокислотне очищення, ката-літичне гідроочищення та напівбезперервна технологічна схема «ГИПРОКОКС» роздільної переробки двох бензолів – першого та другого. Група Основні сполуки, що входять до складу групи Вміст, % Ароматичні вуглеводні бензол, толуол, диметилбен-золи (ксилоли), етилбензол, триметилбензоли, етилтолуоли 80-95 Ненасичені сполуки циклопентадієн, стирол, кумарон, інден з гомологами, циклогексан, метилциклогексен 5-15 Сірковмісні сполуки сірководень, сірковуглець, тіофен, метилтіофен, ди-метилтіофени, триметилтіофени 0,2-2,0 (в перерахунку на сірку) Насичені вуглеводні жирного та гідроароматичного ряду циклопентан, метилциклопентани, циклогексан, метилциклогексани, гептан, гексан 0,3-2,0 Решта фенол, азотисті сполуки, нафталін менше ніж 1,0
Фізичні характеристики та склад сірковуглецевої фракції Ясинівського коксохімічного заводу Кількість (вихід) сірковуглецевої (головної) фракції є порівняно малою (2-3 % від першого бензо-лу) і, як і склад, залежить від умов ректифікації та складу вихідного сирого бензолу. В наш час переробку сірковуглецевої фракції проводять методом термічної полімеризації, що базується на властивості циклопентадієну утворювати під час нагрівання дициклопентадієн із різко відмінною від решти компонентів фракції температурою кипіння. Дициклопентадієн, що утворюється, відділяється шляхом наступної ректифікації. Назва показника (компоненту) Значення Густина при 20 °С, г/см3 0,87-0,93 Розгонка, °С: початок кипіння……………….…..........................................................…… температура при відгонці: 90 %................................................................................................................. 95 %................................................................................................................. 30-38 60-65 66-75 Склад, % бензол………….………………………………...……………………..….... сірковуглець……………..………………..................................................… тіофен…………………………….……….................................................… циклопентадієн………………………………...…………...…………….… дициклопентадієн………………………………….…………………….… сірководень, насичені вуглеводні, амілени та інші ненасичені сполуки…………………….………………... 24,0-40,6 22,7-32,8 6,0-6,9 5,5-13,0 1,6-15,9 10,1-30,4
Основні фізико-хімічні характеристики чистого сірковуглецю Незалежно від способу отримання сірковуглецю його виробництва відносяться до особливо небезпеч-них, що обумовлено високою токсичністю сірковуглецю (ГДК парів сірковуглецю у виробничих примі-щеннях у різних країнах складає від 10 до 60 мг/м3, смертельна доза сірковуглецю складає 10 г/м3), а також високою пожежонебезпечністю сірковуглецю, що має дуже низьку температуру спалаху та само-займання, здатністю сірковуглецю електризуватись, утворювати вибухонебезпечні суміші з киснем повітря в широких межах концентрацій. Оскільки сірковуглець є надзвичайно отруйним та легко самозаймається, його виділення із головної фракції в чистому вигляді пов’язане з пожежо- та вибухонебезпечністю. Показник та одиниця виміру Значення Характеристика молекули CS2: cтруктурна формула……………………………………………….…..... молярна маса, г/моль……………………………........................................ S=C=S 76 Точки фазового переходу: температура плавлення, °С …………….................................................. температура затвердівання, °С……….…................................................ температура кипіння, °С……….…………………………………….…. -111,6 -116,8 46 Термодинамічні та оптичні властивості (при 20 °С): масова теплоємність ср рідкого сірковуглецю, Дж/(кг·К) теплота випаровування при 0 °С, Дж/г…………………………………..... теплота плавлення, Дж/г…………………………………………………… теплота згорання (рідкого), кДж/моль…………………................................. показник заломлення для D-лінії натрію (λ = 589,3 нм)…………..……. 1000 374,7 57,78 1075 1,6276
Найбільш поширені методи утилізації сірковуглецю Для знешкодження сірковуглецю, що міститься в головній фракції, практикується його спалювання в складі пічного палива на КХЗ України: При недостатній кількості кисню можливе утворення CS, COS та парів сірки, а також перебіг побічних реакцій: Більш прийнятними методами знешкодження сірковуглецю є наступні: 1. Окислення перманганатом калію при нагріванні з утворенням сульфатів двох металів та елементної сірки: 2. Гідроліз сірковуглецю водяною парою при температурі 400-450 °С. Проте в цьому разі утворюється високо-токсичний сірководень: (5) (6) (7) (8) (9)
Аміак як реагент для виділення сірковуглецю з головної фракції сирого бензолу Як реагент для виділення сірковуглецю із головної фракції був випробуваний водний розчин аміаку . Аміак є відносно недорогим та доступним реагентом, що може вибірково взаємодіяти з сірковуглецем головної фракції. Отримані при взаємодії сірковуглецю з аміаком сполуки можуть бути використані для виробництва важливих та цінних хімічних продуктів. В залежності від температури, хімізм процесу взаємодії сірковуглецю з аміаком може бути проілюстрований наступними реакціями: Одним із проміжних продуктів даної реакції є дитіокарбамат амонію. Роданід амонію ізомеризується в тіосечовину за такою схемою: У відповідності до наведених реакцій при взаємодії сірковуглецю з аміаком можна отримати роданід амонію, тіосечовину, солі дитіокарбамінової кислоти. Кислотний розклад дитіокарбамату амонію, що реалізується при звичайних умовах, дозволяє регенерувати сірковуглець: Таким чином, стає можливою реалізація технології виробництва чистого сірковуглецю з головної фракції у вигляді готового продукту. Однак з точки зору екобезпеки пропонована технологія має один недолік, а саме – утворення небажаного побічного продукту – токсичного сірководню. (10) (11) (12) (13)
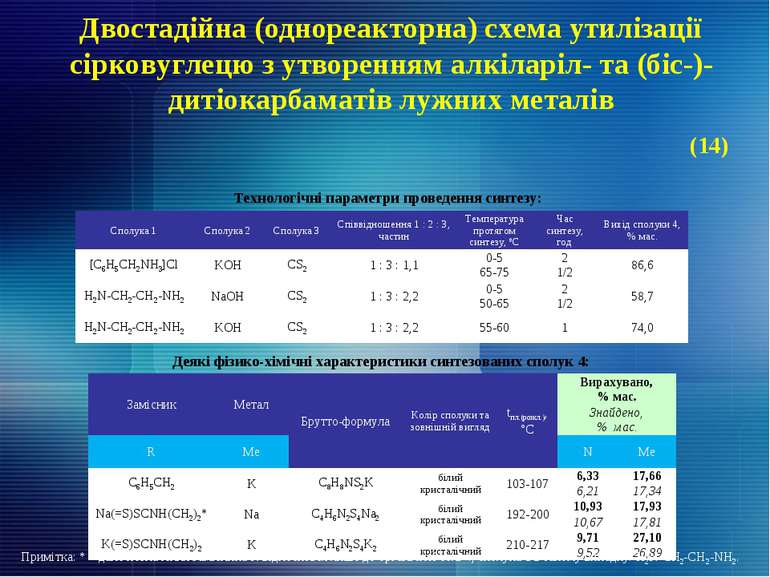
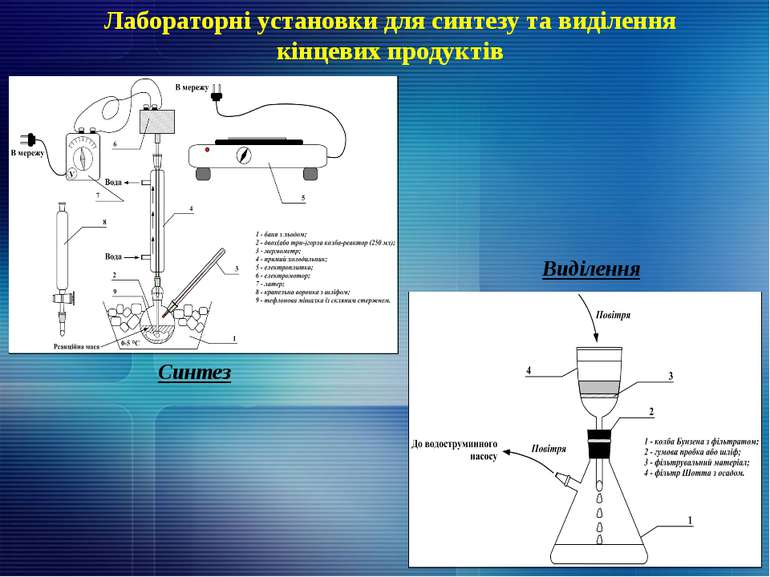
Двостадійна (однореакторна) схема утилізації сірковуглецю з утворенням алкіларіл- та (біс-)-дитіокарбаматів лужних металів Технологічні параметри проведення синтезу: Примітка: * – дане позначення замісника R відноситься лише до органічної солі 4, сполука 1 в такому випадку: H2N-CH2-CH2-NH2. Деякі фізико-хімічні характеристики синтезованих сполук 4: (14) Замісник Метал Брутто-формула Колір сполуки та зовнішній вигляд tпл.(розкл.), °С Вирахувано, % мас. Знайдено, % мас. R Ме N Ме С6Н5СН2 К C8H8NS2К білий кристалічний 103-107 6,33 17,66 6,21 17,34 Na(=S)SCNH(CH2)2* Na C4H6N2S4Na2 білий кристалічний 192-200 10,93 17,93 10,67 17,81 K(=S)SCNH(CH2)2 К C4H6N2S4K2 білий кристалічний 210-217 9,71 27,10 9,52 26,89 Сполука 1 Сполука 2 Сполука 3 Співвідношення 1 : 2 : 3, частин Температура протягом синтезу, ºС Час синтезу, год Вихід сполуки 4, % мас. [С6Н5СН2NH3]Cl KOH CS2 1 : 3 : 1,1 0-5 65-75 2 1/2 86,6 H2N-CH2-CH2-NH2 NaOH CS2 1 : 3 : 2,2 0-5 50-65 2 1/2 58,7 H2N-CH2-CH2-NH2 KOH CS2 1 : 3 : 2,2 55-60 1 74,0
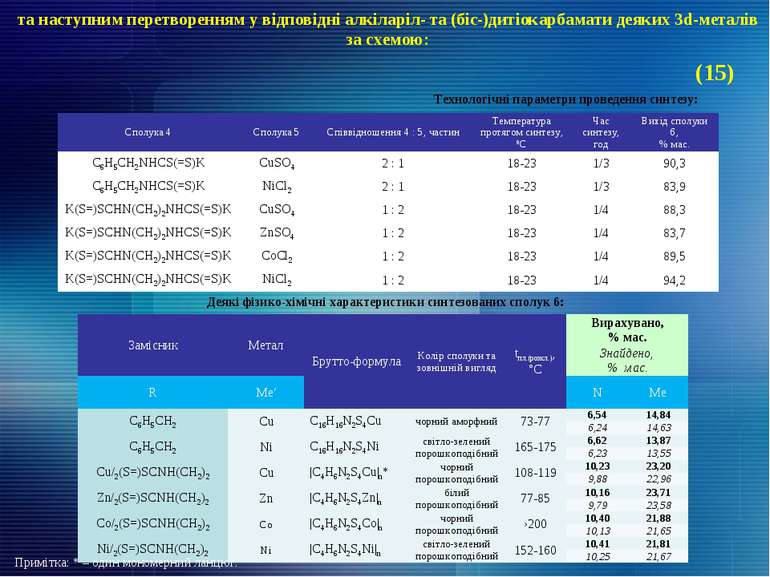
та наступним перетворенням у відповідні алкіларіл- та (біс-)дитіокарбамати деяких 3d-металів за схемою: Технологічні параметри проведення синтезу: Деякі фізико-хімічні характеристики синтезованих сполук 6: Примітка: * – один мономерний ланцюг. (15) Сполука 4 Сполука 5 Співвідношення 4 : 5, частин Температура протягом синтезу, ºС Час синтезу, год Вихід сполуки 6, % мас. С6Н5СН2NHCS(=S)K CuSO4 2 : 1 18-23 1/3 90,3 С6Н5СН2NHCS(=S)K NiCl2 2 : 1 18-23 1/3 83,9 K(S=)SCHN(CH2)2NHCS(=S)K CuSO4 1 : 2 18-23 1/4 88,3 K(S=)SCHN(CH2)2NHCS(=S)K ZnSO4 1 : 2 18-23 1/4 83,7 K(S=)SCHN(CH2)2NHCS(=S)K CoCl2 1 : 2 18-23 1/4 89,5 K(S=)SCHN(CH2)2NHCS(=S)K NiCl2 1 : 2 18-23 1/4 94,2 Замісник Метал Брутто-формула Колір сполуки та зовнішній вигляд tпл.(розкл.), °С Вирахувано, % мас. Знайдено, % мас. R Ме′ N Ме С6Н5СН2 Cu C16H16N2S4Cu чорний аморфний 73-77 6,54 14,84 6,24 14,63 С6Н5СН2 Ni C16H16N2S4Ni світло-зелений порошкоподібний 165-175 6,62 13,87 6,23 13,55 Cu/2(S=)SCNH(CH2)2 Cu |C4H6N2S4Cu|n* чорний порошкоподібний 108-119 10,23 23,20 9,88 22,96 Zn/2(S=)SCNH(CH2)2 Zn |C4H6N2S4Zn|n білий порошкоподібний 77-85 10,16 23,71 9,79 23,58 Co/2(S=)SCNH(CH2)2 Co |C4H6N2S4Co|n чорний порошкоподібний ›200 10,40 21,88 10,13 21,65 Ni/2(S=)SCNH(CH2)2 Ni |C4H6N2S4Ni|n світло-зелений порошкоподібний 152-160 10,41 21,81 10,25 21,67
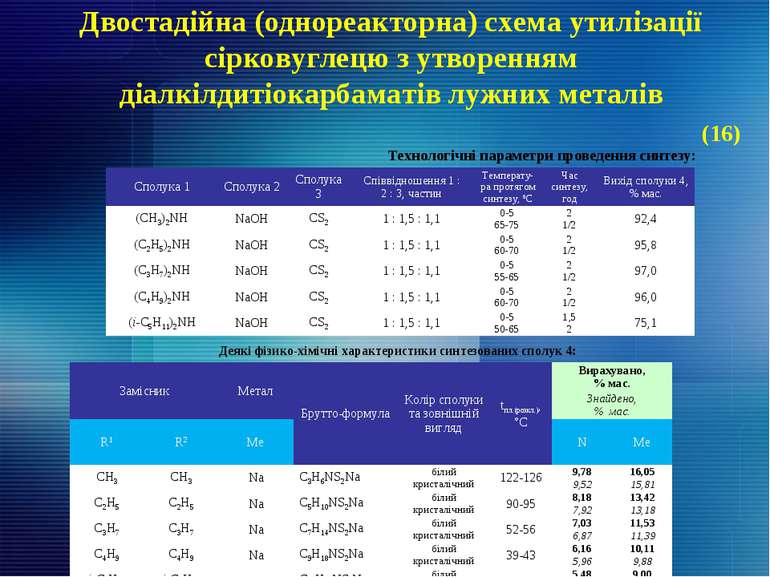
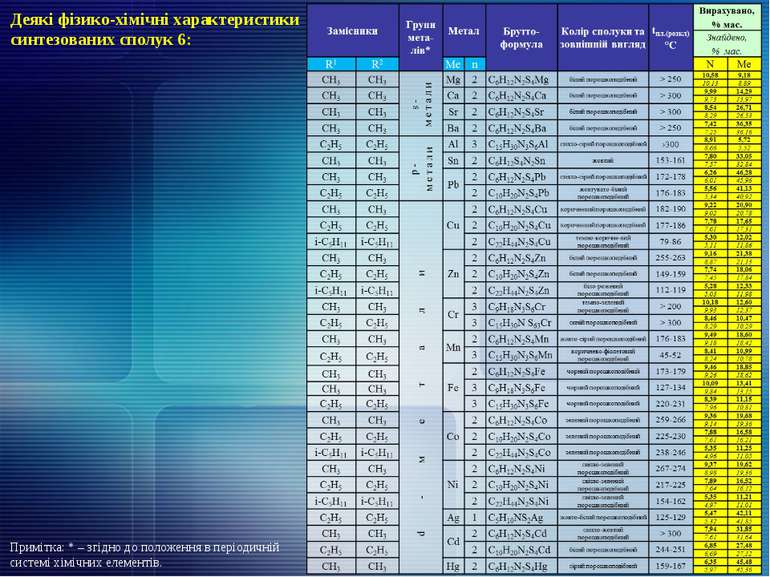
Двостадійна (однореакторна) схема утилізації сірковуглецю з утворенням діалкілдитіокарбаматів лужних металів Технологічні параметри проведення синтезу: Деякі фізико-хімічні характеристики синтезованих сполук 4: (16) Сполука 1 Сполука 2 Сполука 3 Співвідношення 1 : 2 : 3, частин Температу-ра протягом синтезу, ºС Час синтезу, год Вихід сполуки 4, % мас. (CH3)2NH NaOH CS2 1 : 1,5 : 1,1 0-5 65-75 2 1/2 92,4 (C2H5)2NH NaOH CS2 1 : 1,5 : 1,1 0-5 60-70 2 1/2 95,8 (C3H7)2NH NaOH CS2 1 : 1,5 : 1,1 0-5 55-65 2 1/2 97,0 (C4H9)2NH NaOH CS2 1 : 1,5 : 1,1 0-5 60-70 2 1/2 96,0 (і-C5H11)2NH NaOH CS2 1 : 1,5 : 1,1 0-5 50-65 1,5 2 75,1 Замісник Метал Брутто-формула Колір сполуки та зовнішній вигляд tпл.(розкл.), °С Вирахувано, % мас. Знайдено, % мас. R1 R2 Ме N Ме CH3 CH3 Na C3H6NS2Na білий кристалічний 122-126 9,78 16,05 9,52 15,81 C2H5 C2H5 Na C5H10NS2Na білий кристалічний 90-95 8,18 13,42 7,92 13,18 C3H7 C3H7 Na C7H14NS2Na білий кристалічний 52-56 7,03 11,53 6,87 11,39 C4H9 C4H9 Na C9H18NS2Na білий кристалічний 39-43 6,16 10,11 5,96 9,88 i-C5H11 i-C5H11 Na C11H22NS2Na білий кристалічний 76-80 5,48 9,00 5,27 8,75
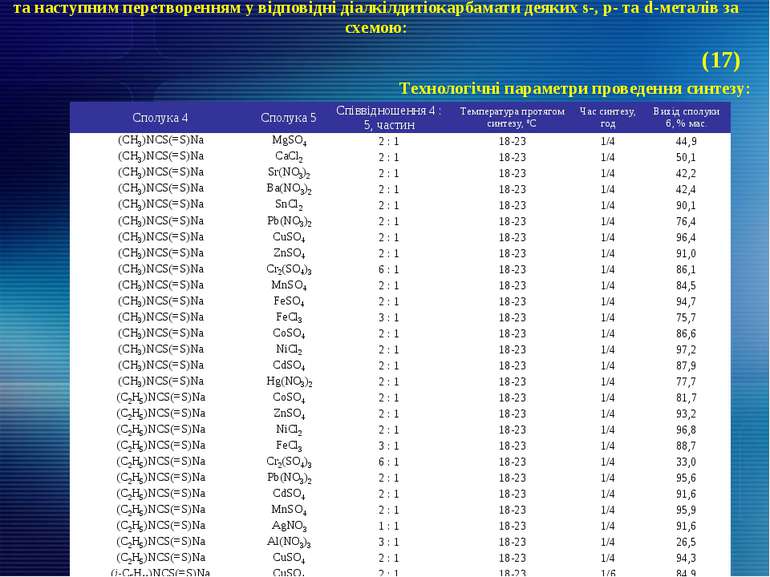
та наступним перетворенням у відповідні діалкілдитіокарбамати деяких s-, p- та d-металів за схемою: Технологічні параметри проведення синтезу: (17) Сполука 4 Сполука 5 Співвідношення 4 : 5, частин Температура протягом синтезу, ºС Час синтезу, год Вихід сполуки 6, % мас. (СН3)NCS(=S)Na MgSO4 2 : 1 18-23 1/4 44,9 (СН3)NCS(=S)Na CaCl2 2 : 1 18-23 1/4 50,1 (СН3)NCS(=S)Na Sr(NO3)2 2 : 1 18-23 1/4 42,2 (СН3)NCS(=S)Na Ba(NO3)2 2 : 1 18-23 1/4 42,4 (СН3)NCS(=S)Na SnCl2 2 : 1 18-23 1/4 90,1 (СН3)NCS(=S)Na Pb(NO3)2 2 : 1 18-23 1/4 76,4 (СН3)NCS(=S)Na CuSO4 2 : 1 18-23 1/4 96,4 (СН3)NCS(=S)Na ZnSO4 2 : 1 18-23 1/4 91,0 (СН3)NCS(=S)Na Cr2(SO4)3 6 : 1 18-23 1/4 86,1 (СН3)NCS(=S)Na MnSO4 2 : 1 18-23 1/4 84,5 (СН3)NCS(=S)Na FeSO4 2 : 1 18-23 1/4 94,7 (СН3)NCS(=S)Na FeCl3 3 : 1 18-23 1/4 75,7 (СН3)NCS(=S)Na CoSO4 2 : 1 18-23 1/4 86,6 (СН3)NCS(=S)Na NiCl2 2 : 1 18-23 1/4 97,2 (СН3)NCS(=S)Na CdSO4 2 : 1 18-23 1/4 87,9 (СН3)NCS(=S)Na Hg(NO3)2 2 : 1 18-23 1/4 77,7 (С2Н5)NCS(=S)Na CoSO4 2 : 1 18-23 1/4 81,7 (С2Н5)NCS(=S)Na ZnSO4 2 : 1 18-23 1/4 93,2 (С2Н5)NCS(=S)Na NiCl2 2 : 1 18-23 1/4 96,8 (С2Н5)NCS(=S)Na FeCl3 3 : 1 18-23 1/4 88,7 (С2Н5)NCS(=S)Na Cr2(SO4)3 6 : 1 18-23 1/4 33,0 (С2Н5)NCS(=S)Na Pb(NO3)2 2 : 1 18-23 1/4 95,6 (С2Н5)NCS(=S)Na CdSO4 2 : 1 18-23 1/4 91,6 (С2Н5)NCS(=S)Na MnSO4 2 : 1 18-23 1/4 95,9 (С2Н5)NCS(=S)Na AgNO3 1 : 1 18-23 1/4 91,6 (С2Н5)NCS(=S)Na Al(NO3)3 3 : 1 18-23 1/4 26,5 (С2Н5)NCS(=S)Na CuSO4 2 : 1 18-23 1/4 94,3 (i-С5Н11)NCS(=S)Na CuSO4 2 : 1 18-23 1/6 84,9 (i-С5Н11)NCS(=S)Na ZnSO4 2 : 1 18-23 1/6 95,2 (i-С5Н11)NCS(=S)Na CoSO4 2 : 1 18-23 1/6 91,8 (i-С5Н11)NCS(=S)Na NiCl2 2 : 1 18-23 1/6 75,7
Деякі фізико-хімічні характеристики синтезованих сполук 6: Примітка: * – згідно до положення в періодичній системі хімічних елементів.
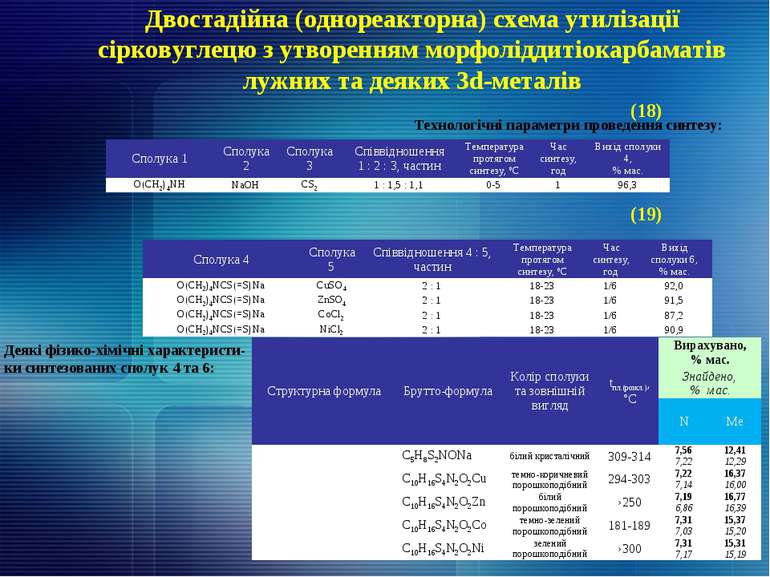
Двостадійна (однореакторна) схема утилізації сірковуглецю з утворенням морфоліддитіокарбаматів лужних та деяких 3d-металів Технологічні параметри проведення синтезу: Деякі фізико-хімічні характеристи- ки синтезованих сполук 4 та 6: (18) (19) Сполука 1 Сполука 2 Сполука 3 Співвідношення 1 : 2 : 3, частин Температура протягом синтезу, ºС Час синтезу, год Вихід сполуки 4, % мас. O(CH2)4NH NaOH CS2 1 : 1,5 : 1,1 0-5 1 96,3 Сполука 4 Сполука 5 Співвідношення 4 : 5, частин Температура протягом синтезу, ºС Час синтезу, год Вихід сполуки 6, % мас. O(CH2)4NCS(=S)Na CuSO4 2 : 1 18-23 1/6 92,0 O(CH2)4NCS(=S)Na ZnSO4 2 : 1 18-23 1/6 91,5 O(CH2)4NCS(=S)Na CoCl2 2 : 1 18-23 1/6 87,2 O(CH2)4NCS(=S)Na NiCl2 2 : 1 18-23 1/6 90,9 Структурна формула Брутто-формула Колір сполуки та зовнішній вигляд tпл.(розкл.), °С Вирахувано, % мас. Знайдено, % мас. N Ме С5Н8S2NONa білий кристалічний 309-314 7,56 12,41 7,22 12,29 C10H16S4N2O2Cu темно-коричневий порошкоподібний 294-303 7,22 16,37 7,14 16,00 C10H16S4N2O2Zn білий порошкоподібний ›250 7,19 16,77 6,86 16,39 C10H16S4N2O2Co темно-зелений порошкоподібний 181-189 7,31 15,37 7,03 15,20 C10H16S4N2O2Ni зелений порошкоподібний ›300 7,31 15,31 7,17 15,19
Сумісна утилізація сірковуглецю та некондиційних пестицидних препаратів: Аміноскладову у вигляді солянокислих солей виділяли як складову частину при реагентній переробці пестицидних препаратів [Пат. 48145, Украина, МПК9 В09В 3/00, Бюл. № 5, 2010 г.; Пат. 48146, Украина, МПК9 В09В 3/00, Бюл. № 5, 2010 г.] Де Аміни отримували шляхом нейтралізації органічних амонієвих солей: (20) (21) (22)
Практичне використання продуктів, виділених при сумісній утилізації сірковуглецю коксохімічних підприємств та некондиційних пестицидних препаратів: 1. Поліфункціональні добавки до індустріальних та моторних олив; 2. Індивідуальні прискорювачі сірчаної вулканізації поліізопрену та 1,3-бутадієну; 3. Селективні флотаційні реагенти в гірничодобувній промисловості. 4. Ефективні протектори радіаційного захисту; 5. Реактиви для хімічної синтетичної практики.
Двостадійна (однореакторна) схема утилізації сірковуглецю з утворенням ксантогенатів та тритіокарбонатів лужних та деяких 3d-металів (23) (24)
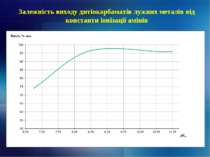
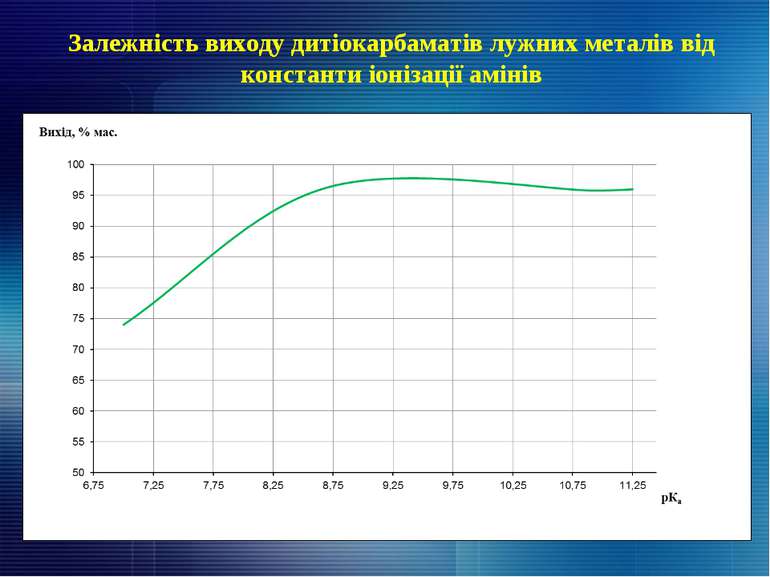
1. Наведено об’єкти та проаналізовано напрямки досліджень реагентної утилізації високотоксичних сірковмісних речовин. 2. Наведено схеми реагентної переробки високотоксичних відпрацьованих сульфідно-лужних розчинів очищення сирої нафти та пестицидних препаратів Тіурам та Фентіурам з подальшим практичним застосуванням отриманих сполук. 3. Показано технологічні особливості утворення, виділення та очищення головної фракції сирого бензолу від сірковуглецю на сучасних коксохімічних виробництвах, розглянуто як існуючі методи утилізації сірковуглецю (в т.ч. реагентні), так і перспективні – шляхом хімічного модифікування з аліфатичними, гетероциклічними амінами, нижчими спиртами та меркаптанами. 4. Досліджено вплив технологічних параметрів при утилізації сірковуглецю (в т. ч. константи іонізації амінів) на вихід дитіокарбаматів лужних металів. 5. Показана можливість сумісної утилізації сірковуглецю коксохімічних підприємств та некондиційних пестицидних препаратів, а також використання кінцевих сполук на практиці.
Схожі презентації
Категорії





![Так, в роботі [Пат. 20133 А, Україна, МПК6 В09В 3/00, Бюл. № 6, 1997 р.] була... Так, в роботі [Пат. 20133 А, Україна, МПК6 В09В 3/00, Бюл. № 6, 1997 р.] була...](https://svitppt.com.ua/images/41/40000/770/img4.jpg)
















![Так, в роботі [Пат. 20133 А, Україна, МПК6 В09В 3/00, Бюл. № 6, 1997 р.] була... Так, в роботі [Пат. 20133 А, Україна, МПК6 В09В 3/00, Бюл. № 6, 1997 р.] була...](https://svitppt.com.ua/images/41/40000/210/img4.jpg)