Презентація на тему:
Значення буферних систем крові...
Завантажити презентацію
Значення буферних систем крові...
Завантажити презентаціюПрезентація по слайдам:
Поняття про кислотно-лужну рівновагу (КЛР) КЛР - це відносна постійність реакції внутрішнього середовища організму, що кількісно характеризується або концентрацією протонів (моль/л), або водневим показником - від ємним десятинним логаріфмом цієї концентрації (рН) В нормі рН крові - 7,37 - 7,44. Фізіологічне коливання рН - в межах 0,05 - 0,07. Зміна рН веде до зміни дії ферментів, що може спричинити тяжкі ускладнення і смерть Перша “лінія захисту” сталості рН в організмі - це буферні системи крові і тканин. Друга “лінія захисту” - діяльність легень і нирок.
Поняття про буферну систему. Буферні системи крові Буферна система - це спряжена кислотно-основна пара, що складається із донора і акцептора іонів водню. Найважливіші буферні системи - - бікарбонатна; - фосфатна; - білкова; - гемоглобінова.
Гемоглобінова буферна система. Її суть Складає 75% всієї буферної системи крові. Суть: при насиченні гемоглобіну киснем він стає більш сильною кислотою (ННbО2). При віддачі кисню він стає дуже слабкою органічною кислотою (ННb). Гемоглобінова буферна система складається із двох частин: - буферна система оксигемоглобіну (кисла форма ННbО2 і основна форма НbО2-) - буферна система дезоксигемоглобіну (кисла форма ННb, основна форма - Нb-)
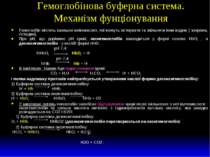
Гемоглобінова буферна система. Механізм фунціонування Гемоглобін містить залишки амінокислот, які можуть зв’язувати та звільняти іони водню ( зокрема, гістидин). При рН, що дорівнює рН крові, оксигемоглобін знаходиться у формі основи НbО2- , а дезоксигемоглобін - у кислій формі ННb: рН 7,4 ННbО2 НbО2- + Н+ рН 7,4 ННb Нb- + Н+ В капілярах тканин йде підкислювання крові: СО2 + Н2О Н2СО3 Н+ + НСО3- і поява надлишку протонів нейтралізується утворенням кислої форми дезоксигемоглобіну: 1) Буферна система дезоксигемоглобіну: Н+ + Нb- ННb, 2) Буферна система оксигемоглобіну: Н+ + НbО2- ННbО2 ННb + О2 У капілярах легень гемоглобін запобігає підлужуванню крові після звільнення з неї вуглекислоти - оксигемоглобін як сильна кислота витісняє з гідрокарбонатів вугільну кислоту, яка швидко розпадається на СО2 і Н2О: 1) Буферна система дезоксигемоглобіну: О2 + ННb ННbО2 (дезоксигемоглобін перетворюється на оксигемоглобін) 2) Буферна система оксигемоглобіну: НСО3- + ННbО2 НbО2- + Н2СО3 Н2О + СО2 .
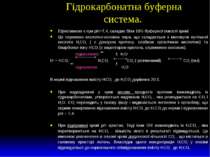
Гідрокарбонатна буферна система. Ефективною є при рН=7,4, складає біля 10% буферної ємкості крові. Це спряжена кислотно-основна пара, що складається з молекули вугільної кислоти Н2СО3 ( є донором протону, слабкою органічною кислотою) та бікарбонат-іону НСО3- (є акцептором протона, спряженою основою). підкислення Н2О Н+ + НСО3- Н2СО3 СО2 ( розчинений) СО2 (газ) підлуження Н2О В нормі відношення вмісту НСО3- до Н2СО3 дорівнює 20:1. При надходженні у кров кислих продуктів протони взаємодіють із гідрокарбонатами, утворюється надлишок Н2СО3 , яка розпадається на СО2 і Н2О. СО2 переходить у газову фазу і видихається легенями з організму, що сприяє поверненню відношення вмісту НСО3- до Н2СО3 до норми і відновленню рН = 7,4. При підлуженні крові рН зростає. Тоді іони ОН- взаємодіють із Н2СО3 , яка перетворюється на НСО3- , кількість якого в результаті підвищується. Це викликає розчинення в плазмі крові додаткової кількості СО2 , що міститься в газовому просторі легень. Внаслідок цього концентрація Н2СО3 у плазмі підвищується до нормального співвідношення вмісту НСО3- до Н2СО3.
Фосфатна буферна система Складає біля 1% буферної ємкості крові. В тканинах є однією з основних. Служить буфером у межах рН 6,1 - 7,7, тому її значення для крові незначне, крім того, у крові достатньо малий вміст фосфатів. Важливою є в підтримці рН внутришньоклітинної рідини, що знаходиться у межах 6,90-7,4. Це спряжена кислотно-основна пара, що складається із іону Н2РО4- ( донор протонів) і іону НРО42- (акцептор протонів). В нормі відношення вмісту НРО42- до Н2РО4- дорівнює 4:1. При надлишку протонів ( підкислення): Н+ + НРО42- Н2РО4- При надлишку ОН- (підлуження): ОН- + Н2РО4- НРО42- + Н2О .
Білкова буферна система Має менше значення для підтримки рН крові, ніж інші системи. Працює завдяки наявності кислотно-основних груп залишків амінокислот у молекулах білків: - негативно заряджений білок - акцептор протонів, спряжена основа; - позитивно заряджений білок - донор протонів, кислота. Ефективна при рН = 7,2-7,4.
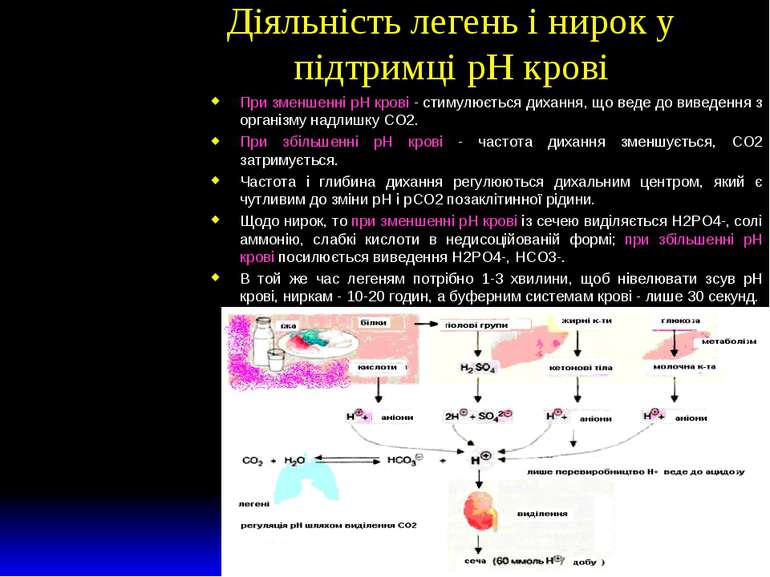
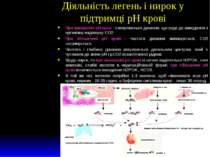
Діяльність легень і нирок у підтримці рН крові При зменшенні рН крові - стимулюється дихання, що веде до виведення з організму надлишку СО2. При збільшенні рН крові - частота дихання зменшується, СО2 затримується. Частота і глибина дихання регулюються дихальним центром, який є чутливим до зміни рН і рСО2 позаклітинної рідини. Щодо нирок, то при зменшенні рН крові із сечею виділяється Н2РО4-, солі аммонію, слабкі кислоти в недисоційованій формі; при збільшенні рН крові посилюється виведення Н2РО4-, НСО3-. В той же час легеням потрібно 1-3 хвилини, щоб нівелювати зсув рН крові, ниркам - 10-20 годин, а буферним системам крові - лише 30 секунд.
Порушення кислотно-лужної рівноваги. Алкалоз. Алкалоз - зменшення в крові та інших біологічних рідинах концентрації іонів Н+ нижче фізіологічних меж (збільшення рН, залуженість). А) Респіраторний алкалоз - спостерігається при надмірному виведенні вуглекислого газу. Характеризується гіпокапнією ( зменшення вмісту СО2 в організмі). Спостерігається при: надлишковій вентиляції легень; вдиханні чистого кисню; штучній вентиляції під час тривалих операцій; піднятті на висоту; у хворих на одишку, на гарячку; при ураженні головного мозку (запалення, травма, пухлина). Б) Метаболічний алкалоз - є наслідком втрати кислот, іонів калію, надлишкового введення з лікувальною метою поташу, лактату натрію, лужних мінеральних вод, при лікуванні печії. Спостерігається при: непрохідності кишечника, внаслідок втрати кислот при блювоті, тяжких крововтратах, опіках, хронічних нефритах, призначенні великих доз діуретиків та ін.
Порушення кислотно-лужної рівноваги. Ацидоз. Це підвищення у крові та інших біологічних рідинах концентрації Н+ вище фізіологічних меж ( зменшення рН, підкисленність). А) Респіраторний ацидоз - є наслідком гіповентиляції легень, недостатності кровообігу, асфіксії. Характеризується гіперкапнією (затримка СО2 організмом). Супроводжує асфіксію, пневмонію, набряк легень, отруєння препаратами, які пригнічують дихальний центр (барбітурати, морфін, ін.), часом виникає після операцій на грудній та брюшній порожнинах. Б) Метаболічний ацидоз - найчастіша і найтяжча форма порушень кислотно-лужної рівноваги. Розвивається при утворенні в організмі надлишку нелетких органічних кислот, при втраті гідрокарбонатів, затримці фосфатів і сульфатів. Часто зумовлений первинними порушеннями обміну речовин (наприклад, гіпоксіями, за яких в організмі накопичується молочна кислота - продукт анаеробного розщеплення глюкози), тривалим голодуванням (внаслідок посиленої мобілізації жиру із депо і нагромадження в печінці продуктів неповного окислення жирних кислот). Супроводжує тяжкі форми порушення кровообігу, крововтрати, серцево-судинну недостачу, перітонити, абсцеси, блокування дихальних ферментів, захворювання ШКТ з ознаками діареї, ураження нирок, отруєння кислотами (оцтовою, борною) та саліцилатами, шок, кому, колапс. Найтяжчі форми метаболічного ацидозу - у дітей через обмеженість лужних резервів.
Порушення кислотно-лужної рівноваги. Компенсований і некомпенсований ацидоз. Ацидоз (метаболічний та респіраторний) може бути компенсованим та некомпенсованим. Про компенсований ацидоз говорять, якщо рН крові не змінюється; компенсація може відбуватися шляхом розбавлення надлишкових кислот позаклітинною рідиною, яка містить бікарбонат натрію; завдяки білкам, які поглинають протони в обмін на натрій і калій; шляхом гіпервентиляції. Якщо ж цих механізмів компенсації недостатньо, то розвивається некомпенсований ацидоз, при якому зрушується рН крові.
Основні показники кислотно-лужної рівноваги Для уточнення характеру порушень кислотно-лужної рівноваги і ступені їх компенсації застосовують комплекс показників кислотно-лужної рівноваги. З метою їх визначення застосовують чутливі електроди для прямого виміру рН і рСО2 крові, а також прилади типа "АСТРУП" , "АЗІВ" та "АКОР", за допомогою яких аизначають: актуальний рН крові - від’ємний десятичний логарифм концентрації протонів у крові в фізіологічних умовах. Норма - 7,36-7,42 . актуальне рСО2 цільної крові - парціальний тиск вуглекислоти (Н2СО3 + СО2) у крові за фізіологічних умов. Норма - 35,8-46,6 (арт. кров) та 46-58 (вен. кров) мм рт. ст. актуальний бікарбонат - концентрація бікарбоната у плазмі крові у фізіологічних умовах. (АВ - асtual bicarbonates); майже не застосовується. стандартні бікарбонати плазми крові - концентрація НСО3- у плазмі повністю насиченій киснем крові, врівноваженій при 38 С альвеолярним повітрям ( із рСО2 = 40 мм рт ст). Норма - 21-25 мекв/л для артеріальної крові. (SB - standart bicarbonates). буферні основи цільної крові чи плазми - сума всіх аніонів цільної крові (головним чином бікарбонатів та аніонів білків), що мають буферні властивості при повному насиченні крові киснем, 38 С та рСО2 = 40 мм рт. ст. Норма - 44,4 мекв/л (ВВ - buffer base). нормальні буферні основи цільної крові - буферні основи цільної крові при фізіологічних значеннях рН і рСО2 альвеолярного повітря. (NВВ - normal buffer base ). Тобто це величина ВВ у фізіологічних умовах. Складає 44,4 мекв/л. Надлишок основ - різниця між буферними основами і нормальними буферними основами (ВВ - NBB). В нормі - від -2,4 до +2,3 мекв/л. (ВЕ - bases excess ).
Клінічне значення показників кислотно-лужної рівноваги рСО2 свідчить про респіраторні порушення кислотно-лужної рівноваги; інші показники відображають метаболічні зрушення. При патології значення рСО2 коливається у межах 10-130 мм рт. ст. При респираторних ацидозах та метаболічних алкалозах воно підвищується до 140-150 мм рт. ст. Зниження його характеризує наявність респираторних алкалозів та метаболічних ацидозів. Стандартні бікарбонати суттєво підвищуються при метаболічному алкалозі і в меншому ступені - при респіраторному ацидозі. Зниження вмісту бікарбонатів спостерігається при метаболічному ацидозі та респіраторному алкалозі. Діагностичне значення цього показника - у встановленні характеру порушення килотно-лужної рівноваги (респіраторний чи метаболічний). Зміна величини концентрації буферних основ вказує на ступінь метаболічних зрушень. При метаболічних розладах їх рівень різко порушується; при респираторних ці зрушення незначні. В той же час коливання цього показника є значними і у здорових людей, що зменшує його діагностичну цінність. При патології значення показника надлишку буферних основ (ВЕ) коливається у межах 30 мекв/л. Позитивне значення вказує на недостачу літких кислот або на надлишок основ, а від’ємне - на надлишок перших і недостачу других. Максимальні зміни характерні для метаболічних порушень. При метаболічному ацидозі цей показник має від’ємний знак (дефіцит буферних основ), а при метаболічному алкалозі з надлишком буферних основ - позитивний знак. При респіраторних зсувах його зміна незначна - підвищення при ацидозі і зменшення при алкалозі.
Схожі презентації
Категорії