Презентація на тему:
"Туберкульоз. Сучасні методи діагностики та лікування"
Завантажити презентацію
"Туберкульоз. Сучасні методи діагностики та лікування"
Завантажити презентаціюПрезентація по слайдам:
Біохімія крові. Гемоглобін, будова та функції. Дихальна функція крові, регуляція кислотно-лужної рівноваги крові. Білки плазми крові.
Функції крові Дихальна функція — гемоглобін, який входить до складу еритроцитів, разом із плазмою крові здійснюють транспорт газів. Поживна (трофічна) функція — плазма крові забезпечує міжорганне перенесення поживних речовин до клітин, де вони використовуються в катаболічних та анаболічних процесах. Видільна (екскреторна) функція — за допомогою плазми крові забезпечується транспортування до органів виділення кінцевих метаболітів обміну речовин та продуктів біотрансформації чужорідних органічних сполук. Захисна функція — різні типи лейкоцитів та плазма крові за допомогою складної системи ферментів та специфічних білків забезпечують широкий спектр захисних реакцій. Регуляторна функція — здійснюється за допомогою гормонів а також у підтриманні кислотно-лужного і водно-сольового балансу, осмотичного тиску міжклітинної рідини та участі в регуляції температури тіла. Терморегуляційна функція - крові приймає участь в регуляції всіх видів обміну речовин і температурного гомеостазу, виступає джерелом всіх рідин, секретів і екскретів організму.
Фізико-хімічні властивості крові В нормі відносна густина цільної крові 1,050-1,064, плазми - 1,024-1,030, клітин 1,080-1,097. Кров має значну в'язкість за рахунок високого вмісту білків і еритроцитів. В'язкість крові у 4-5 разів вища, ніж в'язкість води. Важливим фізико-хімічним показником крові є осмотичний тиск плазми крові. Він визначається концентрацією всіх частинок, які знаходяться в одиниці об'єму. При температурі тіла 37°С осмотичний тиск плазми крові - 7,6 атмосфери або 5 776 мм рт ст Та частина осмотичного тиску, яка залежить від білків плазми крові називається онкотичним. Він становить близько 0,02 атм або 15,2 мм рт ст.
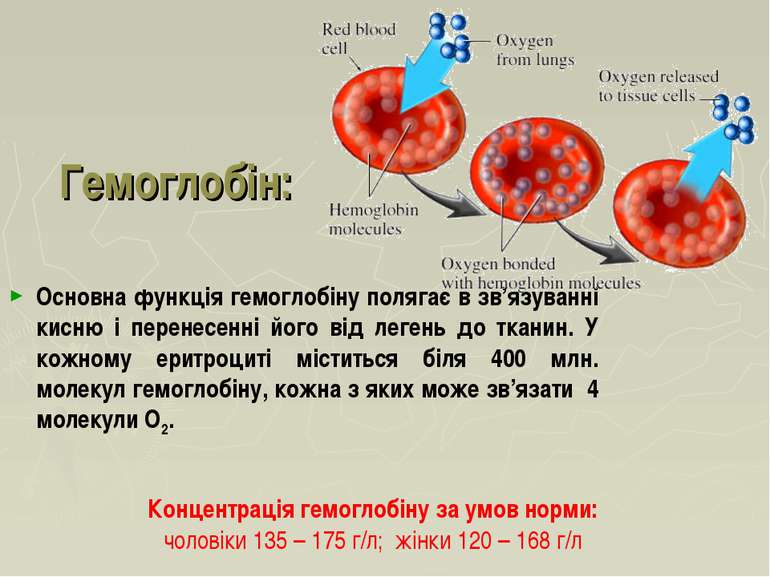
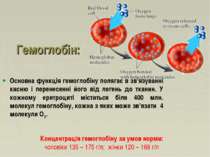
Гемоглобін: Основна функція гемоглобіну полягає в зв’язуванні кисню і перенесенні його від легень до тканин. У кожному еритроциті міститься біля 400 млн. молекул гемоглобіну, кожна з яких може зв’язати 4 молекули О2. Концентрація гемоглобіну за умов норми: чоловіки 135 – 175 г/л; жінки 120 – 168 г/л
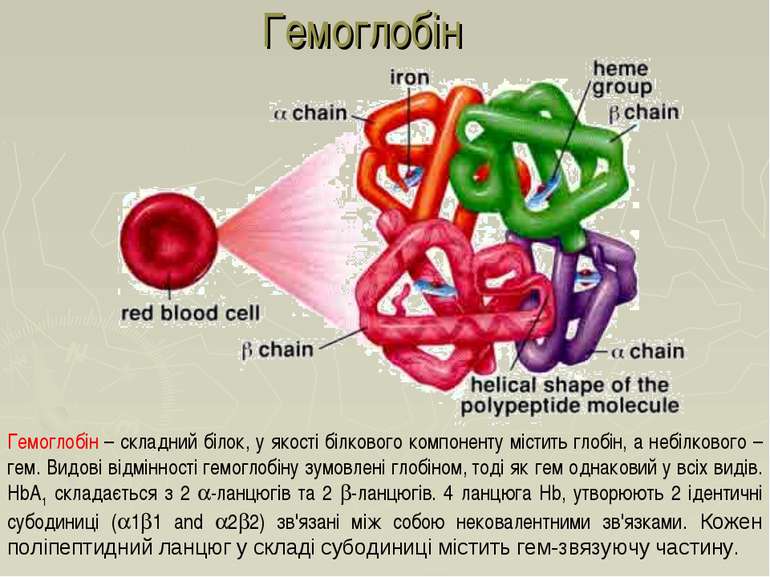
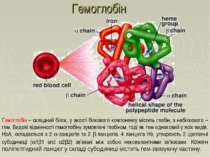
Гемоглобін – складний білок, у якості білкового компоненту містить глобін, а небілкового – гем. Видові відмінності гемоглобіну зумовлені глобіном, тоді як гем однаковий у всіх видів. HbA1 складається з 2 -ланцюгів та 2 -ланцюгів. 4 ланцюга Hb, утворюють 2 ідентичні субодиниці ( 1 1 and 2 2) зв'язані між собою нековалентними зв'язками. Кожен поліпептидний ланцюг у складі субодиниці містить гем-звязуючу частину. Гемоглобін
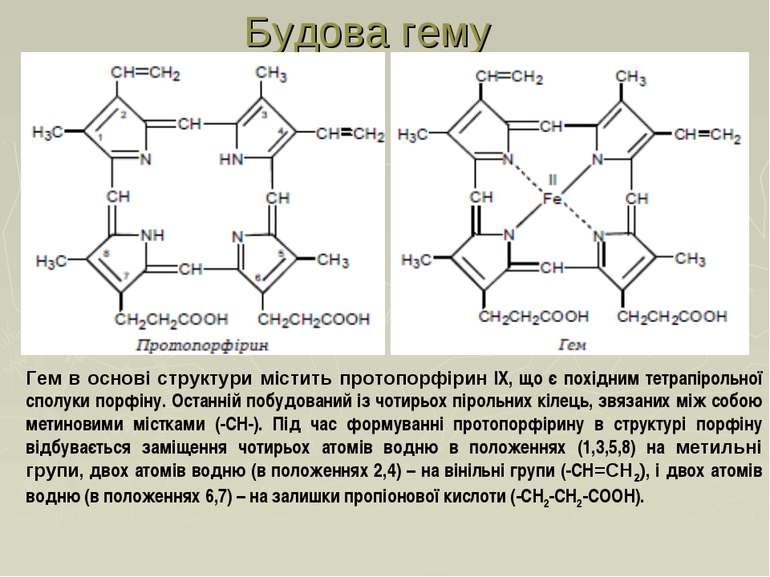
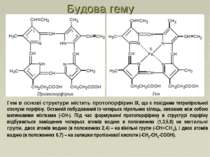
Гем в основі структури містить протопорфірин IX, що є похідним тетрапірольної сполуки порфіну. Останній побудований із чотирьох пірольних кілець, звязаних між собою метиновими містками (-СН-). Під час формуванні протопорфірину в структурі порфіну відбувається заміщення чотирьох атомів водню в положеннях (1,3,5,8) на метильні групи, двох атомів водню (в положеннях 2,4) – на вінільні групи (-СН=СН2), і двох атомів водню (в положеннях 6,7) – на залишки пропіонової кислоти (-СН2-СН2-СООН). Будова гему
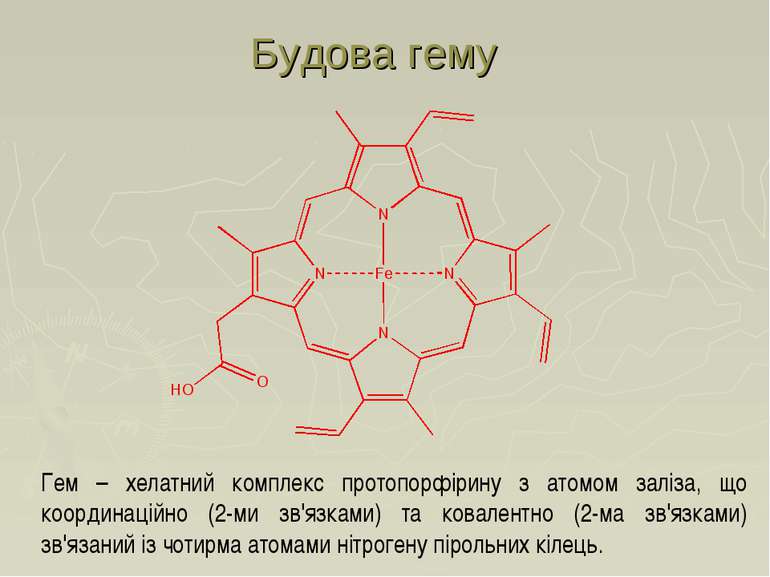
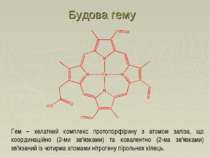
Гем – хелатний комплекс протопорфірину з атомом заліза, що координаційно (2-ми зв'язками) та ковалентно (2-ма зв'язками) зв'язаний із чотирма атомами нітрогену пірольних кілець. Будова гему
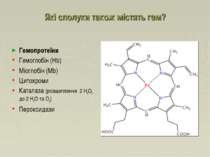
Які сполуки також містять гем? Гемопротеїни Гемоглобін (Hb) Міоглобін (Mb) Цитохроми Каталаза (розщеплення 2 H2O2 до 2 H2O та O2) Пероксидази
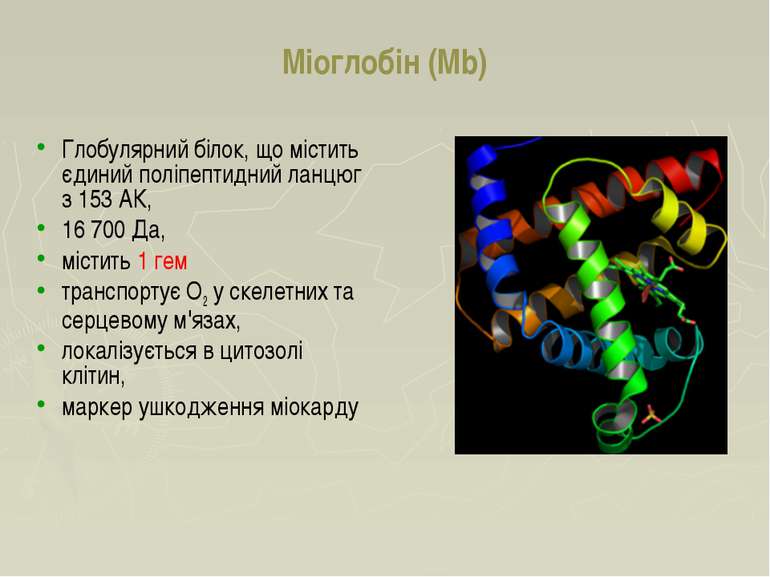
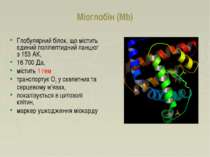
Міоглобін (Mb) Глобулярний білок, що містить єдиний поліпептидний ланцюг з 153 AК, 16 700 Да, містить 1 гем транспортує O2 у скелетних та серцевому м'язах, локалізується в цитозолі клітин, маркер ушкодження міокарду
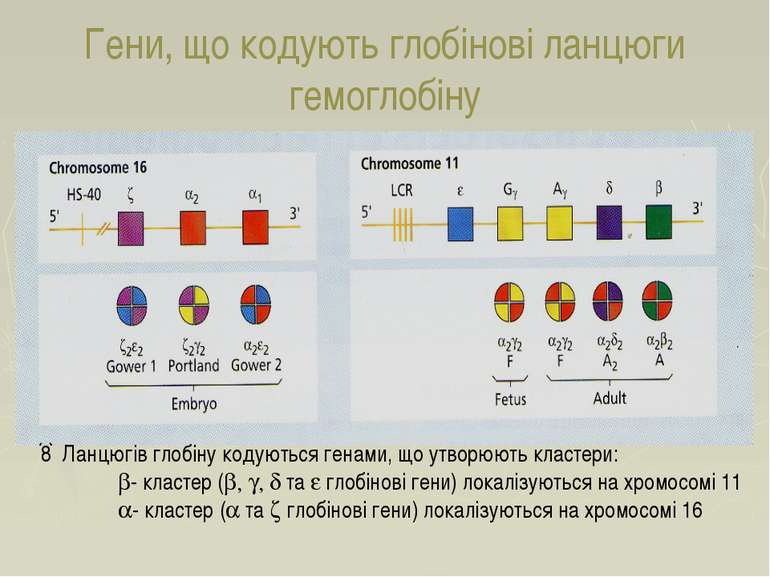
Гени, що кодують глобінові ланцюги гемоглобіну 8 Ланцюгів глобіну кодуються генами, що утворюють кластери: b- кластер (b, g, d та e глобінові гени) локалізуються на хромосомі 11 a- кластер (a та z глобінові гени) локалізуються на хромосомі 16
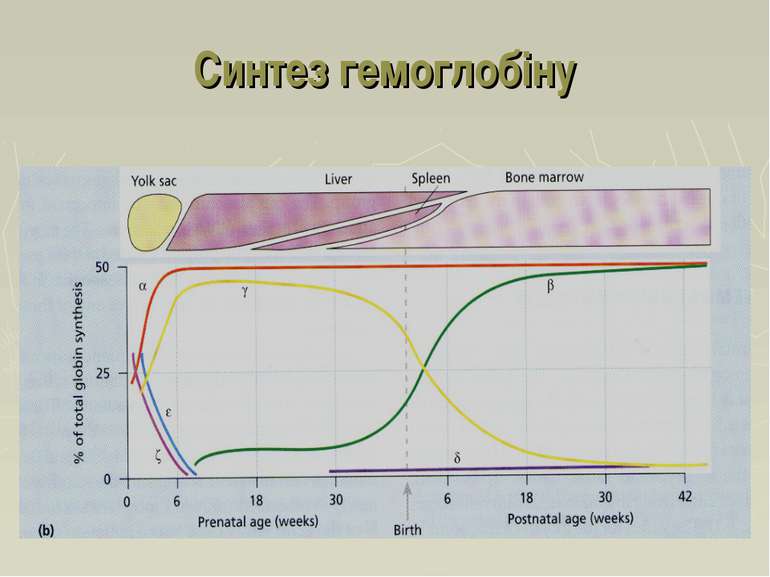
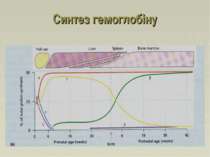
Синтез глобіну починається з 3-го тижня вагітності Ембріональний Гемоглобін Gower I ( z2e2) Гемоглобін Portland ( z2g2) Гемоглобін Gower II (a2e2) Фетальний : HbF (a2g2), HbA (a2b2) Дорослий : HbA, HbA2 ( a2d2), HbF. Синтез глобіну
Типи гемоглобіну дорослої людини Фетальний гемоглобін відрізняється своїми фізико-хімічними властивостями – електрофорктичною рухливісь, стійкістю до лужної денатурації Тип Будова Коментарі HbA (96%) 2 2 HbA2 (2,5 %) 2 2 HbF (1,5% в дорослих, у плодів – головна форма гемоглобіну впродовж 2го та 3rо триместру вагітності) 2 2 His143 ( ) Ser ( )
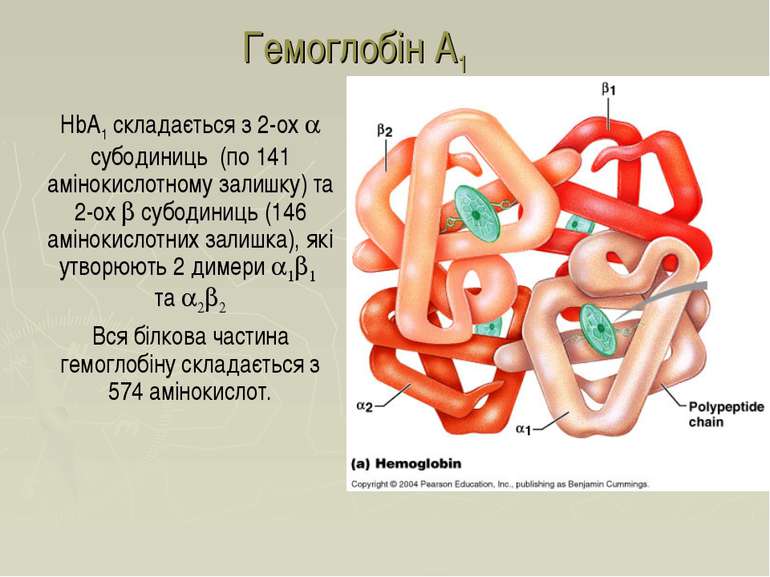
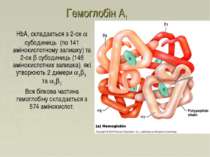
Гемоглобін A1 HbA1 складається з 2-ох a субодиниць (по 141 амінокислотному залишку) та 2-ох b субодиниць (146 амінокислотних залишка), які утворюють 2 димери a1b1 та a2b2 Вся білкова частина гемоглобіну складається з 574 амінокислот.
Похідні гемоглобіну Оксигемоглобін (oxyHb) = Hb з O2 Дезокси (deoxyHb) = Hb без O2 Карбоксигемоглобін (HbCO) – CO звязується з Fe2+ гему у випадку отруєння CO або паління. Карбгемоглобін (HbCO2) - CO2 нековалентно звязується з глобіновим ланцюгом Hb. Метгемоглобін (metHb) містить Fe3+ замість of Fe2+ Глікозильований гемоглобін (HbA1c) за умов норми не перевищує (› 7%).
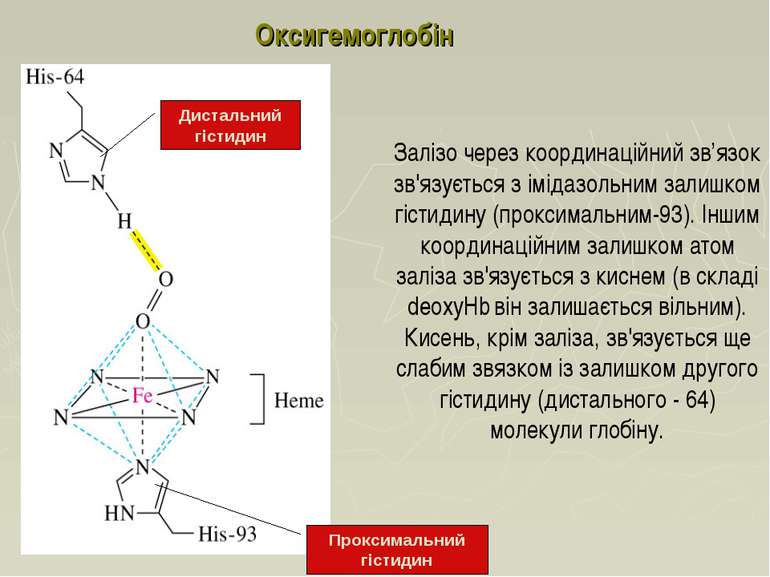
Залізо через координаційний зв’язок зв'язується з імідазольним залишком гістидину (проксимальним-93). Іншим координаційним залишком атом заліза зв'язується з киснем (в складі deoxyHb він залишається вільним). Кисень, крім заліза, зв'язується ще слабим звязком із залишком другого гістидину (дистального - 64) молекули глобіну. Дистальний гістидин Проксимальний гістидин Оксигемоглобін
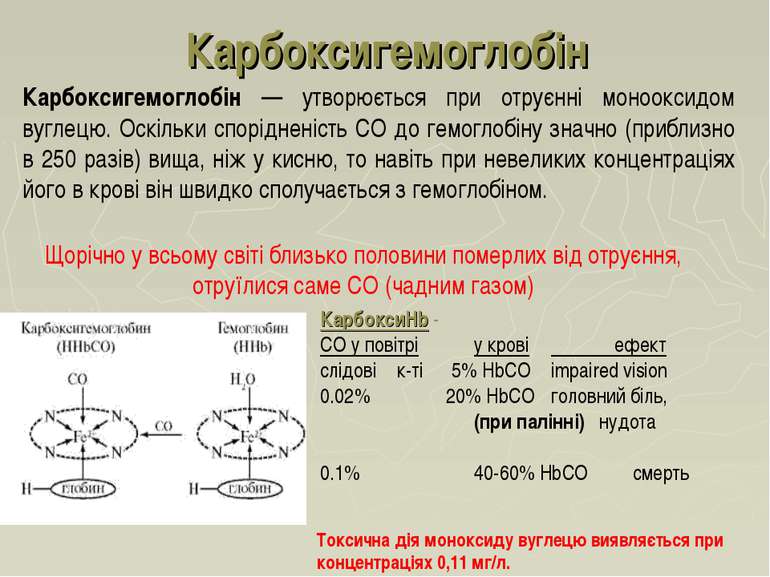
Карбоксигемоглобін Карбоксигемоглобін — утворюється при отруєнні монооксидом вуглецю. Оскільки спорідненість СО до гемоглобіну значно (приблизно в 250 разів) вища, ніж у кисню, то навіть при невеликих концентраціях його в крові він швидко сполучається з гемоглобіном. КарбоксиHb - CO у повітрі у крові ефект слідові к-ті 5% HbCO impaired vision 0.02% 20% HbCO головний біль, (при палінні) нудота 0.1% 40-60% HbCO смерть Токсична дія моноксиду вуглецю виявляється при концентраціях 0,11 мг/л. Щорічно у всьому світі близько половини померлих від отруєння, отруїлися саме СО (чадним газом)
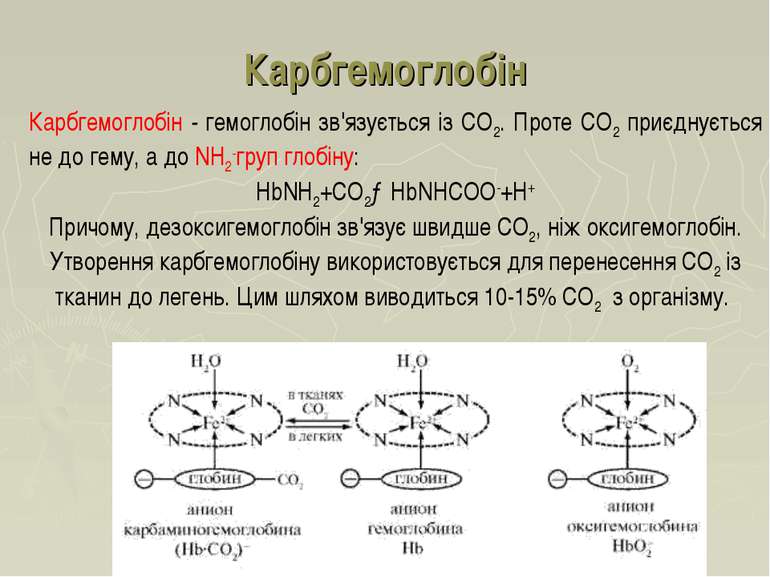
Карбгемоглобін Карбгемоглобін - гемоглобін зв'язується із СО2. Проте СО2 приєднується не до гему, а до NH2-груп глобіну: НbNH2+СО2→НbNНСОО-+H+ Причому, дезоксигемоглобін зв'язує швидше СО2, ніж оксигемоглобін. Утворення карбгемоглобіну використовується для перенесення СО2 із тканин до легень. Цим шляхом виводиться 10-15% СО2 з організму.
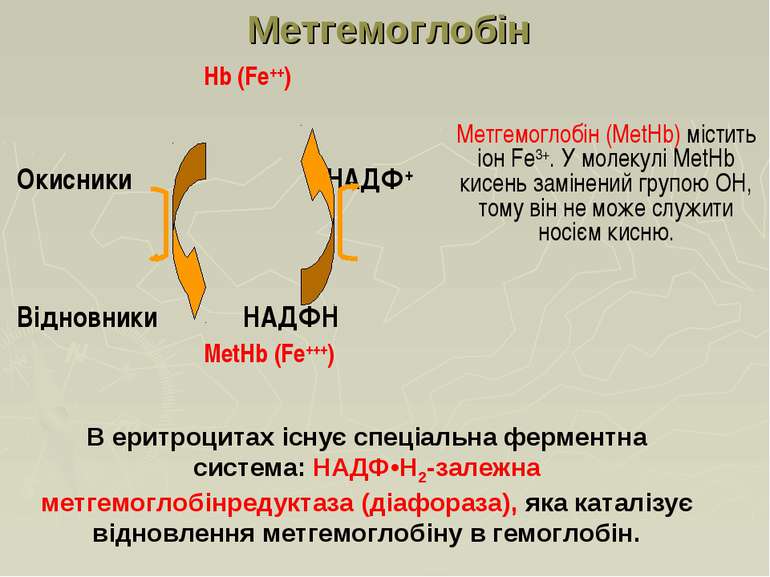
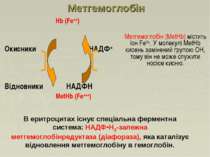
Hb (Fe++) Окисники НАДФ+ Відновники НAДФH MetHb (Fe+++) Метгемоглобін Метгемоглобін (МеtHb) містить іон Fе3+. У молекулі МеtHb кисень замінений групою ОН, тому він не може служити носієм кисню. В еритроцитах існує спеціальна ферментна система: НАДФ•Н2-залежна метгемоглобінредуктаза (діафораза), яка каталізує відновлення метгемоглобіну в гемоглобін.
Met Hb 1.7% HbM - норма 10% HbM - ціаноз 15-30% HbM- генетична недостатність метгемоглобінредуктази >35% HbM - головний біль, слабкість, запаморочення, задуха ~70% HbM - смерть В крові дорослої людини завжди є невелика кількість МеtHb (0,3-3 г/л). Зокрема, МеtHb зв'язує (знешкоджує) ціаніди, перетворюючи їх в порівняно нешкідливий ціанметгемоглобін. Крім цього, метгемоглобін знешкоджує сірководень, масляну кислоту та інші речовини; проявляє більш виражену пероксидазну дію, ніж гемоглобін. Значення цього процесу полягає не тільки в руйнуванні токсичних для організму перекисів, але і в тому, що метгемоглобін при цьому відновлюється в гемоглобін. Метгемоглобін
Глікозильований гемоглобін НbА1C — глікозильований Hb, який з'являється в еритроцитах за умов некомпенсованого цукрового діабету. Цей Hb — стабільний комплекс глюкози з мінорною А1C фракцією Hb, який утворюється між аміногрупою валіну - N-кінцевою амінокислотою β-глобіну і карбоксильною групою вуглеводу: У нормі концентрація HbA1C становить 5-7% від загальної кількості, тобто 8-10 г/л. Гіперглікемія на протязі 10-12 годин сприяє збільшенню кількості глікозильованого гемоглобіну. Глікозилювання гемоглобіну підвищує його спорідненність до кисню в тканинах, крім цього, затруднює приєднання 2,3-ДФГ.
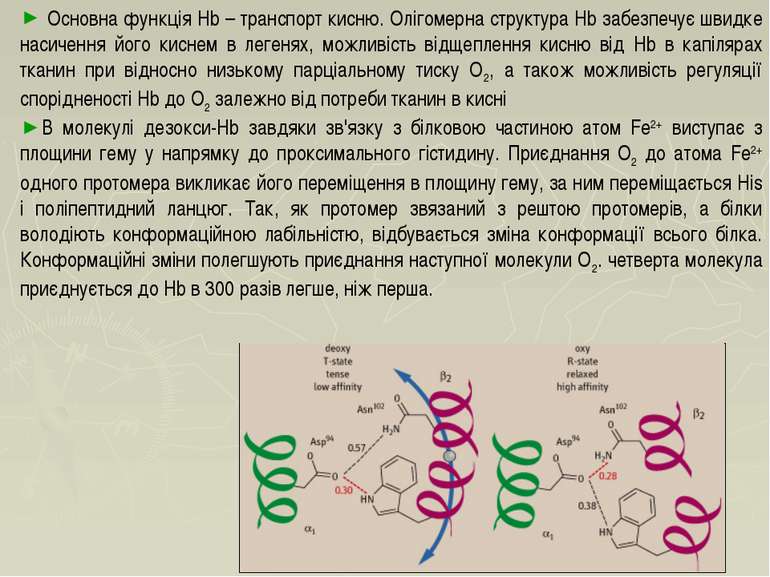
Основна функція Hb – транспорт кисню. Олігомерна структура Hb забезпечує швидке насичення його киснем в легенях, можливість відщеплення кисню від Hb в капілярах тканин при відносно низькому парціальному тиску О2, а також можливість регуляції спорідненості Hb до О2 залежно від потреби тканин в кисні В молекулі дезокси-Hb завдяки зв'язку з білковою частиною атом Fe2+ виступає з площини гему у напрямку до проксимального гістидину. Приєднання О2 до атома Fe2+ одного протомера викликає його переміщення в площину гему, за ним переміщається His і поліпептидний ланцюг. Так, як протомер звязаний з рештою протомерів, а білки володіють конформаційною лабільністю, відбувається зміна конформації всього білка. Конформаційні зміни полегшують приєднання наступної молекули О2. четверта молекула приєднується до Hb в 300 разів легше, ніж перша.
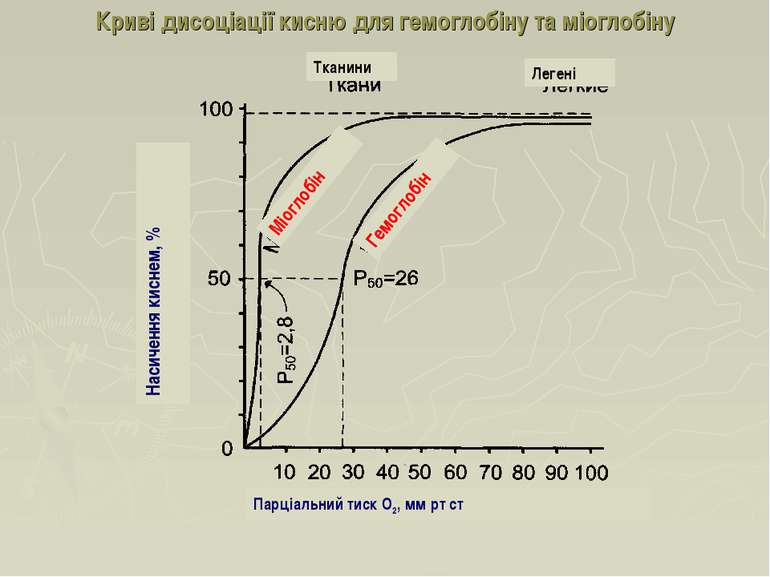
Криві дисоціації кисню для гемоглобіну та міоглобіну Насичення киснем, % Легені Парціальний тиск О2, мм рт ст Тканини Гемоглобін Міоглобін
Ефект кооперативності Ефект кооперативності: приєднання кожної молекули O2 підвищує спорідненість до наступної Вивільненню кисню з оксигемоглобіну в периферійних тканинах значною мірою сприяє градієнт його парціального тиску в напрямку альвеоли (100 мм рт. ст.) → артеріальна кров (90 мм рт. ст.) → венозна кров (40 мм рт. ст.) → мітохондрії клітин (0-5 мм рт. ст.).
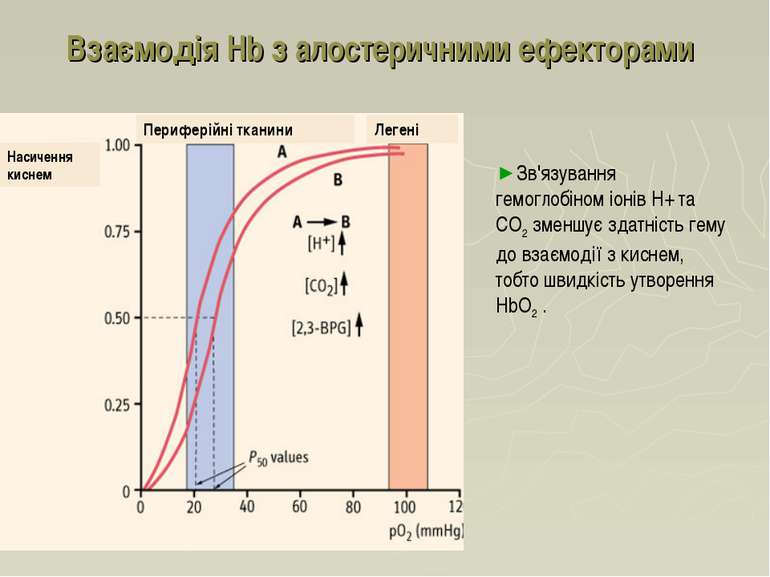
Взаємодія Hb з алостеричними ефекторами Зв'язування гемоглобіном іонів Н+ та СО2 зменшує здатність гему до взаємодії з киснем, тобто швидкість утворення НbО2 . Периферійні тканини Легені Насичення киснем
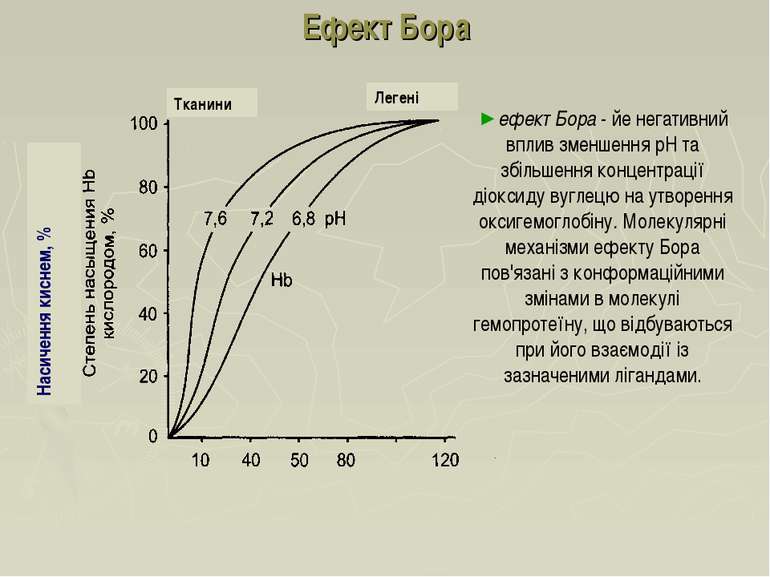
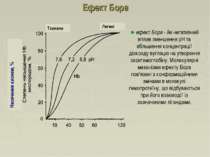
Ефект Бора ефект Бора - йе негативний вплив зменшення рН та збільшення концентрації діоксиду вуглецю на утворення оксигемоглобіну. Молекулярні механізми ефекту Бора пов'язані з конформаційними змінами в молекулі гемопротеїну, що відбуваються при його взаємодії із зазначеними лігандами. Легені Тканини Насичення киснем, %
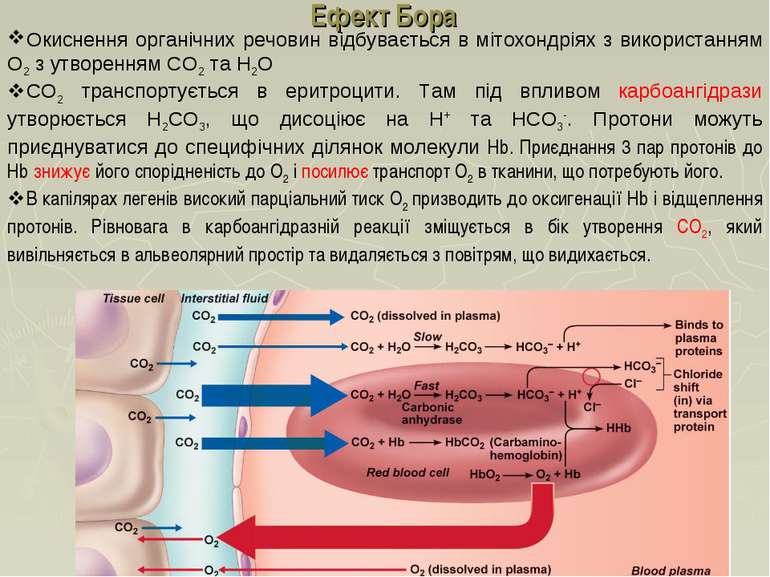
Ефект Бора Окиснення органічних речовин відбувається в мітохондріях з використанням О2 з утворенням СО2 та Н2О СО2 транспортується в еритроцити. Там під впливом карбоангідрази утворюється Н2СО3, що дисоціює на Н+ та НСО3-. Протони можуть приєднуватися до специфічних ділянок молекули Hb. Приєднання 3 пар протонів до Hb знижує його спорідненість до О2 і посилює транспорт О2 в тканини, що потребують його. В капілярах легенів високий парціальний тиск О2 призводить до оксигенації Hb і відщеплення протонів. Рівновага в карбоангідразній реакції зміщується в бік утворення СО2, який вивільняється в альвеолярний простір та видаляється з повітрям, що видихається.
Вплив 2,3-дифосфогліцерату pO2 (парціальний тиск O2) насичення O2, % Продукт анаеробного гліколізу в еритроцитах Концентрація 2,3-ДФГ в еритроцитах 5 мМ, що наближається до еквімолярної концентрації з гемоглобіном. 2,3-ДФГ, приєднуючись до гемоглобіну змінює (зменшує) спорідненість до О2. Приєднання 2,3-ДФГ до дезоксиHb відбувається в алостеричному центрі Hb. Концентрація 2,3-ДФГ може змінюватись, так в умовах високогір'я, коли людина піднімається на висоту 4000 м над рівнем моря концентрація 2,3-ДФГ зростає вдвічі за 2 дня, що знижує спорідненість Hb до кисню і підвищує кількість О2, що транспортується до тканин. У хворих з емфіземою легенів, парціальний тиск О2 знижується, при цьому зростає продукування 2,3-ДФГ, його концентрація сягає 7мМ. 2,3-ДФГ= 8 ммоль/л 2,3-ДФГ= 0 ммоль/л 2,3-ДФГ= 5 ммоль/л (норма)
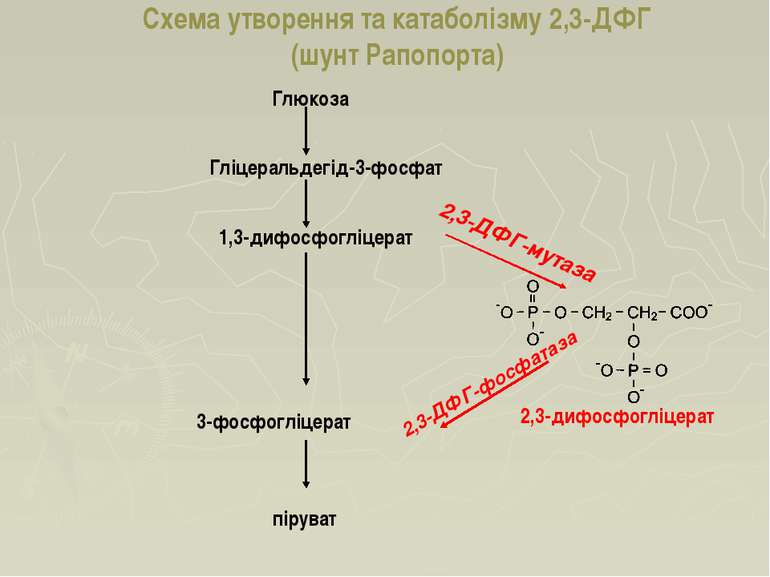
Схема утворення та катаболізму 2,3-ДФГ (шунт Рапопорта) Глюкоза Гліцеральдегід-3-фосфат 1,3-дифосфогліцерат 3-фосфогліцерат піруват 2,3-дифосфогліцерат 2,3-ДФГ-мутаза 2,3-ДФГ-фосфатаза
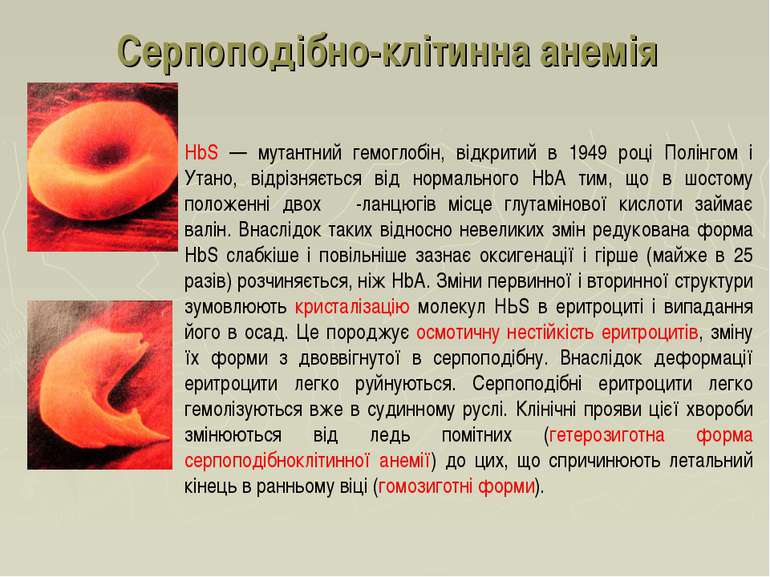
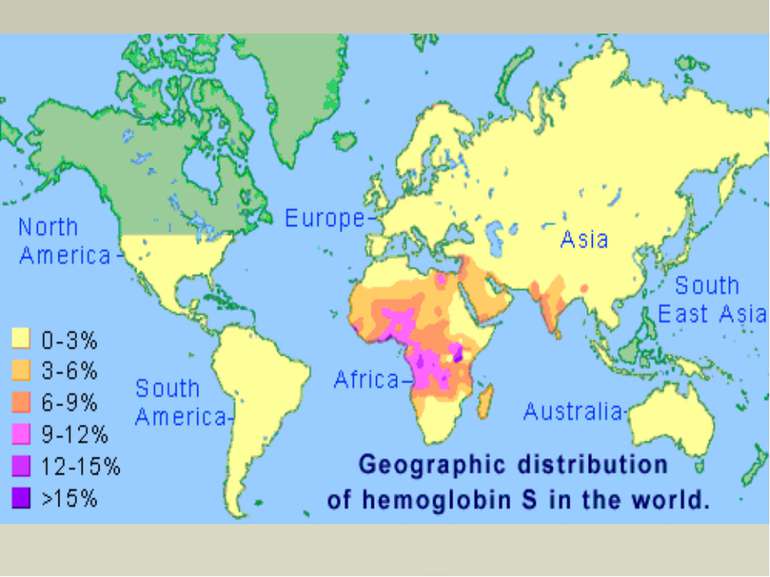
Серпоподібно-клітинна анемія НbS — мутантний гемоглобін, відкритий в 1949 році Полінгом і Утано, відрізняється від нормального HbА тим, що в шостому положенні двох β-ланцюгів місце глутамінової кислоти займає валін. Внаслідок таких відносно невеликих змін редукована форма HbS слабкіше і повільніше зазнає оксигенації і гірше (майже в 25 разів) розчиняється, ніж НbА. Зміни первинної і вторинної структури зумовлюють кристалізацію молекул НЬS в еритроциті і випадання його в осад. Це породжує осмотичну нестійкість еритроцитів, зміну їх форми з двоввігнутої в серпоподібну. Внаслідок деформації еритроцити легко руйнуються. Серпоподібні еритроцити легко гемолізуються вже в судинному руслі. Клінічні прояви цієї хвороби змінюються від ледь помітних (гетерозиготна форма серпоподібноклітинної анемії) до цих, що спричинюють летальний кінець в ранньому віці (гомозиготні форми).
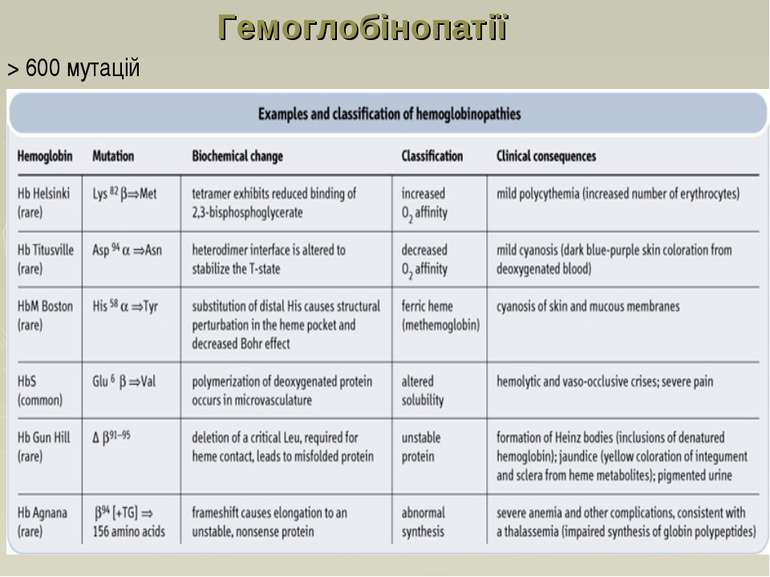
Гемоглобінопатії НbС — аномальний Hb, у молекулі якого існує заміна залишку глутамінової кислоти в 6-му положенні β-ланцюга на лізин. Еритроцити, що містять такий аномальний Hb, здатні до гемолізу, що також супроводжується розвитком анемії. НbМ — існує група гемоглобінів М, в поліпептидних ланцюгах яких залишок гістидину, який бере участь у зв'язуванні гему з залізом, заміщений на іншу амінокислоту. У Hb, які містять такий молекулярний дефект, залізо (Fe3+) не може відновлюватися метгемоглобінредуктазою до Fe2+, у зв'язку з цим в еритроцитах накопичується метгемоглобін (містить Fe3+ у складі гему), що не здатний до нормального транспорту кисню. Така метгемоглобінемія найбільш виражена в гомозиготному стані, внаслідок чого хворі гинуть в умовах важкої гіпоксії.
Таласемії Таласемії - захворювання, зумовлен порушенням синтезу a-або β-ланцюгів гемоглобіну. При цьому окремі ланцюги можуть бути відсутніми або замінюватися іншими. Розрізняють а-таласемію (коли порушений синтез а-ланцюга) і β-таласемію (порушений синтез β-ланцюга гемоглобіну). Більш поширеною формою є β-таласемія. Часто зустрічаються комбіновані форми гемоглобінозів, які можуть поєднуватися з дефіцитом глюкозо-6-фосфатдегідрогенази в еритроцитах, що ще більше посилює розвиток захворювання (анемії). Гемоглобінопатії частіше зустрічаються серед населення Середньої Азії, Азербайджану і Закавказзя. Загальну і диференціальну діагностику гемоглобінозів проводять за допомогою біохімічних методів, в тому числі електрофоретичними дослідженнями гемоглобіну.
Кислотно-основний стан крові Кров відіграє значну роль у підтриманні кислотно-основного гомеостазу, тобто певного співвідношення між концентраціями водневих та гідроксильних іонів у біологічних рідинах. Кислотно-основний стан (КОС) характеризується такими показниками: У крові здорової людини підтримується постійна концентрація водневих іонів, що становить в плазмі венозної крові рН 7,36, а артеріальної - рН 7,4 реакція нормальної крові є слаболужню. рСО2 - парціальний тиск вуглекислого газу в артеріальній крові 35-45 мм.рт.ст., у венозній - вищий; Стандартний бікарбонат (SВ) - концентрація гідрокарбонату плазми крові становить 24-27 ммоль/л: Буферні основи (ВВ) - це сума аніонів буферних основ - гідрокарбонатів, білків, фосфатів. гемоглобіну (за умови повного насичення його СО2). В нормі їх концентрація в крові становить 42-52 ммоль/л: Нормальні буферні основи (NВВ) цільної крові - сума всіх основних буферних систем крові при фізіологічних значеннях рН і рСО2 альвеолярного повітря. В нормі становлять 0±2,3 ммоль/л: Надлишок основ (ВЕ) - показник надлишку або дефіциту буферних потужностей.
Порушення кислотно-основного стану Якщо компенсаторні механізми організму не здатні попередити зсуви концентрації водневих іонів, наступає порушення КОС - ацидоз або алкалоз. Дихальний ацидоз виникає при бронхіальній астмі, набряку, емфіземі, асфіксії механічного характеру тощо. Всі ці захворювання призводять до гіповентиляції і гіперкапнії, тобто підвищення рСО2 артеріальної крові. Метаболічний ацидоз – супроводжується нагромадженням в тканинах і в крові органічних кислот. Метаболічний ацидоз спостерігається при діабеті, голодуванні, гарячці, захворюваннях шлунково-кишкового тракту, шоках тощо. Дихальний алкалоз виникає при посиленій вентиляції легень, що супроводжується швидким виділенням з організму СО2 і розвитку гіпокапнії (рСО2 менше 35мм.рт.ст.). Такий вид алкалозу може спостерігатися при вдиханні чистого кисню, компенсаторній задишці, яка супроводжує ряд захворювань. Метаболічний алкалоз розвивається при втраті великої кількості кислот (блювота тощо) і всмоктуванні основних еквівалентів кишкового соку, які не нейтралізувалися кислим шлунковим соком, а також при нагромадженні основних еквіваленті в v тканинах (при тетанії) і у випадку неправильної корекції метаболічного ацидозу.
Буферні системи крові Бікарбонатна буферна система Буферна система гемоглобіну Фосфатна буферна система Білкова буферна система
Бікарбонатна буферна система складається з вільної вугільної кислоти, яка розчинена в плазмі і еритроцитах та розчинених бікарбонатів — натрію (в плазмі) та калію (в еритроцитах). Вміст бікарбонатів перевищує вміст вільної вуглекислоти у 18-20 разів, що і зумовлює деяку лужність крові. Запас бікарбонатів у крові (тобто хімічно зв'язана вуглекислота) отримав назву лужного резерву крові, що є важливим біохімічним компонентом, який протидіє зсувам рН крові в кислий бік при накопиченні в організмі кислих продуктів. H2CO3 H++ HCO3- Зниження лужного резерву крові, що відбувається за рахунок нейтралізації кислот бікарбонатами, супроводжується утворенням еквівалентної кількості Н2СО3 яка, проте, не накопичується в крові, а швидко розкладається на воду та діоксид вуглецю і виділяється. легенями. Співвідношення між концентраціями вуглекислоти та бікарбонатів при цьому залишається постійним. Бікарбонатна буферна система
Буферна система гемоглобіну. Здатність гемоглобіну та оксигемоглобіну бути компонентами відповідних буферних систем пов'язана з їх властивостями як кислот, які здатні утворювати в еритроцитах нестійкі калієві солі. Калієва сіль гемоглобіну (КНb) в тканинних капілярах може взаємодіяти з вугільною кислотою (а також іншими кислими метаболітами), утворюючи вільний гемоглобін-кислоту (ННb) та сіль відповідної кислоти. Оксигемоглобін, який присутній в артеріальній крові, є більш сильною кислотою, ніж гемоглобін, і його калієва сіль може розкладати бікарбонати з утворенням вугільної кислоти, яка виділяється легенями у формі СО2 .
Фосфатна буферна система Вона становить всього 1% від всієї буферної ємності крові. Однак в тканинах ця система є однією з основних. Роль кислоти в цій системі виконує однозаміщений фосфат – NаН2Р04, а роль солі – двохзаміщенин фосфат - Nа2НРO4. Буферна дія фосфатної системи основана на можливості зв'язування іонів водню аніонами НРO42- з утворенням Н2РO4-. а також іонів ОН- з іонами Н2РO4- (Н- + Н2РO4- → НРO42-+ Н2О) У крові максимальна ємність фосфатного буферу проявляється при рН 7,2. Фосфатний буфер у крові знаходиться в тісному взаємозв'язку з бікарбонатною буферною системою.
Білкова буферна система Білки утворюють буферну систему за рахунок наявності кислотно-основних груп у молекулі білків: білок – Н+ ( кислота, донор протонів) і білок - (спряжена основа, акцептор протонів). Білкова буферна система плазми крові ефективна при рН 7.2-7.4.
Легені та нирки беруть участь у підтриманні КОС. регулюючи екскрецію або затримку в організмі надлишку кислих або основних продуктів метаболізму Зокрема, виділення легенями діоксиду вуглецю під час дихання протидіє накопиченню в крові кислих еквівалентів. Нирки здатні як до екскреції кислих (кислі фосфати тощо) або лужних продуктів (Nа2НРО4, іонів амонію), так і до затримання лужних еквівалентів шляхом реабсорбції бікарбонатів.
Гіпоксія – це недостатність О2 в тканинах. Гіпоксії поділяють на 2 групи: 1. Гіпоксія, викликана зниженням рО2 у повітрі, що вдихається (екзогенна гіпоксія). 2. Гіпоксія внаслідок розвитку патологічного процесу. До цієї групи належать наступні типи: а) дихальний (легеневий); б) серцево-судинний (циркуляторний); в) кров'яний (гемічний); г) тканинний (гістотоксичний); д) змішаний. Гіпоксія
Гіпоксія, викликана зниженням рО2 у повітрі, що вдихається Цей вид гіпоксії спостерігається, головним чином за умов високогір'я. Може також мати місце за умов, коли загальний барометричний тиск нормальний, але РО2 знижений: наприклад, при аварії в шахтах, на підводних човнах, а також підчас операцій, якщо наркозна апаратура несправна. При екзогенній гіпоксії розвивається гіпоксемія, тобто зменшується РО2 в артеріальній крові і знижується насичення гемоглобіну киснем.
Гіпоксія внаслідок розвитку патологічного процесу Дихальний (легеневий) тип гіпоксії виникає внаслідок альвеолярної гіпевентеляції, зумовленої порушенням прохідності дихальних шляхів (запальний процес, чужорідні предмети, спазм), зменшенням дихальної поверхні легенів (набряк, пневмонія). У подібних випадках знижується РО2 в альвеолярному повітрі та напруження кисню в крові, в результаті чого зменшується насичення гемоглобіну киснем. Серцево-судинний (циркуляторний) тип гипоксії спостерігається при порушенні кровобігу, що призводить до порушення кровопостачання легень. Для газового складу крові в типових випадках циркуляторної гіпоксії притаманні нормальний вміст кисню в артеріальній крові, але знижений у венозній
Гіпоксія внаслідок розвитку патологічного процесу Кров'яний (гемічний) тип гіпоксії виникає внаслідок зменшення кисневої ємності крові при анеміях, зумовлений зниженням еритроцитарної маси або зниженням вмісту гемоглобіну в еритроцитах. У таких випадках РО2 в венозній крові знижений. Тканинний (гістотоксичний) тип зазвичай зумовлений порушенням спроможності тканин поглинати кисень з крові. Утилізація кисню тканинами може погіршуватись як наслідок інгібування біологічного окиснення різно-манітними інгібіторами, порушення синтезу ферментів або пошкодження мембран клітин, наприклад, отруєння ціанідами.
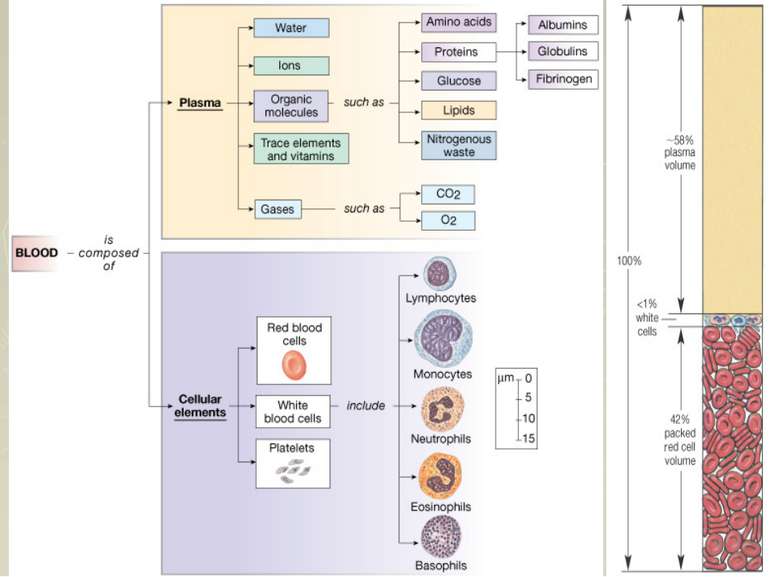
Білки плазми крові У плазмі крові міститься близько 7 % усіх білків організму. Це декілька десятків різних білків, які відрізняються за фізико-хімічними та функціональними властивостями: транспортні білки, ферменти, проферменти, інгібітори ферментів, гормони, антитіла, антитоксини, фактори коагуляції та антикоагулянти тощо. Білки плазми виконують функції: Підтримують осмотичний (онкотичний тиск) крові. Білки плазми крові утворюють важливу буферну систему крові, що підтримує рН у межах 7,37-7,43. Виконують транспортну функцію (альбуміни, трансретин, транскортин, феритин, гаптоглобін, церулоплазмін, тощо). Білки визначають в'язкість крові, а відтак відіграють важливу роль у гемодинаміці. Білки плазми крові служать резервом амінокислот для організму. Імуноглобуліни, білкові фактори згортання крові, 1-антитрипсин та білки системи комплементу забезпечують захисну функцію
Загальні властивості білків плазми крові Більшість синтезується у печінці Виняток: -глобуліни – синтезуються клітинами крові Синтезуються у вигляді попередників на полісомах, підлягають посттрансляційній модифікації на ЕРП Більшість за природою є глікопротеїнами Виняток: альбумін Характерною особливістю є період піврозпаду Т1/2у циркуляторному руслі – від декількох годин до декількох тижнів (для альбумінів – 20 днів) Багато білків плазми крові володіють поліморфізмом (імуноглобуліни, трансферин…) У клінічній практиці застосовується визначення співвідношення між концентраціями альбумінів та глобулінів у плазмі крові (так званого "білкового коефіцієнта"), який становить в середньому 1,5-2,0.
Глікопротеїни плазми крові Більшість білків плазми крові за своєю хімічною природою є складними білками глікопротеїнами (виняток альбуміни). До складу вуглеводної частини глікопротеїнів плазми крові належать олігосахариди, що складаються з таких моносахаридів та їх похідних: галактоза, маноза, рамноза, гюкозамін, галактозамін, нейрамінова кислота та сіалові кислоти. Вуглеводна частина зв'язується з білковою частино, утворюючи глікозидні зв'язки через ОН-групи залишків треоніну та серину, або карбоксильну групою аспарагінової кислоти. Різні глікопротеїни плазми крові різняться вуглеводним складом, а також співвідношенням білок:олігосахарид. Глікопротеїнів спостерігають при туберкульозі, плевритах, пневмоніях, гострому ревматизмі, нефротичному синдромі, діабеті, інфаркті міокарду, подагрі, хронічних лейкозах, мієломі, лімфосаркомі.
N-ацетил-нейрамінова (сіалова) кислота найактивніший, але, водночас, найбільш лабільний компонент глікопротеїнів. Як правило, із залишком N-ацетил-нейрамінової кислоти зв'язана галактоза. Ензим ендотелію нейрамінідаза гідролізує зв’язок між ними, галактоза стає доступною для специфічних рецепторів гепатоцитів. Шляхом ендоцитозу білки потрапляють в клітини печінки, де руйнуються. Глікопротеїни плазми крові Наприклад, білок плазми крові церулоплазмін — глікопротеїн. Його вуглеводна частина містить на кінцях ланцюгів сіалову кислоту. Період піврозпаду (Т1/2) для церулоплазміну досить великий, проте, якщо видалити залишок сіалової кислоти, він вкорочується до декількох хвилин: такий асіало-церулоплазмін захоплюється рецепторами гепатоцитів, комплементарними до дисахаридних залишків Gal-GlcNAc-. Приєднання асіало-церулоплазмину до рецепторів запускає механізм ендоцитозу. Якщо у церулоплазміну видалити ще й залишок галактози, то взаємодія з рецептором унеможливлюється і Т1/2 значно подовжується. Таким чином, вуглеводна частина глікопротеїнів визначає тривалість його існування в кровяному руслі.
Основні фракції білків плазми крові людини Фракція % Конц. (г/л) Альбуміни 52 – 58 40 – 50 1-глобуліни: тироксин-звязуючий глобулін, транскортин, 1-кислий глікопротеїн, 1-антитрипсин, 1-лілопротеїн (ЛПВЩ), 1-фетопротеїн 2,4 – 4,4 3-6 2-глобуліни: гаптоглобін, макроглобулін, церулоплазмін 6,1 – 10,1 5 – 9 -глобуліни: трансферин, ліпопротеїн (ЛПНЩ), C-реактивний білок, C3 та C4 компоненти системи комплементу 8,5 – 14,5 6 – 11 -глобуліни: IgG, IgM, IgA, IgD, IgE 10 – 21 8 – 15
Гіпер-, гіпо-, пара-, диспротеїнемія Загальна концентрація білків плазми крові людини становить 65-85 г/л. Гіперпротеїнемія, зумовлена збільшенням рівня -глобулінів, наприклад, гіперпротеїнемія в результаті інфекційного захворювання….. Гіпопротеїнемія або зменшення загальної кількості білків у плазмі крові відбувається за рахунок зменшення кількості альбумінів. Загальний вміст білка знижується до 30-40 г/л. Гіпопротеїнемія спостерігається при ураженні печінкових клітин (гостра атрофія печінки, токсичний гепатит тощо), при білковому голодуванні, злоякісних пухлинах. При мієломній хворобі в сироватці крові з'являються специфічні “мієломні білки”. Поява в плазмі крові білків, які в нормі не існують, прийнято називати парапротеїнемією. Часто при цьому захворюванні вміст білків у плазмі крові досягає 100-160 г/л. При багатьох захворюваннях (гепатити, гострий ревматизм, туберкульоз, ретикульоз тощо) дуже часто змінюється співвідношення окремих білкових фракцій, однак загальний вміст білка в сироватці крові залишається в нормі. Такий стан називається диспротеїнемією.
Білки розділяють різними методами: ЕФ на папері: альбуміни а1-глобуліни а2 -глобуліни β-глобуліни γ-глобуліни Висолювання нейтр. солями Альбуміни Глобуліни Фібриноген ЕФ на ПААГ : 16-17 фракцій ІмуноЕФ: Понад 30 фракцій зокрема: IgG, IgM, IgM, IgE, IgD, трансферин, а-макроглобулін, церулоплазмін, тощо
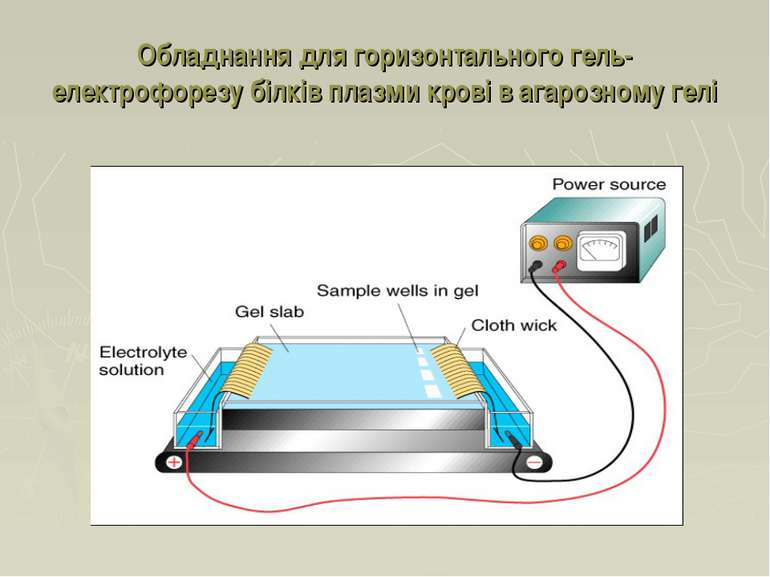
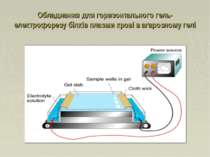
Електрофорез Принцип методу: Розділення заряджених частинок в електричному полі. Електрофоретична рухливість також залежить від: розміру, форми частинок та сили електричного поля Білки плазми крові негативно заряджені при pH 8.6 (буфер допомагає зберігати сталий рівень pH), вони рухаються до аноду зі швидкістю, що залежить від їхнього заряду Розділені білки фіксують та фарбують барвниками (напр. Амідоблек, Кумасі).
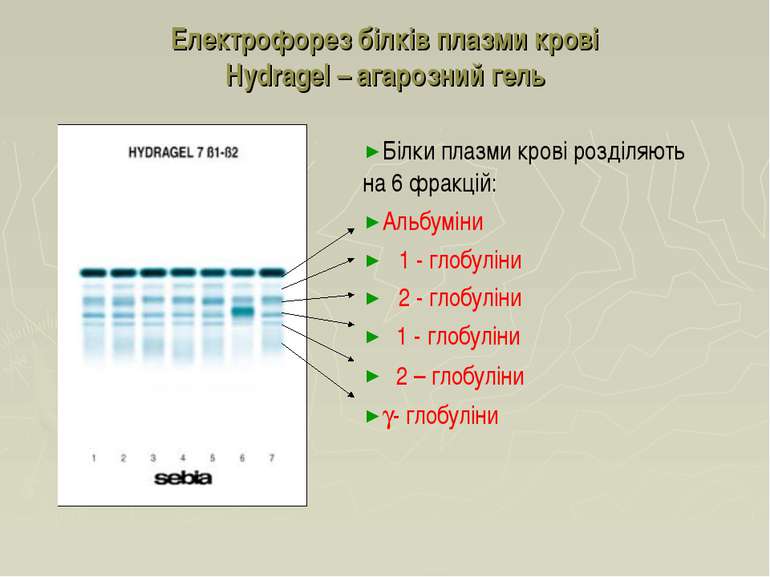
Електрофорез білків плазми крові Hydragel – агарозний гель Білки плазми крові розділяють на 6 фракцій: Альбуміни α1 - глобуліни α2 - глобуліни β1 - глобуліни β2 – глобуліни g- глобуліни
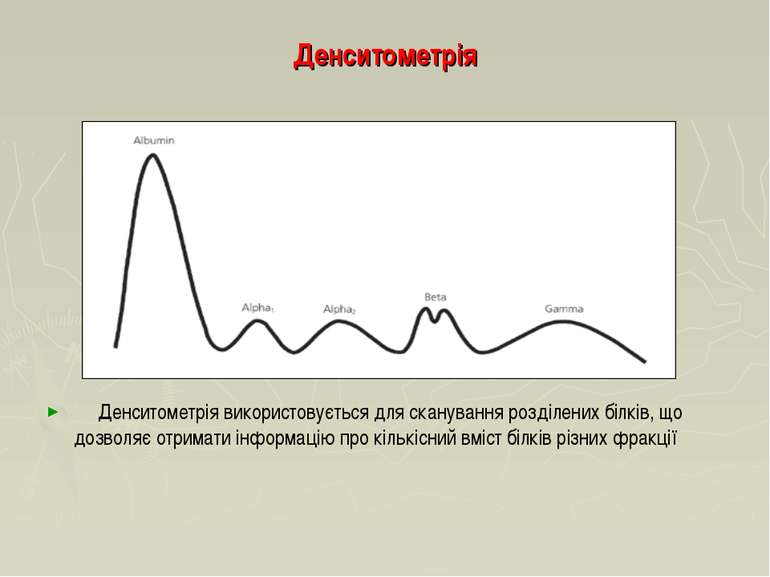
Денситометрія Денситометрія використовується для сканування розділених білків, що дозволяє отримати інформацію про кількісний вміст білків різних фракції
Використання електрофорзу для діагностики різних захворюваннь Електрофореграма є сталою за фізіологічних умов (iнтенсивність смуг). Спектр білків змінюється при різних захворюваннях (співвідношення фракцій) кількісна оцінка вмісту білків шляхом денситометрії
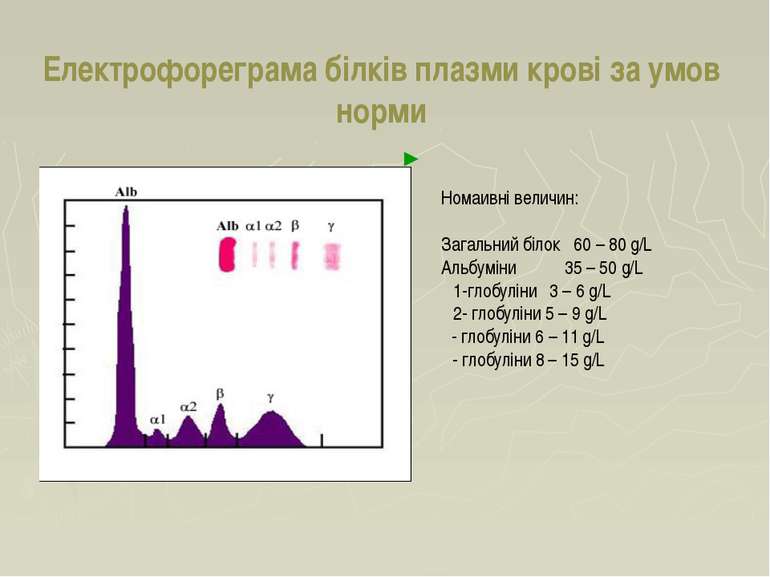
Електрофореграма білків плазми крові за умов норми Номаивні величин: Загальний білок 60 – 80 g/L Альбуміни 35 – 50 g/L α1-глобуліни 3 – 6 g/L α2- глобуліни 5 – 9 g/L β- глобуліни 6 – 11 g/L γ- глобуліни 8 – 15 g/L
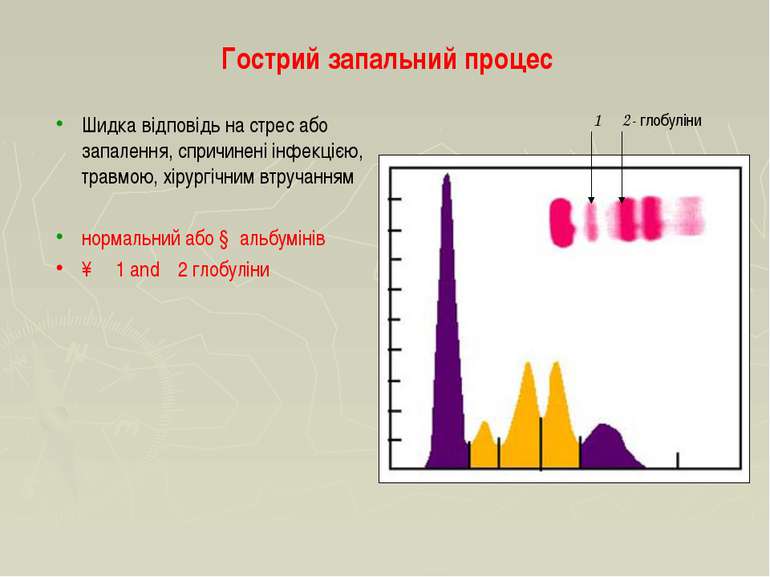
Гострий запальний процес Шидка відповідь на стрес або запалення, спричинені інфекцією, травмою, хірургічним втручанням нормальний або ↓ альбумінів ↑ α1 and α2 глобуліни α1 α2- глобуліни
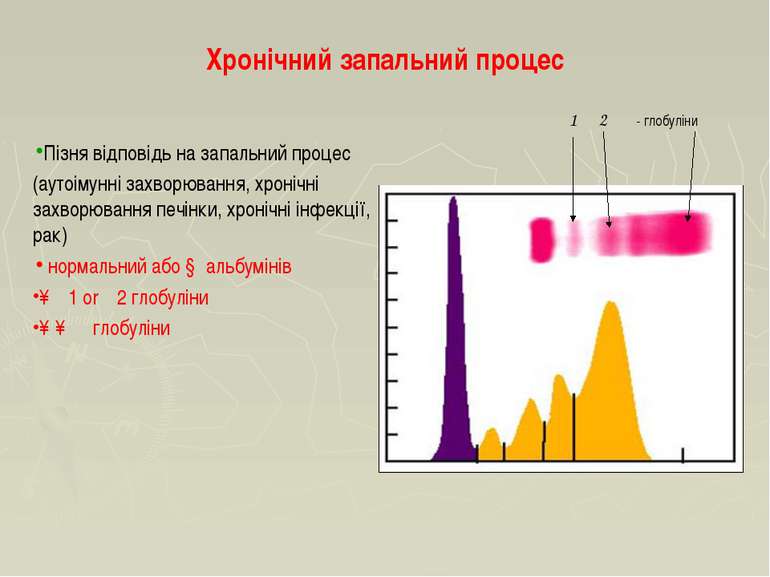
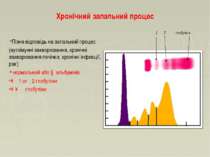
Хронічний запальний процес Пізня відповідь на запальний процес (аутоімунні захворювання, хронічні захворювання печінки, хронічні інфекції, рак) нормальний або ↓ альбумінів ↑α1 or α2 глобуліни ↑↑ γ глобуліни α1 α2 γ- глобуліни
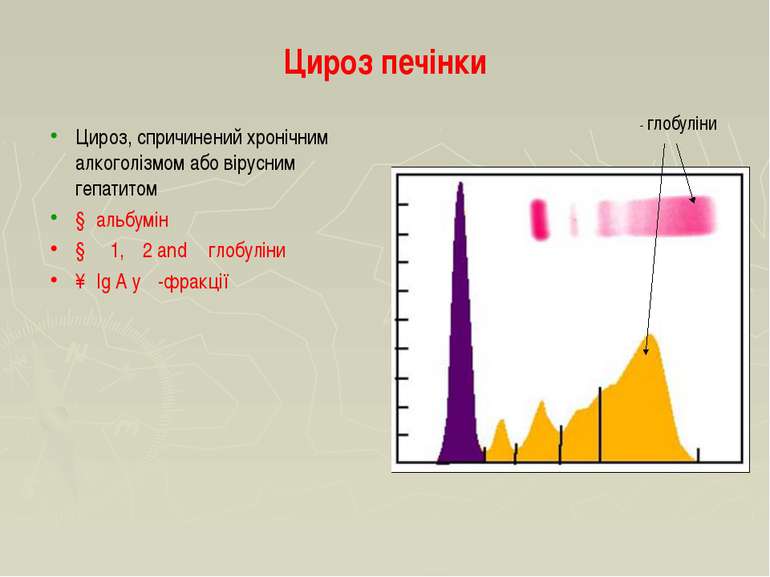
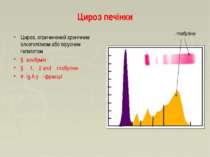
Цироз печінки Цироз, спричинений хронічним алкоголізмом або вірусним гепатитом ↓ альбумін ↓ α1, α2 and β глобуліни ↑ Ig A у γ-фракції γ- глобуліни
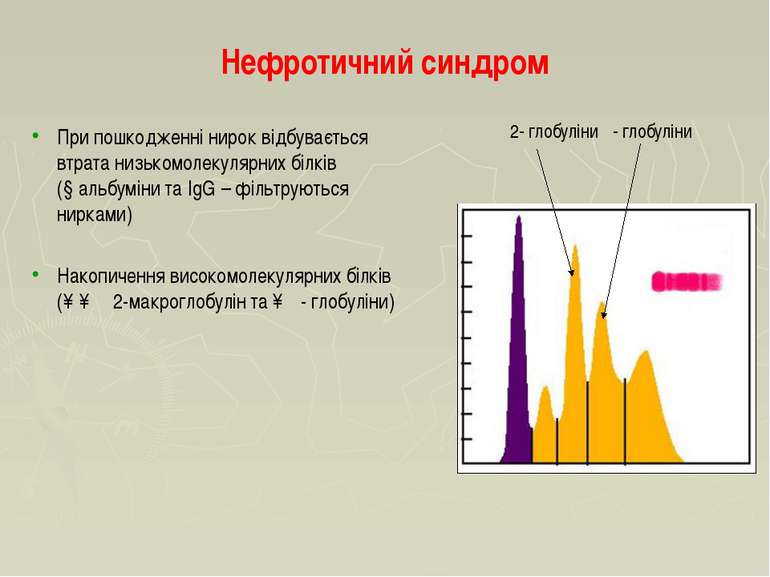
Нефротичний синдром При пошкодженні нирок відбувається втрата низькомолекулярних білків (↓альбуміни та IgG – фільтруються нирками) Накопичення високомолекулярних білків (↑↑ α2-макроглобулін та ↑β- глобуліни) α2- глобуліни β- глобуліни
Альбуміни Альбуміни (кнц. 40-50 г л) Синтезуються в печінці Прості білки з молек. масою 68,000 Да Еліпсоїдної форми, невеликого розміру Забезпечують до 70-80 % онкотичного тиску білків плазми крові, (застосовується в клінічній практиці при переливанні розчинів альбуміну хворим із тканинними набряками). альбумінів сироватки може спричиняти перехід води із судинного русла до тканин і розвиток онкотичних набряків. Альбуміни транспортують низку метаболітів та низькомолекулярних сполук: Стероїдних гормонів Вільних жирних кислот білірубіну ліків Ca2+ Cu2+ [Альбумінів] спостерігають при дегідратації [Альбумінів] спостерігають при захворюваннях печінки, нефротичному синдромі, синдромі мальабсорбції та при білковій недостатності
Глобуліни Глобуліни — гетерогенна фракція білків крові, які виконують наступні функції: транспортні ( 1-глобуліни — транспорт ліпідів, тироксину, кортикостероїдних гормонів, а2-глобуліни — транспорт ліпідів, іонів міді; β-глобуліни — транспорт ліпідів, вільного та гемового заліза) Захисні (участь β -глобулінів в імунних реакціях як антитоксинів: γ-глобуліни як фракція імуноглобулінів) функції. Імуноглобуліни крові. Імуноглобуліни (ІgА, IgG, IgE, IgM) — білки γ-глобулінової фракції плазми крові, які виконують функцію антитіл, основних ефекторів гуморального імунітету.
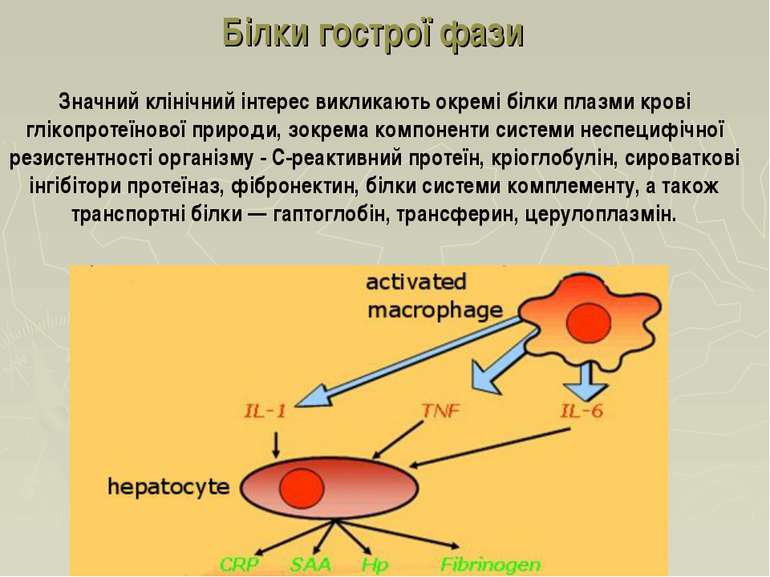
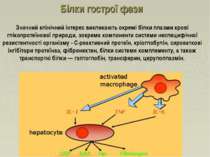
Білки гострої фази Значний клінічний інтерес викликають окремі білки плазми крові глікопротеїнової природи, зокрема компоненти системи неспецифічної резистентності організму - С-реактивний протеїн, кріоглобулін, сироваткові інгібітори протеїназ, фібронектин, білки системи комплементу, а також транспортні білки — гаптоглобін, трансферин, церулоплазмін.
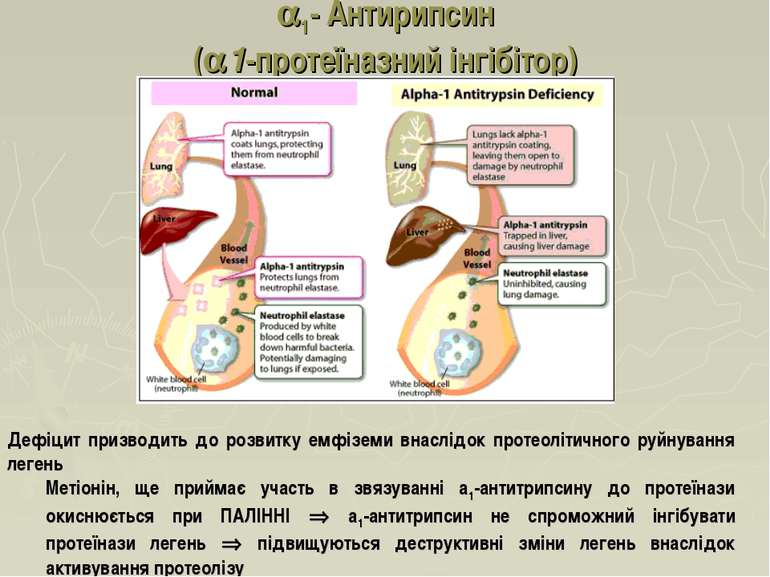
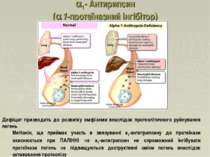
1- Антирипсин (a1-протеїназний інгібітор) Основний компонент ( 90 %) 1-фракції глікопротеїн з молекулярною масою 55 кД, концентрація якого в плазмі крові становить 2-3 г/л. Синтезується гепатоцитами та макрофагами Глікопротеїн Основною біологічною властивістю цього інгібітора є його здатність утворювати комплекси з протеїназами, пригнічуючи при цьому протеолітичну активність таких ферментів, як трипсин, хімотрипсин, плазмін, тромбін та протеаз, які вивільняються при руйнуванні лейкоцитів або чужорідних клітин у вогнищах запалення. В умовах запального процесу вміст 1-антитрипсину в крові значно збільшується за рахунок стимуляції його синтезу в гепатоцитах.
1- Антирипсин (a1-протеїназний інгібітор) Дефіцит призводить до розвитку емфіземи внаслідок протеолітичного руйнування легень Метіонін, ще приймає участь в звязуванні а1-антитрипсину до протеїнази окиснюється при ПАЛІННІ а1-антитрипсин не спроможний інгібувати протеїнази легень підвищуються деструктивні зміни легень внаслідок активування протеолізу
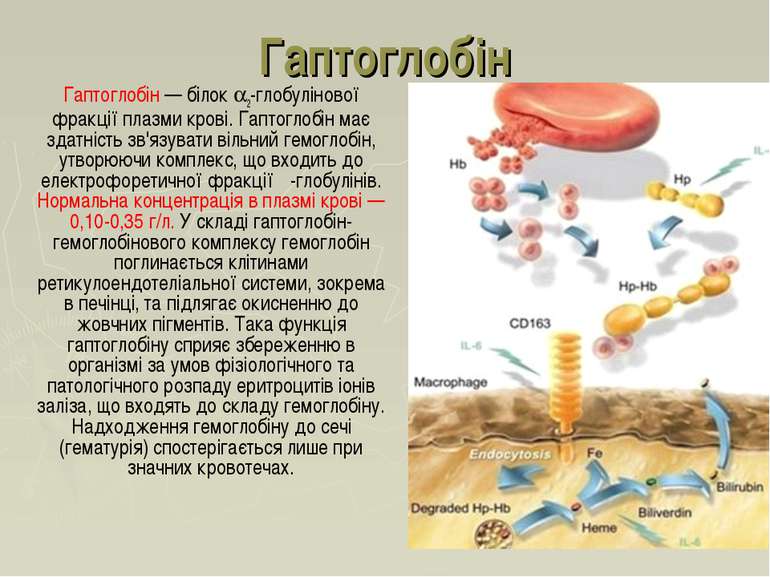
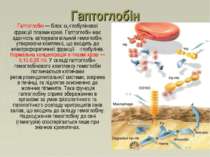
Гаптоглобін Гаптоглобін — білок 2-глобулінової фракції плазми крові. Гаптоглобін має здатність зв'язувати вільний гемоглобін, утворюючи комплекс, що входить до електрофоретичної фракції β-глобулінів. Нормальна концентрація в плазмі крові — 0,10-0,35 г/л. У складі гаптоглобін-гемоглобінового комплексу гемоглобін поглинається клітинами ретикулоендотеліальної системи, зокрема в печінці, та підлягає окисненню до жовчних пігментів. Така функція гаптоглобіну сприяє збереженню в організмі за умов фізіологічного та патологічного розпаду еритроцитів іонів заліза, що входять до складу гемоглобіну. Надходження гемоглобіну до сечі (гематурія) спостерігається лише при значних кровотечах.
Гаптоглобін належить до білків гострої фази запалення, інфекція рана малігнізація Зростання концентрації гаптоглобіну: Причини зниження концентрації гаптоглобіну Гемолітична анемія: Перід піврозпаду гаптоглобіну = 5 днів, тоді як комплексу гаптоглобін -Hb = 90 хв (комплекс швидко виводиться з плазми) рівень гаптоглобіну знижується, коли Hb постійно вивільняється еритроцитами (напр. гемолітична анемія)
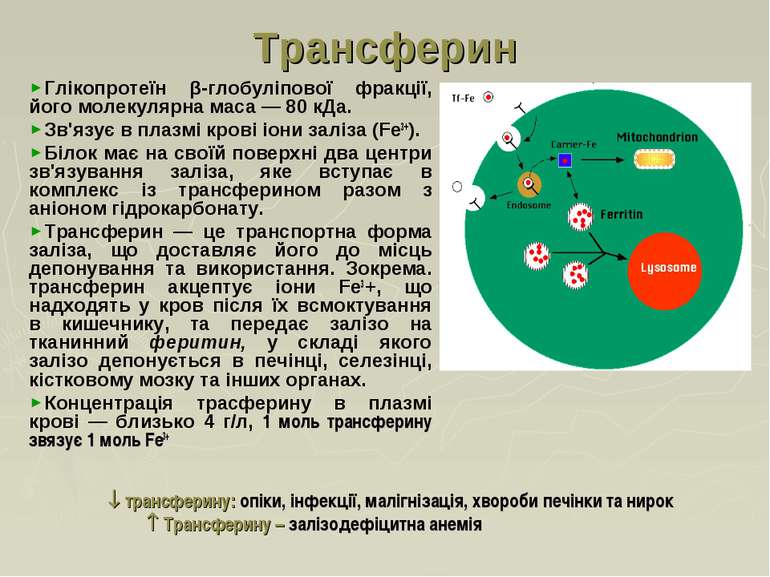
Трансферин Глікопротеїн β-глобуліпової фракції, його молекулярна маса — 80 кДа. Зв'язує в плазмі крові іони заліза (Fe3+). Білок має на своїй поверхні два центри зв'язування заліза, яке вступає в комплекс із трансферином разом з аніоном гідрокарбонату. Трансферин — це транспортна форма заліза, що доставляє його до місць депонування та використання. Зокрема. трансферин акцептує іони Fe3+, що надходять у кров після їх всмоктування в кишечнику, та передає залізо на тканинний феритин, у складі якого залізо депонується в печінці, селезінці, кістковому мозку та інших органах. Концентрація трасферину в плазмі крові — близько 4 г/л, 1 моль трансферину звязує 1 моль Fe3+ трансферину: опіки, інфекції, малігнізація, хвороби печінки та нирок Трансферину – залізодефіцитна анемія
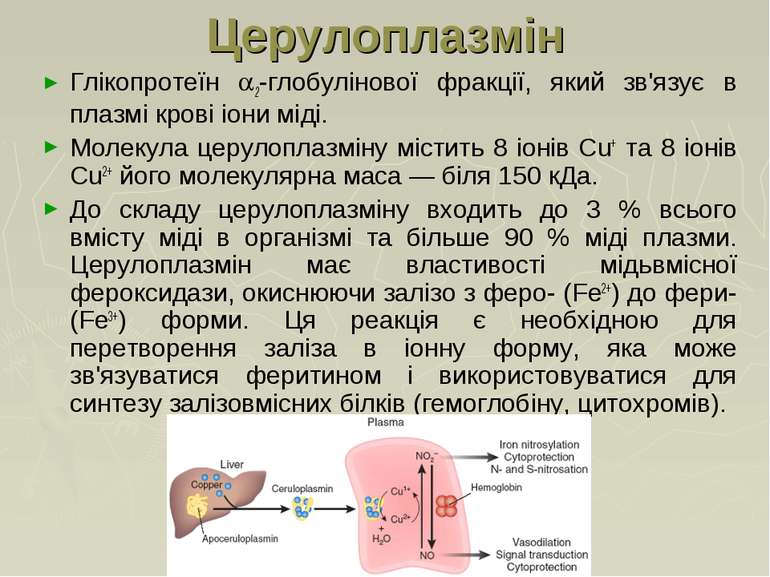
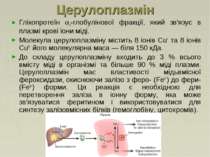
Церулоплазмін Глікопротеїн 2-глобулінової фракції, який зв'язує в плазмі крові іони міді. Молекула церулоплазміну містить 8 іонів Сu+ та 8 іонів Сu2+ його молекулярна маса — біля 150 кДа. До складу церулоплазміну входить до 3 % всього вмісту міді в організмі та більше 90 % міді плазми. Церулоплазмін має властивості мідьвмісної фероксидази, окиснюючи залізо з феро- (Fe2+) до фери- (Fe3+) форми. Ця реакція є необхідною для перетворення заліза в іонну форму, яка може зв'язуватися феритином і використовуватися для синтезу залізовмісних білків (гемоглобіну, цитохромів).
Причини зниження концентрації церулоплазміну: Зниження вмісту церулоплазміну в плазмі крові (хвороба Вільсона) призводить до виходу іонів міді з судинного русла і його накопичення протеогліканами сполучної тканини, що проявляється патологічними змінами в печінці, головному мозку (гепатоцеребральна дегенерація), рогівці тощо. Причини зростання концентрації церулоплазміну: Запалення Карциноми, лейкемія Ревматоїдний артрит
С-реактивний білок С-реактивний білок (С-реактивний протеїн — СРП) — білок, що отримав свою назву внаслідок здатності реагувати з С-полісахаридом пневмокока, утворюючи при цьому преципітати. За хімічною природою є глікопротеїном. У сироватці крові здорової людини С-реактивний білок відсутній, та з'являється при патологічних станах, що супроводжуються запаленням та некрозом тканин, зокрема він був вперше виявлений при крупозній пневмонії. Наявність СРП характерна для гострого періоду захворювань — "білок гострої фази". Визначення СРП має діагностичне значення в гострій фазі ревматизму, при інфаркті міокарда, пневмококових, стрептококових, стафілококових інфекціях.
Фібронектин Фібронектин - глікопротеїн плазми крові, який синтезується та секретується в міжклітинний простір багатьма клітинами. Фібронектин присутній на поверхні клітин, на базальних мембранах, у сполучній тканині та в крові. Фібронектин має властивості "липкого" білка, що зв'язується з вуглеводними компонентами сіалогліколіпідів (гангліозидів) на поверхні плазматичних мембран, виконуючи інтегруючу функцію у міжклітинній взаємодії. Крім цього, за рахунок утворення комплексів з колагеновими фібрилами, фібронектин відіграє значну роль в організації перицелюлярного матриксу.
Кріоглобулін Кріоглобулін — білок γ-глобулінової фракції, який, подібно до С-реактивного протеїну, відсутній у плазмі крові здорових людей і з'являється в ній при лейкозах, лімфосаркомі, мієломі, ревматизмі, цирозі печінки, нефрозах. Характерною фізико-хімічною ознакою кріоглобуліну є його розчинність при нормальній температурі тіла (37 °С) та здатність утворювати желеподібні осади при охолодженні плазми крові до 4 °С.
Ферменти плазми крові У крові присутня значна кількість ферментних білків, які поділяються на власні ферменти крові та ферменти, що потрапляють з клітин інших органів, тканин або біологічних секретів. СЕКРЕТОРНІ (власні) Синтезуються в печінці, потрапляють в кров. До цієї групи належить протеази, фосфатази, естерази, зокрема компоненти згортальної та антизгортальної систем крові, ферменти, які беруть участь в імунних процесах, активації системи комплементу та інших реакціях неспецифічної резистентності організму тощо ІНДИКАТОРНІ (клітинні) Ферменти, що за умов норми практично відсутні в крові (або наявні в слідових кількостях). Проникають в результаті ушкодження тканин. Визначення їх акт-ті має значення при патологічних ушкодженнях мембран гепатоцитів (АЛТ), міокарда (АСТ, ЛДГ, КФК) тощо. ЕКСКРЕТОРНІ Синтезуюються, головним чином, у печінці (лейцинамінопептидаза, лужна фосфатаза, тощо). За фізіологічних умов вони вивільняються з жовчю. При патології вивільнення екскреторних ферментів з жовчю зростає.
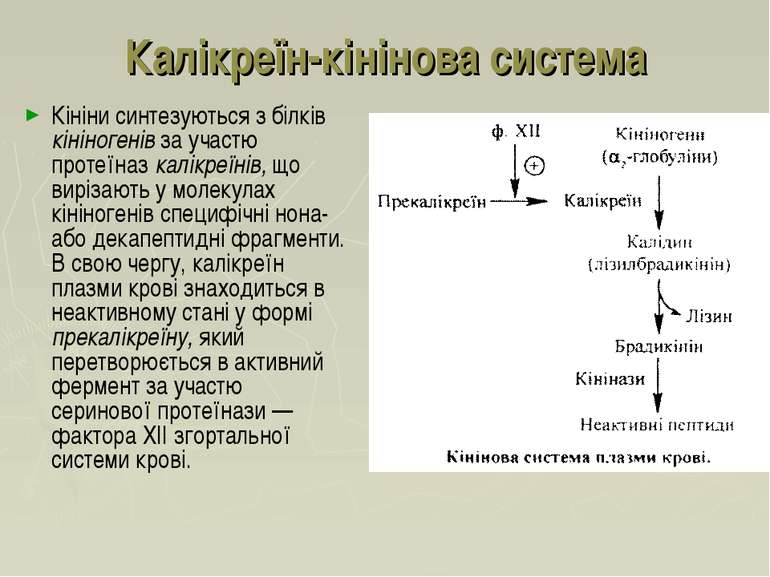
Калікреїн-кінінова система Кініни – низькомолекулярні пептиди, які містяться в крові та інших біологічних рідинах та тканинах, беручи участь у регуляції судинного тонусу (розширення судин), процесів мікроциркуляції, запаленні, алергічних реакціях. Основними кінінами крові є нонапептид брадикінін та декапептид калідин: Arg-Pro-Pro-Gly-Phe-Ser-Pro-Phe-Arg Брадикінін Lys-Arg-Pro-Pro-Gly-Phe-ser-Pro-Phe-Arg Калідин (лізилбрадикінін)
Кініни синтезуються з білків кініногенів за участю протеїназ калікреїнів, що вирізають у молекулах кініногенів специфічні нона- або декапептидні фрагменти. В свою чергу, калікреїн плазми крові знаходиться в неактивному стані у формі прекалікреїну, який перетворюється в активний фермент за участю серинової протеїнази — фактора XII згортальної системи крові. Калікреїн-кінінова система
Кініни розслаблюють гладенькі м'язи кровоносних судин, спричинюють зниження кров'яного тиску, а також розширення мікроциркуляторного русла в ділянках запалення. Брадикінін є найбільш потужною судинодилятуючою речовиною в організмі. Крім цього, внутрішньотканинне утворення кінінів у місці запалення спричинює підвищення проникності судинних стінок, почуття болю. У зв'язку з участю кінінів у патогенезі запальних процесів, в клінічній практиці широко застосовуються лікарські засоби, які є інгібіторами кініноутворення (контрикал, гордокс тощо). Період піврозпаду кінінів плазми крові незначний (20-30c). Руйнування кінінів здійснюється за рахунок дії ферментів кіназ, які розщеплюють пептидні зв’язки у молекулах кінінів, спричинюючи втрату їх біологічної активності. Калікреїн-кінінова система
Небілкові органічні сполуки плазми крові Органічний азот біохімічних сполук, який можна визначити в надосадовій рідині після осадження білків плазми або сироватки крові, отримав у клінічній біохімії назву залишкового або рест-азоту. Вміст небілкового азоту в крові становить 15-25 ммоль/л. Сечовина – 50 % Амінокислоти – 25 % Сечова кислота – 4 % Креатин – 5% Креатинін – 2,5 Аміак – 0,5% Індикан – 0,5 Нуклеотиди
Азотемії При патологічних станах рівень небілкового азоту в крові підвищується. Цей стан називається азотемією. В залежності від причин азотемія поділяється на ретенційну і продукційну. Ретенційна азотемія спостерігається при недостатньому виділенні з сечею азотовмісних продуктів при нормальному поступленні їх в кров'яне русло. Вона поділяється на ниркову і позаниркову. При нирковій ретенційній азотемії концентрація залишкового азоту в крові збільшується в результаті зниження очисної (екскреторної) функції нирок. Підвищення вмісту залишкового азоту при ретенційній нирковій азотемії проходить в основному за рахунок сечовини. Позаниркова ретенційна азотемія може виникнути в результаті важкої недостатності кровообігу, зниження артеріального тиску і зменшення ниркового кровоплину. Часто позаниркова ретенційна азотемія виникає внаслідок наявності перешкод відтоку сечі після її утворення в нирках. Продукційна азотемія спостерігається при надмірному поступленні азотовмісних речовин у кров, як наслідок підвищеного розпаду тканинних білків при запальних станах, пораненнях, опіках, кахексії тощо.
Схожі презентації
Категорії