Презентація на тему:
sensor_procaritiot
Завантажити презентацію
sensor_procaritiot
Завантажити презентаціюПрезентація по слайдам:
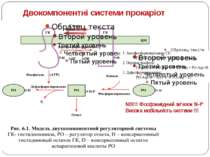
Основні компоненти сенсорних систем Мембранний чи цитоплазматичний сенсор, що детектує зміни навколишніх умов Внутрішньоклітинні посередники Ефектор – безпосередний регулятор клітинної відповіді NB!!! Мембрана – теж сенсор
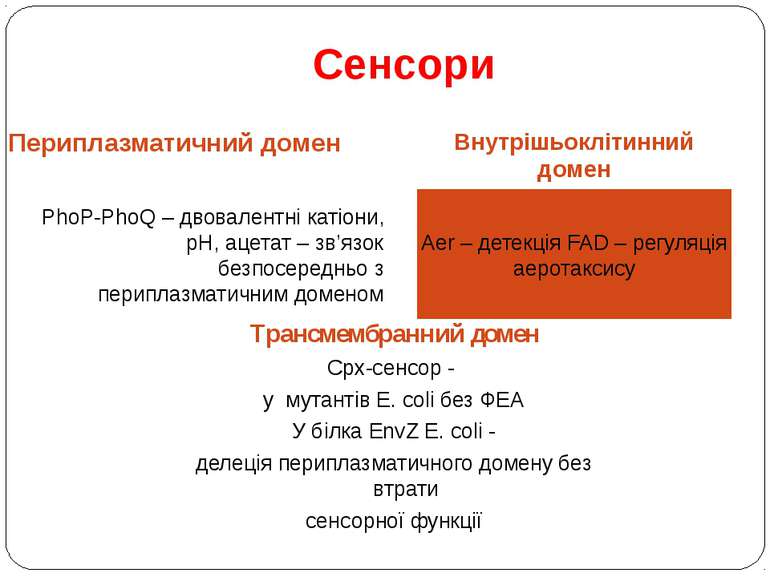
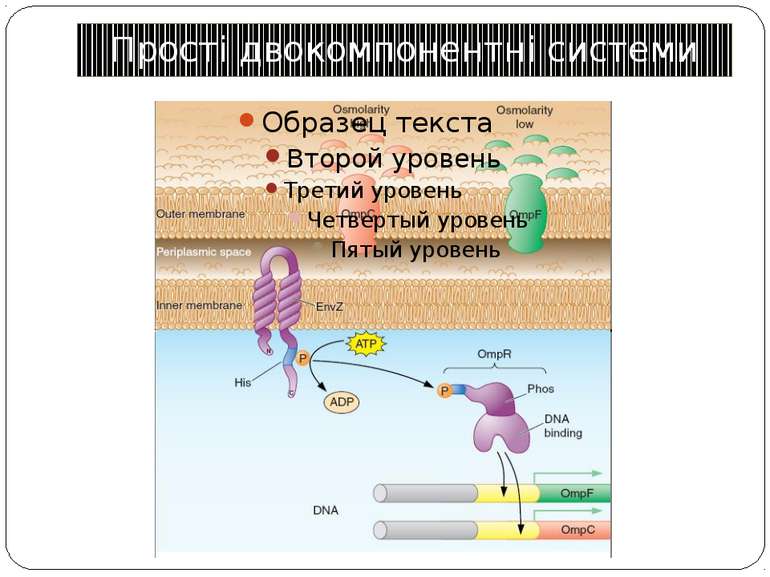
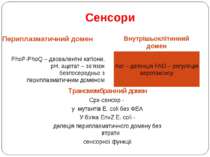
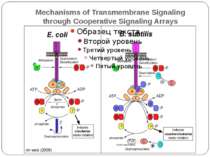
Сенсори Периплазматичний домен Внутрішьоклітинний домен PhoP-PhoQ – двовалентні катіони, рН, ацетат – зв’язок безпосередньо з периплазматичним доменом Aer – детекція FAD – регуляція аеротаксису Трансмембранний домен Cpx-сенсор - у мутантів E. coli без ФЕА У білка EnvZ E. coli - делеція периплазматичного домену без втрати сенсорної функції
Рухомість білків у мембрані Латеральна дифузія 0,1 мкм/с - 0,001 мкм/с Фактори: Текучість мембрани (визначається ліпідним складом) Належність до великого білкового комплексу – важке переміщення Власне мембранні структури – контакти, десмосоми і т.д. Заякореність на елементах цитоскелету
Ознаки вторинного посередника синтезуються клітиною у відповідь на позаклітинний стимул, тобто є задіяними у передачі сигналу від первинного месенджера; Беруть участь у процесах передачі сигналу у клітині, що їх синтезує; видаляються після закінчення дії сигналу.
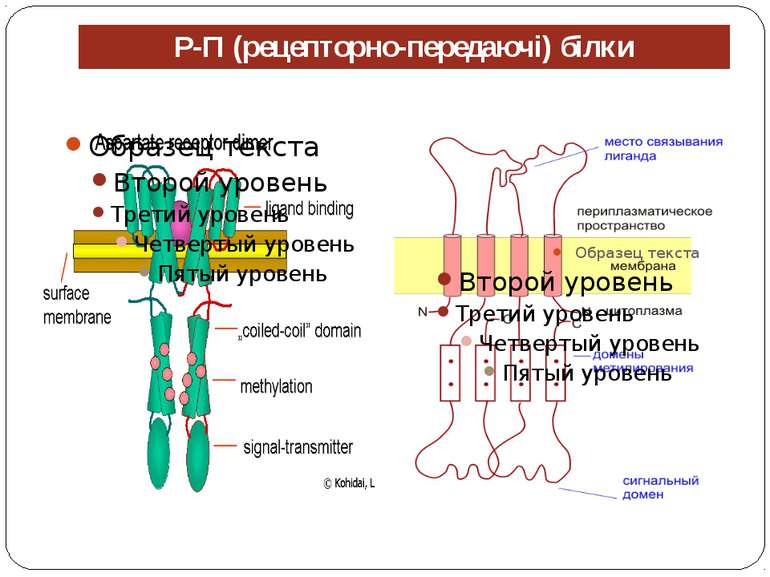
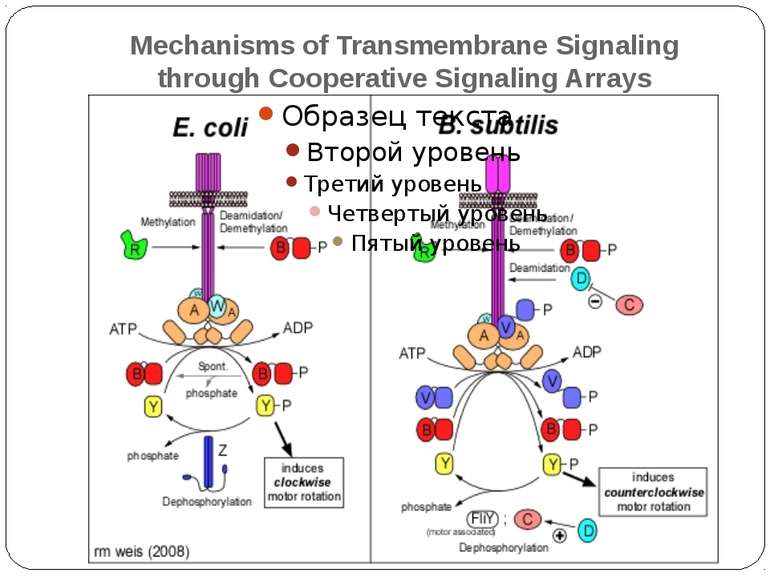
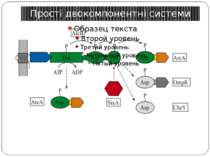
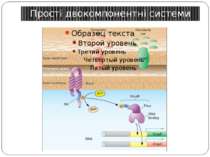
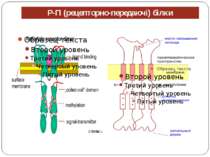
Механізм передачі сигналу Лінійна структура TM1–P–TM2–L–C, де P - периплазматичний домен-детектор C - цитоплазматичний сигнальний домен гістидинкіназа (EnvZ) або з гістидинкіназою взаємодіє (MCP рецептори хемотаксису) TM – трансмембранні сегменти L - цитоплазматичний лінкер Рецептори – гомодимери Р С ?
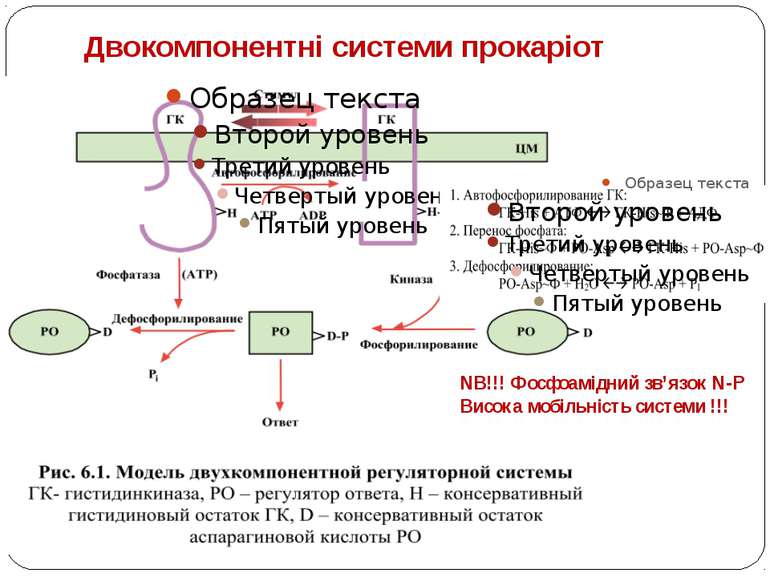
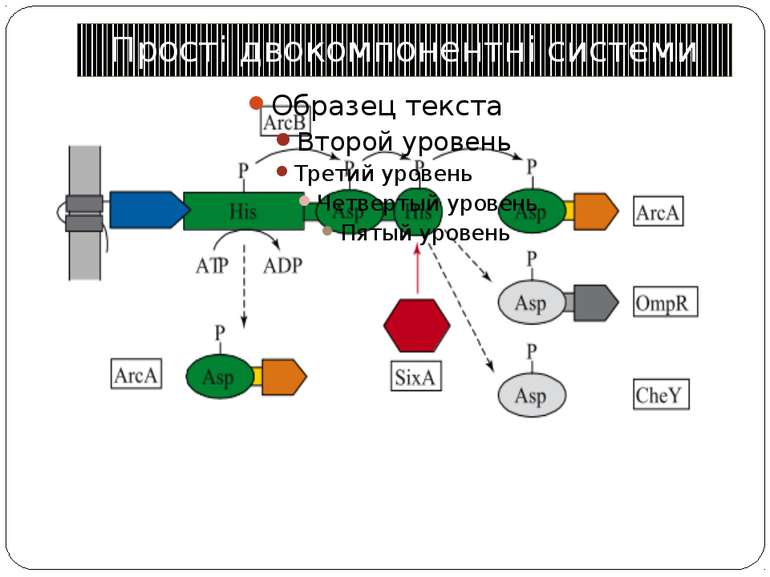
Двокомпонентні системи прокаріот NB!!! Фосфоамідний зв’язок N-P Висока мобільність системи !!!
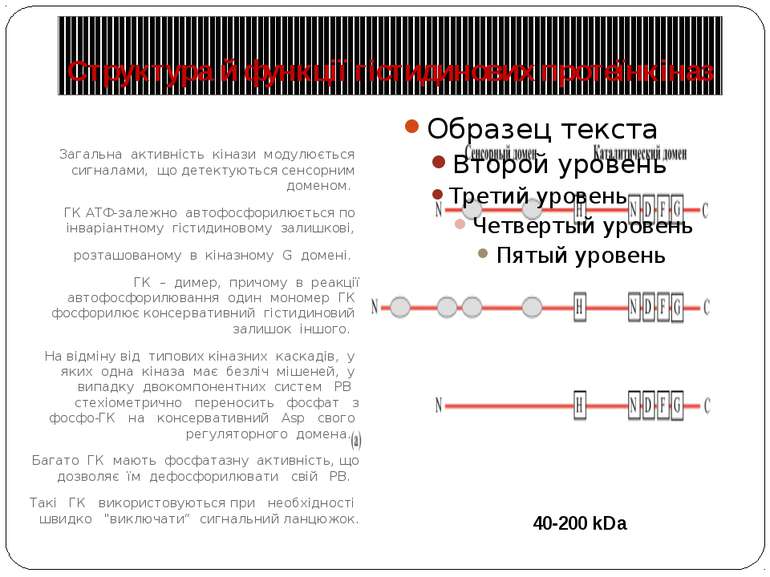
Структура й функції гістидинових протеїнкіназ Загальна активність кінази модулюється сигналами, що детектуються сенсорним доменом. ГК АТФ-залежно автофосфорилюється по інваріантному гістидиновому залишкові, розташованому в кіназному G домені. ГК – димер, причому в реакції автофосфорилювання один мономер ГК фосфорилює консервативний гістидиновий залишок іншого. На відміну від типових кіназних каскадів, у яких одна кіназа має безліч мішеней, у випадку двокомпонентних систем РВ стехіометрично переносить фосфат з фосфо-ГК на консервативний Asp свого регуляторного домена. Багато ГК мають фосфатазну активність, що дозволяє їм дефосфорилювати свій РВ. Такі ГК використовуються при необхідності швидко "виключати“ сигнальний ланцюжок. 40-200 kDa
Типи ГК “класичні” “гібридні” осмосенсор EnvZ из E. coli (трансмембранний компонент) кінази хемотаксису CheA і азотного регулоні NtrB (без трансмембранного компоненту) Множинні донорні і акцепторні сайти ArcB - регулятор активності ряду генів в анаеробних умовах - два N-кінцевих трансмембранних сегменти, за якими кіназний домен, потім домен, схожий на регуляторний і другий гістидинвмісний домен HPt-домен
Каталітичне кіназне ядро домен димеризації і АТФ/АДФ-зв’язуючий фосфотрансферний чи каталітичний домен. розмір ~350 АК Консервативний залишок гістидину в домені димеризації.
HPt-домени Виключно в складі гібридних кіназ розмір біля 120 АК містять залишок гістидину, який здатен брати участь в фосфотрансферних реакціях. HPt-домени не мають ні кіназної, ні фосфатазної активності !!!
Сенсорний домен Специфічні Н.: PAS-домени – невеликі (~100 АК), розміщені перед (ближче до N-кінця) кіназним ядром, як правило, після одної чи кількох пар трансмембранних сегментів Кофактори - гем, ФАД, ФМН і т.д.
Лінкерний домен 40-180 АК. характерний α-спіральний coiled coil мотив, в більшості випадків перед фосфорильованим гістидиновим залишком кіназного ядра. Функції: правильне розміщення мономерів в димері ГК передача сигнала від сенсорної до кіназної частини білка
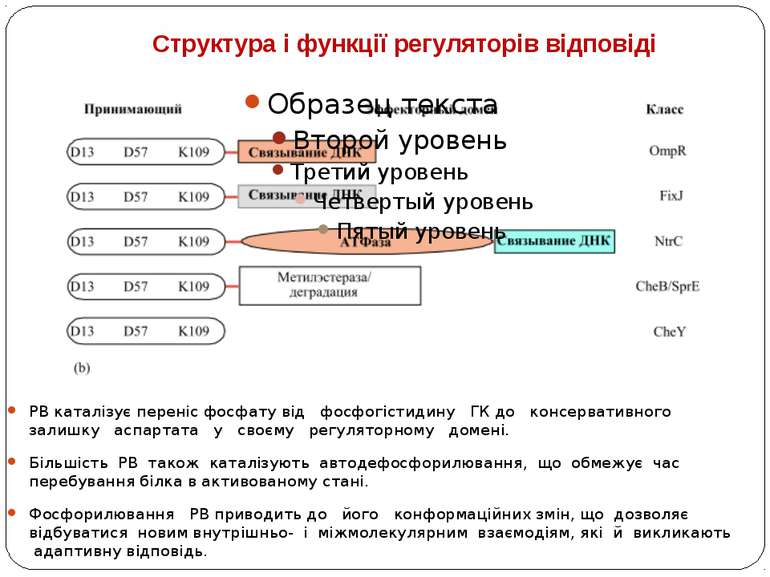
Структура і функції регуляторів відповіді РВ каталізує переніс фосфату від фосфогістидину ГК до консервативного залишку аспартата у своєму регуляторному домені. Більшість РВ також каталізують автодефосфорилювання, що обмежує час перебування білка в активованому стані. Фосфорилювання РВ приводить до його конформаційних змін, що дозволяє відбуватися новим внутрішньо- і міжмолекулярним взаємодіям, які й викликають адаптивну відповідь.
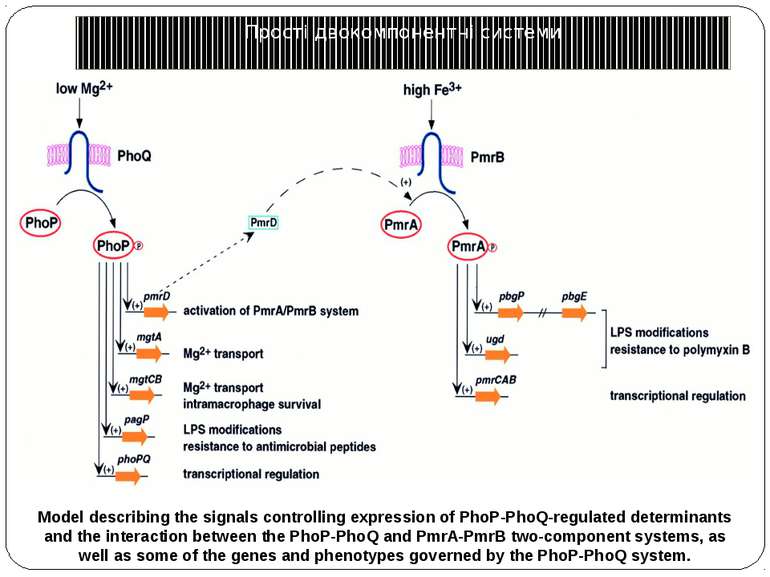
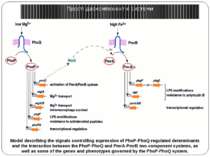
Model describing the signals controlling expression of PhoP-PhoQ-regulated determinants and the interaction between the PhoP-PhoQ and PmrA-PmrB two-component systems, as well as some of the genes and phenotypes governed by the PhoP-PhoQ system. Прості двокомпонентні системи Model describing the signals controlling expression of PhoP-PhoQ-regulated determinants and the interaction between the PhoP-PhoQ and PmrA-PmrB two-component systems, as well as some of the genes and phenotypes governed by the PhoP-PhoQ system.
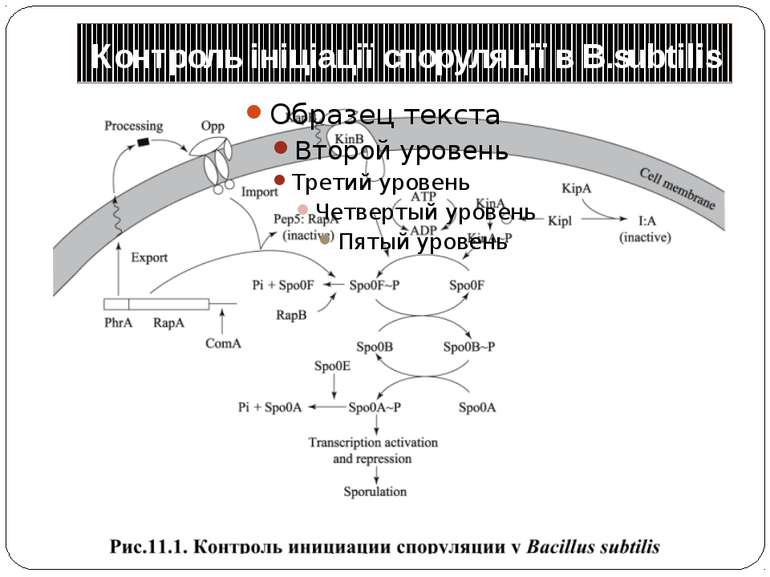
Фосфотрансляційні системи His-Asp-His-Asp 1. Автофосфорилювання ГК: ГК-His1 + АТФ ↔ ГК-His1 ~Ф + АДФ 2. 1-й переніс фосфату: ГК-His1 ~Ф + РО1 -Asp ↔ ГК-His1 + РО-Asp1 ~Ф 3. 2-й переніс фосфату: РО-Asp1 ~Ф + HPt-His2 ↔ РО-Asp1 + HPt-His2 ~Ф 4. 3-й переніс фосфату: HPt-His2 ~Ф + РО-Asp2 ↔ HPt-His2 + РО-Asp2 ~Ф 5. Дефосфорилювання: РО-Asp2 ~Ф + H2O ↔ РО-Asp2 + PI Н.: Система контролю споруляції B. subtilis
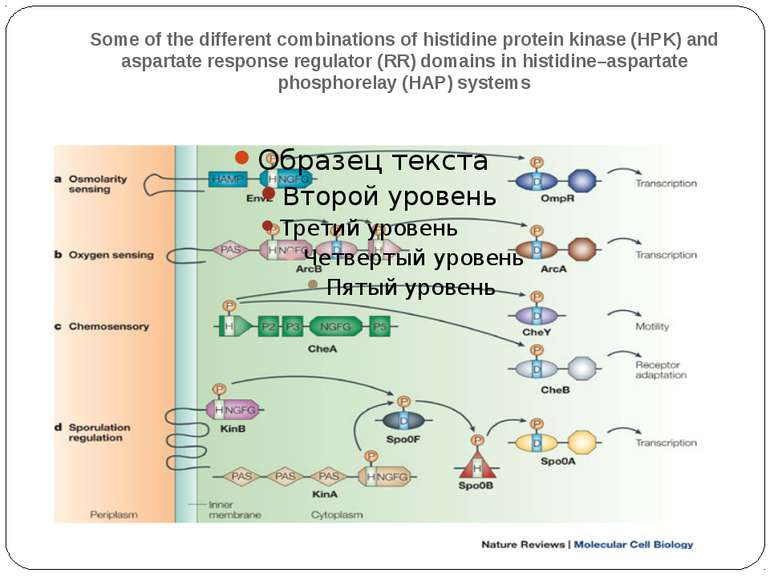
Some of the different combinations of histidine protein kinase (HPK) and aspartate response regulator (RR) domains in histidine–aspartate phosphorelay (HAP) systems a | The EnvZ/OmpR pathway of Escherichia coli, which is involved in regulating the expression of the two outer-membrane porins OmpF and OmpC. A membrane-bound HPK (EnvZ) controls the activity of the RR OmpR in response to changes in osmolarity. b | The complex ArcB–ArcA HAP system of E. coli. The membrane-bound HPK ArcB senses changes in the redox state of components of the respiratory electron-transport chain through its PAS (PER, ARNT, SIM) domain. The phosphoryl group is then passed from the conserved His in the ArcB kinase domain to a fused RR domain, then to a fused histidine-containing phosphotransfer (HPt) domain and finally to a DNA-binding RR ArcA. ArcA regulates microaerophilic gene expression. c | The chemosensory pathway of E. coli. The soluble HPK chemotaxis protein (Che)A has five domains per monomer that are designated P1–P5 from the N terminus to the C terminus. CheA senses changes through transmembrane chemoreceptors, which induce the trans-autophosphorylation of dimeric CheA on a His residue of the HPt domain. Two RRs compete for this phosphoryl group: CheY, a single-domain, motor-binding protein, which controls flagellar motor switching, and CheB, which controls the adaptation of the chemoreceptors. d | Part of the complex system that regulates sporulation in Bacillus subtilis. A single-domain RR, Spo0F, is regulated by two HPKs, one of which has numerous transmembrane domains (KinB), the other of which is soluble with numerous PAS domains (KinA). Spo0F indirectly phosphorylates a DNA-binding RR, Spo0A, by way of a His residue in Spo0B. Throughout this figure, light-green rectangles highlight conserved, phosphorylatable His residues, light-blue rectangles highlight conserved, phosphorylatable Asp residues, and orange circles highlight phosphoryl (P) groups. NGFG represents the kinase domain and, with the exception of CheA, the conserved His residue that precedes the kinase domain is contained within the dimerization domain. Despite being dimeric in nature, HPKs are shown here as monomers for simplicity, and the HAMP domain ('histidine kinases, adenylyl cyclases, methyl-binding proteins and phosphatases' domain) is a linker domain.
Регуляторні механізми Регуляція активності ГК Регуляція автокіназної і РО-фосфатазної активності Регуляція дефосфорилювання РВ Н.: система споруляції бацил має набір строго регульованих фосфатаз (RapA, RapB, RapE), які дефосфорилюють Spo0F, і ще одну фосфатазу, яка дефосфорилює Spo0A. в системі хемотаксису допоміжний білок CheZ олігомеризується з фосфо-CheY і стимулює його дефосфорилювання. Інші способи регуляції
Інші способи регуляції Регуляція переносу фосфату Н.: у гібридній кіназі VirA з A. Tumefaciens карбоксикінцевий Asp-вмісний домен впливає на автокіназну активність кіназного ядра шляхом фізичної взаємодії з сайтом автофосфорилювання. Фосфорилювання ГК більше одного РВ. Конкуренція за фосфат може впливати на активацію різних гілок сигнального шляху. Контроль експресії гену РВ. Н.: Двокомпонентні системи, які регулюють транскрипцію, авторегулюються. В таких системах фосфо-РВ діє як активатор чи репресор оперону, який кодує ГК і РВ.
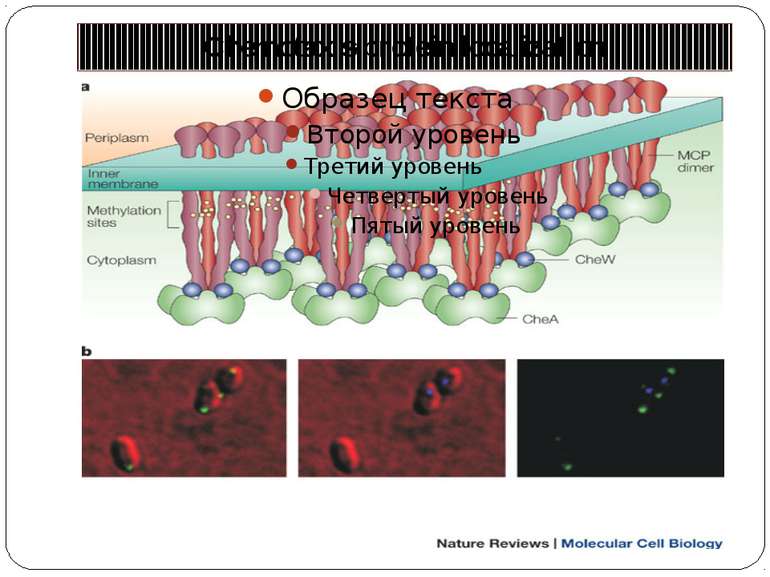
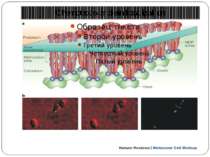
Chemotaxis-protein localization a | The possible pattern of interaction between different components of the chemosensory pathway at the poles of bacterial cells, which produces signalling clusters. The clusters are shown as being formed of mixed trimers of methyl-accepting chemotaxis protein (MCP) homodimers. These trimers might interact laterally through changes in their packing, as well as through alterations in their interactions with, and between, the chemotaxis protein (Che)W and CheA. The stoichiometry could be three MCP dimers to two CheW monomers to one CheA dimer, as is shown in the figure, but the exact stoichiometry is still unclear. The rough positions of the methylation sites are highlighted in yellow. b | The localization of chemotaxis proteins in vivo. Rhodobacter sphaeroides has two chemosensory pathways. Components of one pathway, which includes CheW3, localize to a polar cluster (green labelling in the first and third panels) that contains the transmembrane MCPs, whereas components of the other pathway, which includes CheW4, localize to a cytoplasmic cluster (purple labelling in the second and third panels) that contains the transducer-like proteins. The physical and biochemical separation of the components of these two signalling pathways (see the third, merged panel) might be important for preventing crosstalk between closely related proteins in vivo.
Типи атрактантів Моносахариди та пептиди Молекула аттрактанту может взаємодіяти зі зв’язуючим білком (ЗБ) в периплазматичному просторі, викликаючи в останньому конформаційні зміни, що роблять можливою його взаємодію з тим чи іншим трансмембраним білком Н.: галактоза-зв’язуючий білок (ГЗБ), рибоза-зв’язуючий білок (РЗБ), мальтоза-зв’язуючий білок (МЗБ) і дипептид-зв’язуючий білок (ДЗБ) . Амінокислоти аттрактант взаємодіє безпосередньо з трансмембранним білком.
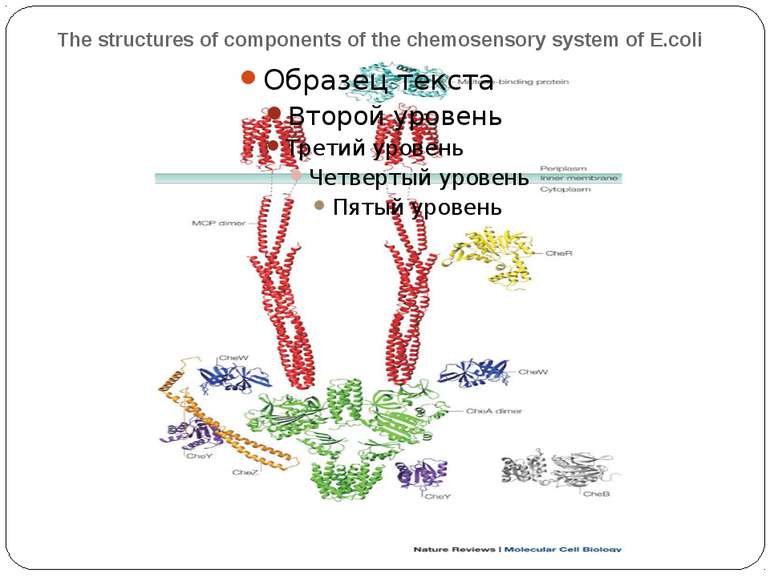
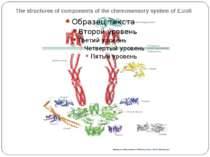
The structures of components of the chemosensory system of E.coli The figure shows the structures of the components of the chemosensory system in the same stoichiometry and localization as is shown in Fig. 2 — that is, two methyl-accepting chemotaxis protein (MCP) dimers are shown interacting with two chemotaxis protein (Che)W monomers and a CheA dimer, and CheY, CheB and CheR are all depicted as monomers. The relevant Protein Data Bank accession numbers are: maltose-binding protein (1ANF); MCP periplasmic domain (1WAT) and cytoplasmic domain (1QU7); the CheA P1 domain (1I5N), P2 domain (1EAY) and P3–P5 domains (1B3Q); the CheW averaged NMR structure (1KOS); CheY (1EHC); CheR (1BC5); CheB (1A2O); and CheZ with phosphorylated CheY bound (1KMI). The figure is a graphical representation and is not meant to imply that the domains or proteins interact in the manner depicted or that their orientations are as shown. The dashed lines represent the transmembrane domains and the HAMP domains ('histidine kinases, adenylyl cyclases, methyl-binding proteins and phosphatases' domains), for which there are, as yet, no structures. This figure was prepared using the program MOLMOL143.
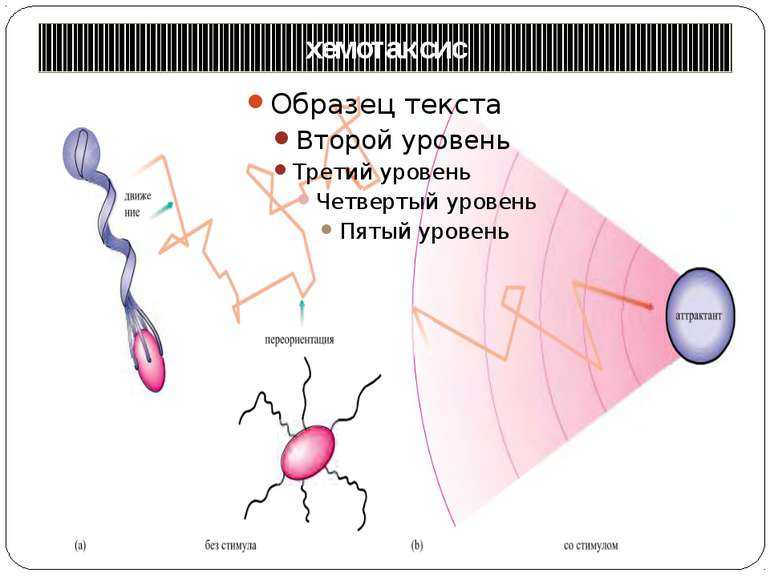
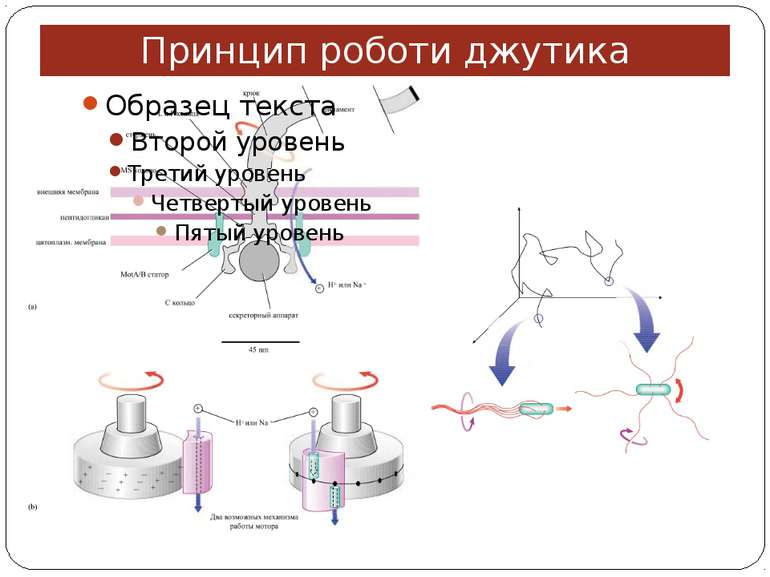
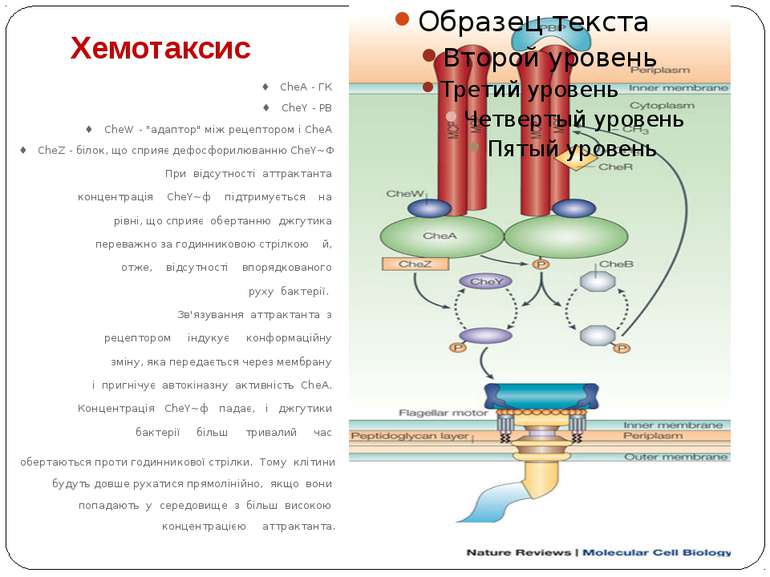
Хемотаксис ♦ CheA - ГК ♦ CheY - РВ ♦ CheW - "адаптор" між рецептором і CheA ♦ CheZ - білок, що сприяє дефосфорилюванню CheY~Ф При відсутності аттрактанта концентрація CheY~ф підтримується на рівні, що сприяє обертанню джгутика переважно за годинниковою стрілкою й, отже, відсутності впорядкованого руху бактерії. Зв'язування аттрактанта з рецептором індукує конформаційну зміну, яка передається через мембрану і пригнічує автокіназну активність CheA. Концентрація CheY~ф падає, і джгутики бактерії більш тривалий час обертаються проти годинникової стрілки. Тому клітини будуть довше рухатися прямолінійно, якщо вони попадають у середовище з більш високою концентрацією аттрактанта.
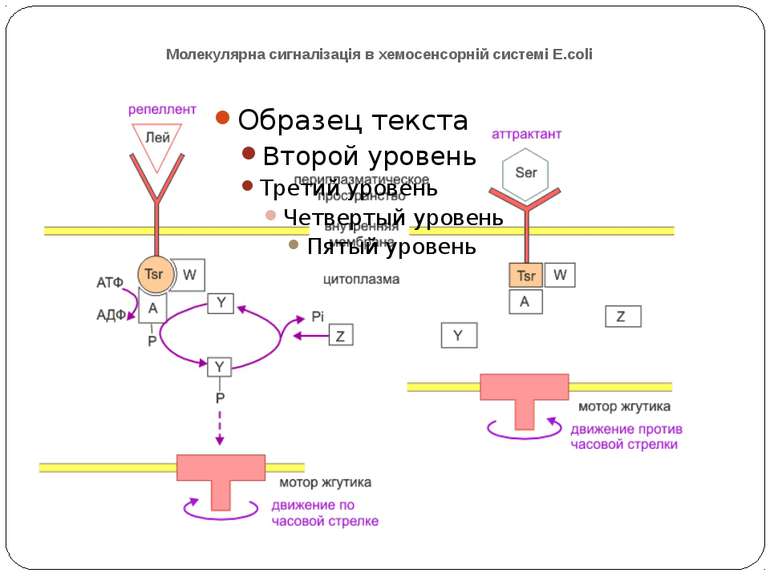
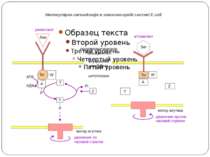
Молекулярна сигналізація в хемосенсорній системі E.coli (А) Р-П-белок Tsr связывается с молекулой репеллента (Лейцин (Лей)). CheW и CheA активируются, CheA присоединяет фосфат от АТФ и переносит его на CheY. CheY диффундирует к мотору жгутика и вызывает его вращение по часовой стрелке и хаотическое движение бактерии. CheY затем дефософорилируется белком CheZ. (Б) Р-П-белок Tsr связывается с аттрактантом (Серин (Сер)). Последующие конформационные изменения инактивируют CheA и CheW, так что CheY остается нефосфорилированным и, соответственно, неактивированным. Жгутик восстанавливает движение против часовой стрелки, и бактерия движется прямолинейно. A - CheA, W - CheW, Y - CheY, Z - CheZ.
Сенсорна адаптація хемочутливості у E.coli Сенсорна адаптація відбувається в результаті метилювання Р-П білку, якщо бактерія виявляється в умовах незмінної концентрації аттрактанта. Тому, Р-П-білки називають МАХ (білками метил-адаптуючого хемотаксису).
Схожі презентації
Категорії