Презентація на тему:
Sensor_OX
Завантажити презентацію
Sensor_OX
Завантажити презентаціюПрезентація по слайдам:
NB !!! У деяких рослин при повному пригніченні мітохондріального дихання споживання О2 знижується лише на 5-30% В печінці in situ утворюється в 2 рази більше H2O2, ніж у її ізольованих субклітинних фракціях Мінімально ушкоджені органи й тканини використовують у відносному спокої до 10-15% споживаного організмом кисню для синтезу його активних форм ROS виділяються клітинами, що не беруть участі в патогенезі та не відіграють фагоцитарних функцій
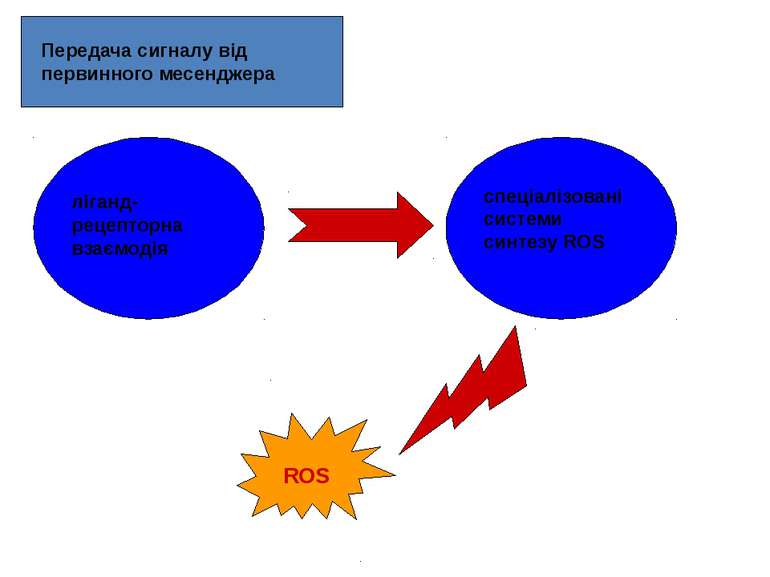
Як потенційні сигнальні молекули, ROS повинні: синтезуватись клітиною у відповідь на позаклітинний стимул, тобто бути задіяними у передачі сигналу від первинного месенджера; брати участь у процесах передачі сигналу у клітині, що їх синтезує; видалятися після закінчення дії сигналу.
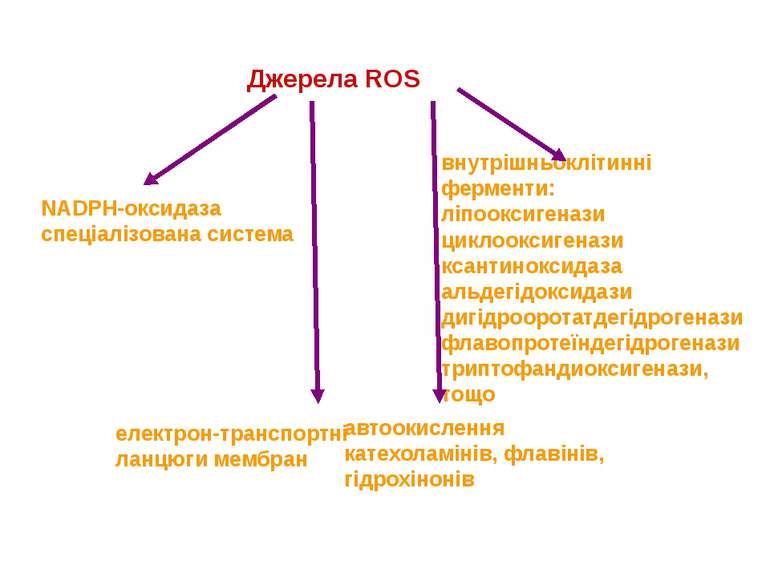
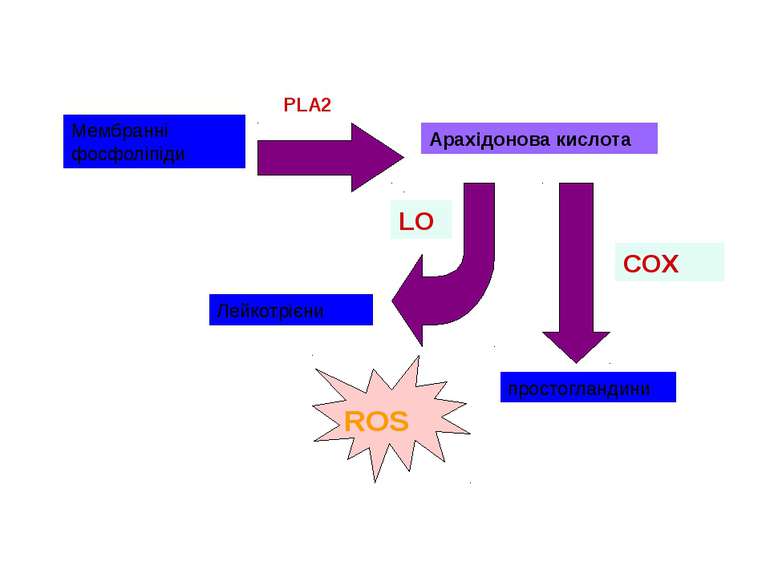
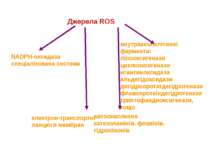
Джерела ROS NADPH-оксидаза спеціалізована система внутрішньоклітинні ферменти: ліпооксигенази циклооксигенази ксантиноксидаза альдегідоксидази дигідрооротатдегідрогенази флавопротеїндегідрогенази триптофандиоксигенази, тощо електрон-транспортні ланцюги мембран автоокислення катехоламінів, флавінів, гідрохінонів
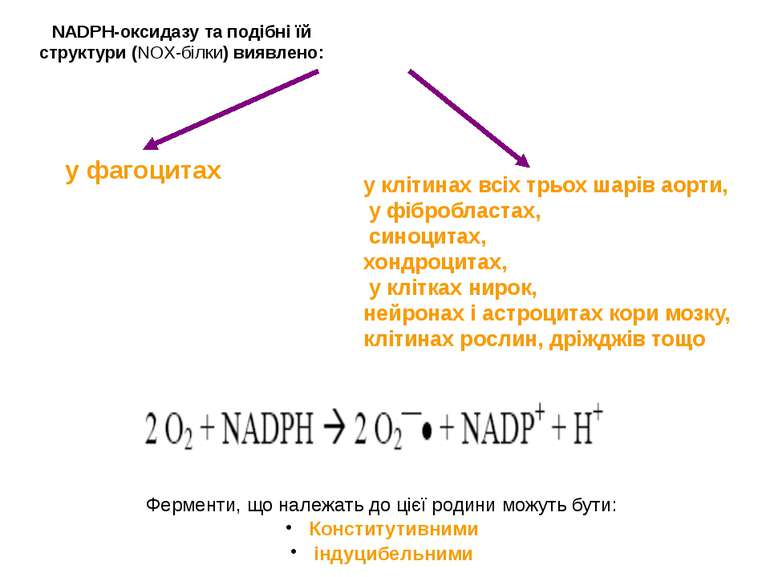
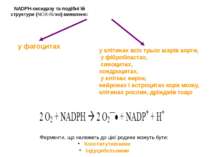
NADPH-оксидазу та подібні їй структури (NOX-білки) виявлено: Ферменти, що належать до цієї родини можуть бути: Конститутивними індуцибельними у клітинах всіх трьох шарів аорти, у фібробластах, синоцитах, хондроцитах, у клітках нирок, нейронах і астроцитах кори мозку, клітинах рослин, дріжджів тощо у фагоцитах
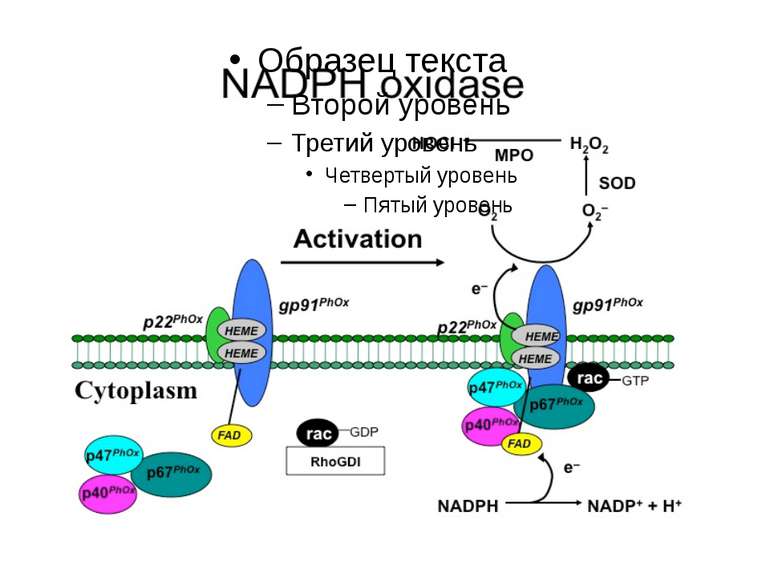
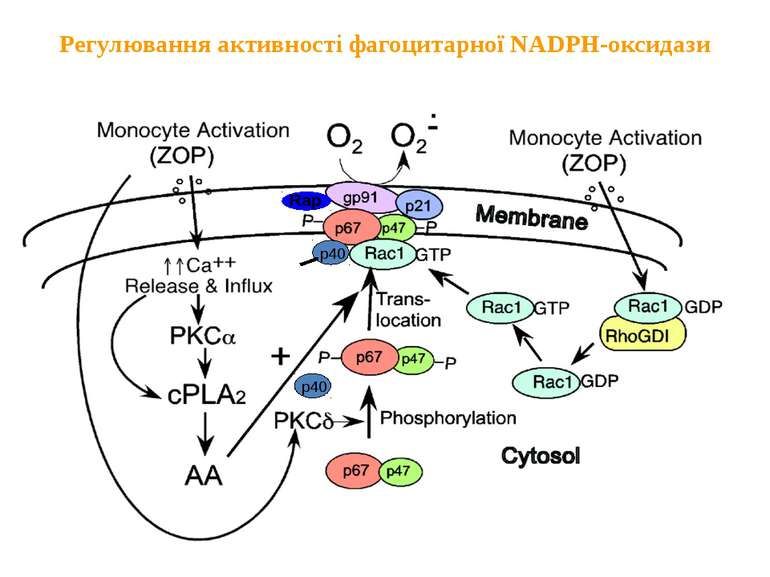
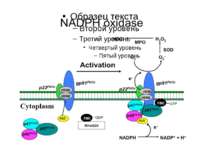
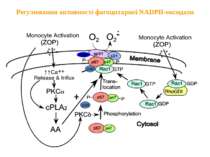
Регулювання активності фагоцитарної NADPH-оксидази Активація моноцитів Активація моноцитів мембрана Вивільнення і надходження фосфорилювання цитозоль 2
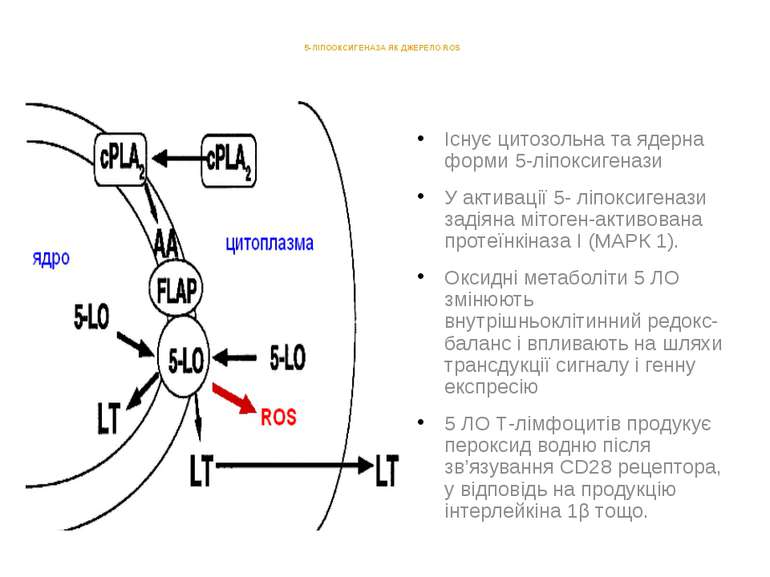
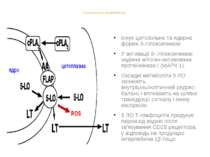
5-ЛІПООКСИГЕНАЗА ЯК ДЖЕРЕЛО ROS Існує цитозольна та ядерна форми 5-ліпоксигенази У активації 5- ліпоксигенази задіяна мітоген-активована протеїнкіназа I (МАРК 1). Оксидні метаболіти 5 ЛО змінюють внутрішньоклітинний редокс-баланс і впливають на шляхи трансдукції сигналу і генну експресію 5 ЛО Т-лімфоцитів продукує пероксид водню після зв’язування CD28 рецептора, у відповідь на продукцію інтерлейкіна 1β тощо.
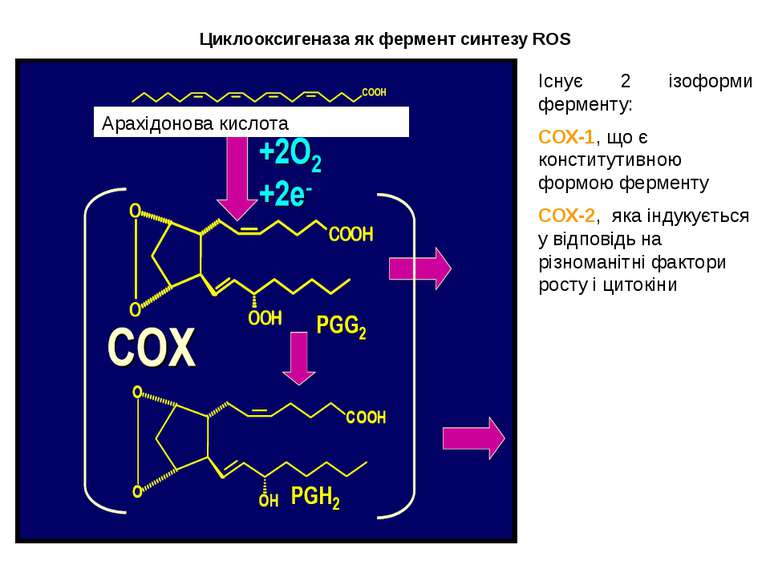
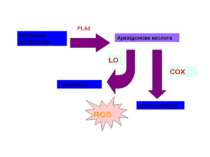
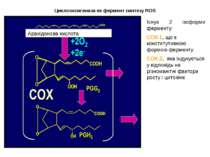
Циклооксигеназа як фермент синтезу ROS ROS Існує 2 ізоформи ферменту: СОХ-1, що є конститутивною формою ферменту СОХ-2, яка індукується у відповідь на різноманітні фактори росту і цитокіни Арахідонова кислота
Ксантиноксидаза як фермент синтезу ROS каталізує кінцеву стадію окислення пуринів, а також окисну трансформацію птерідинів і деяких аліфатичних та ароматичних альдегідів Ксантиноксидаза містить I молібденовий центр, два залізо-сірчаних центри й I FAD. ксантин + H2O + O2 = сечова кислота + H2O2 фермент може також синтезувати NO, що, можливо, показує подвійну роль ферменту у передачі сигналів клітини
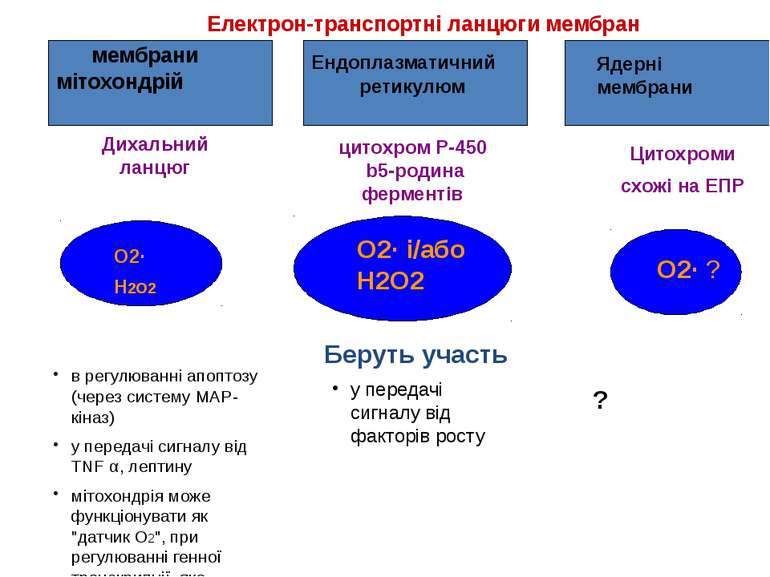
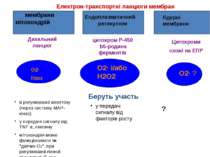
Електрон-транспортні ланцюги мембран Дихальний ланцюг цитохром P-450 b5-родина ферментів Цитохроми схожі на ЕПР Беруть участь O2· H2O2 мембрани мітохондрій Ендоплазматичний ретикулюм Ядерні мембрани O2· і/або H2O2 O2· ? в регулюванні апоптозу (через систему MAP-кіназ) у передачі сигналу від TNF α, лептину мітохондрія може функціонувати як "датчик O2", при регулюванні генної транскрипції, яка викликана гіпоксією у передачі сигналу від факторів росту ?
РОЛЬ ROS В РЕЦЕПТОР-ОПОСЕРЕДКОВАНИХ ШЛЯХАХ ПЕРЕДАЧІ СИГНАЛІВ Основні ліганди, що призводять до синтезу ROS: гормони (інсулін, ангіотензин, паратиреоїдний гормон, вітамін Д3); цитокіни (інтерлейкін, інтерферон, тромбоцитарний фактор росту, епідермальний фактор росту (EGF), трансформуючий фактор росту b -1, фактор некрозу пухлин (TNF), фактор росту нервів (NGF), епідермальний фактор росту, фактор росту тромбоцитів (PDGF) тощо); деякі нейромедіатори. Первинні месенджери здійснюють регуляцію рівня ROS у клітині за рахунок активації процесів їхньої генерації, з одного боку, і зниження активності окремих ланок АОЗ, з іншого.
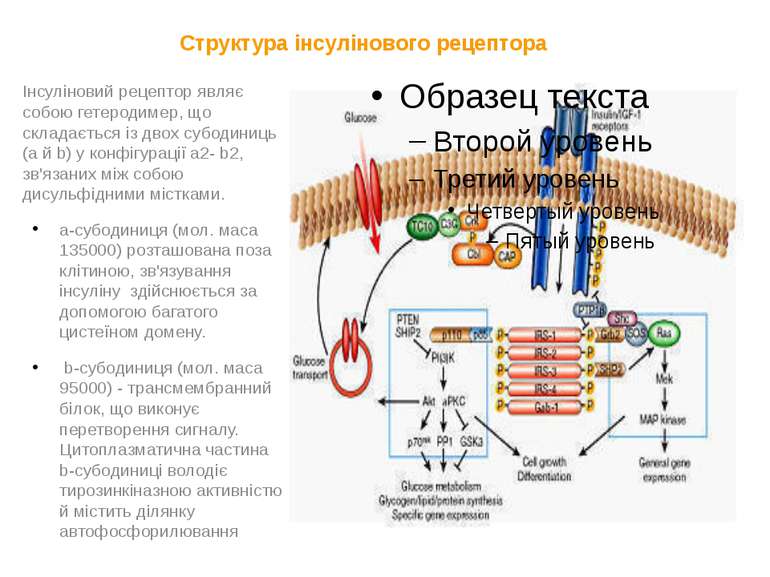
Структура інсулінового рецептора Інсуліновий рецептор являє собою гетеродимер, що складається із двох субодиниць (a й b) у конфігурації a2- b2, зв'язаних між собою дисульфідними містками. a-субодиниця (мол. маса 135000) розташована поза клітиною, зв'язування інсуліну здійснюється за допомогою багатого цистеїном домену. b-субодиниця (мол. маса 95000) - трансмембранний білок, що виконує перетворення сигналу. Цитоплазматична частина b-субодиниці володіє тирозинкіназною активністю й містить ділянку автофосфорилювання
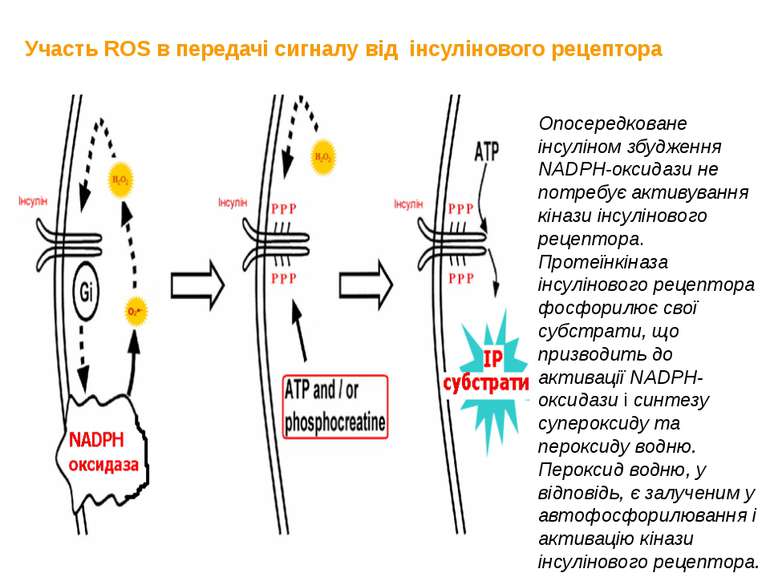
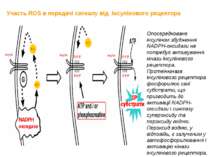
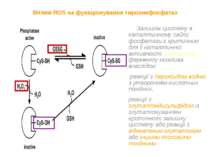
Участь ROS в передачі сигналу від інсулінового рецептора Опосередковане інсуліном збудження NADPH-оксидази не потребує активування кінази інсулінового рецептора. Протеїнкіназа інсулінового рецептора фосфорилює свої субстрати, що призводить до активації NADPH-оксидази і синтезу супероксиду та пероксиду водню. Пероксид водню, у відповідь, є залученим у автофосфорилювання і активацію кінази інсулінового рецептора.
За відсутності інсуліна високі концентрації пероксиду водню та тіол-реактивних агентів викликали інсуліноподібні сигнали. У основі механізму зазначеного явища лежить: інгібування активності тирозинових фосфатаз високими концентраціями пероксиду водню та тіол-реактивних агентів; ROS – опосередковані конфірмаційні зміни активного центру кінази інсулінового рецептора.
Механізм автофосфорилювання ІР за участю АФК Модифікація пероксидом водню будь-якого з 4-х залишків цистеїну 1056, 1138, 1234, і 1245 призводить к структурних змін, внаслідок яких Asp 1132 і Tyr-1162 каталітичної ділянки виявляються доступними для відмінних від звичайних донорів фосфату. Tyr-1158 вступає в тісний контакт з Asp 1083, використовуючи його (а не Asp 1132) як каталітичну амінокислоту для автофосфорилювання. До подібних конфірмаційних змін призводить також прооксидантне зростання тіол-глутатіонового співвідношення. Вважається, що очевидна надлишковість функціонально важливих залишків цистеїну в різних областях білка інсулінового рецептора, ймовірно, зумовлена еволюційно, з метою збільшення можливості регулюючих взаємодій з ROS.
ROS відіграють корегуляторну роль у активації інсулінового рецептора. посилюючи сигнали інсуліна і забезпечуючи позитивний зворотний зв’язок Активація синтезу ROS через інсуліновий рецептор і редокс-чутливість кінази інсулінового рецептора зумовлює кооперативність між інсуліновим рецептором і іншими мембранними рецепторами
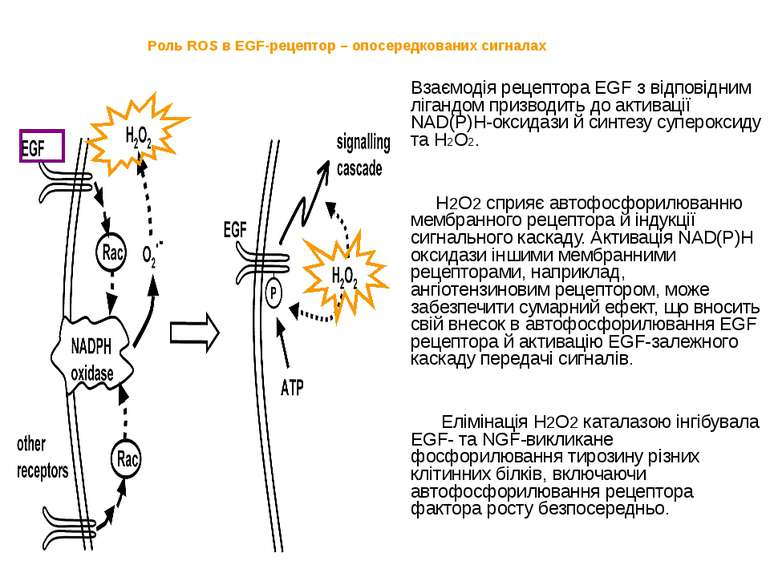
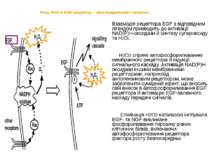
Роль ROS в EGF-рецептор – опосередкованих сигналах Взаємодія рецептора EGF з відповідним лігандом призводить до активації NAD(P)H-оксидази й синтезу супероксиду та Н2О2. Н2О2 сприяє автофосфорилюванню мембранного рецептора й індукції сигнального каскаду. Активація NAD(P)H оксидази іншими мембранними рецепторами, наприклад, ангіотензиновим рецептором, може забезпечити сумарний ефект, що вносить свій внесок в автофосфорилювання EGF рецептора й активацію EGF-залежного каскаду передачі сигналів. Елімінація Н2О2 каталазою інгібувала EGF- та NGF-викликане фосфорилювання тирозину різних клітинних білків, включаючи автофосфорилювання рецептора фактора росту безпосередньо. Взаимодействие рецептора EGF или других связанных мембранных рецепторов с соответствующими лигандами приводит к активации NAD(P)H оксидазы и продукции суперокиси и перекиси водорода. Перекись водорода, в свою очередь, способствует автофосфориляции мембранного рецептора и индукции сигнального каскада. Активация NAD(P)H оксидазы другими мембранными рецепторами, типа ангиотензинового рецептора может обеспечить суммарный эффект, который вносит свой вклад в автофосфориляцию EGF рецептора и в активацию EGF-зависимого каскада передачи сигналов.
У зв'язку з існуванням багатьох факторів росту, цитокінів, або інших лігандів, які викликають ендогенну продукцію ROS, існує велика ймовірність, що редокс-залежність процесу трансдукції сигналу може сприяти синергічним взаємодіям між різними типами мембранних рецепторів Ця фізіологічно вигідна кооперативність між різними рецепторами, можливо, була головною рушійною силою у філогенетичному розвитку досить складного механізму редокс-регулювання Окрім NADPH-оксидази, у ROS-залежну передачу сигналів від цитокінів можуть бути залучені інші ферменти синтезу. Так, IL-1 активує фактор транскрипції NF-kВ 3-ма різними способами: через синтез ROS 5-LO у лімфоїдних клітинах; через ROS- і 5-LO – незалежний шлях в епітеліоцитах; і через синтез ROS NADPH-оксидазою в моноцитах.
БІОХІМІЧНІ МЕХАНІЗМИ ДІЇ ROS Окисні модифікації білків Зміни внутрішньоклітинного редокс-статусу
Зміни внутрішньоклітинного редокс-статусу У клітині зберігається високе редокс-співвідношення GSH і TRX, що підтримується активністю GSH і TRX редуктаз редокс-сигнали регулююються альтераціями як загального рівня GSH так і змінами співвідношення його окисленої і відновленої форм. TRX - невеликий багатофункціональний білок з 2-ма редокс-активними цистеїнами в активному сайті (Cys-Gly-Pro-Cys). Згідно останніх досліджень, TRX може регулювати активність деяких білків безпосередньо зв'язуючись з ними. Наприклад: TRX інгібує ASK-1, зв'язуючись с його термінальною областю. Показано пряму асоціацію між TRX і глюкокортикоїдним рецептором. TRX полегшує зв’язування з ДНК і факторів транскрипції - NF-кB, p53 і т.п через активацію Ref-1.
Окисна модифікація білків як потенційний механізм для ROS-опосередкованої передачі сигналів A: При EGF-опосередкованій мітогенній передачі сигналів - ROS безпосередньо інактивують PTP-1B шляхом зворотного окислення його каталітичної ділянки (Cys215). B: інгібування тіолтрансфераз шляхом S-глутатіонування сульфгідрильної групи у активному центрі; редокс-регулювання зв'язування c-Jun з ДНК. C: активація білка OxyR. Відновлення критичних цистеїнових залишків в деяких факторах транскрипції, спричинене дисульфід-відновлюючими системами (типу тіоредоксина) і redox factor-1 (Ref-1), викликає їх прикріплення до ДНК і трансактивацію; D: редокс-активація протеїнкінази (PK) внаслідок її димеризації або димеризації її регулюючого інгібуючого білку (RP), що веде до його дисоціації та наступної активації PK E: білки, що містять метали змінної валентності можуть бути окислені ROS, синтезованими оксидазами змішаної функції (MFO), які "призначені" для убіквітинування і наступної деградації протеазами. Це – потенційний механізм для ROS – залежної альтерації білкової стабільності.
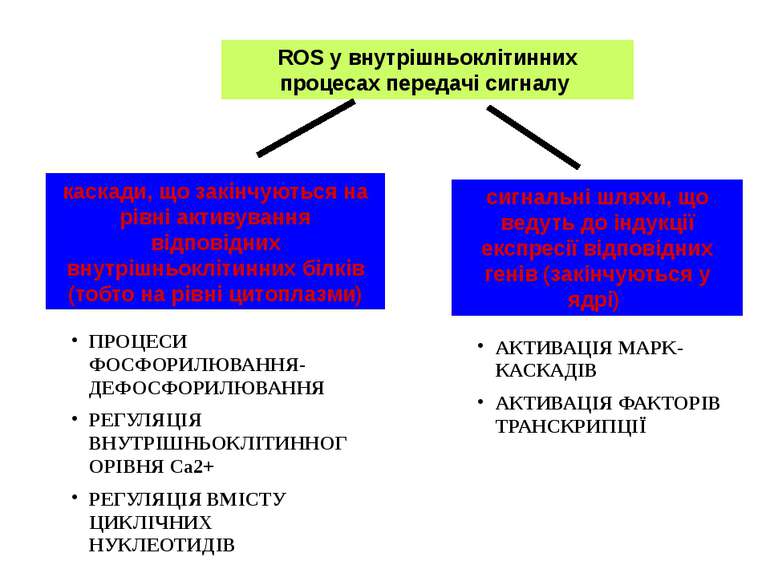
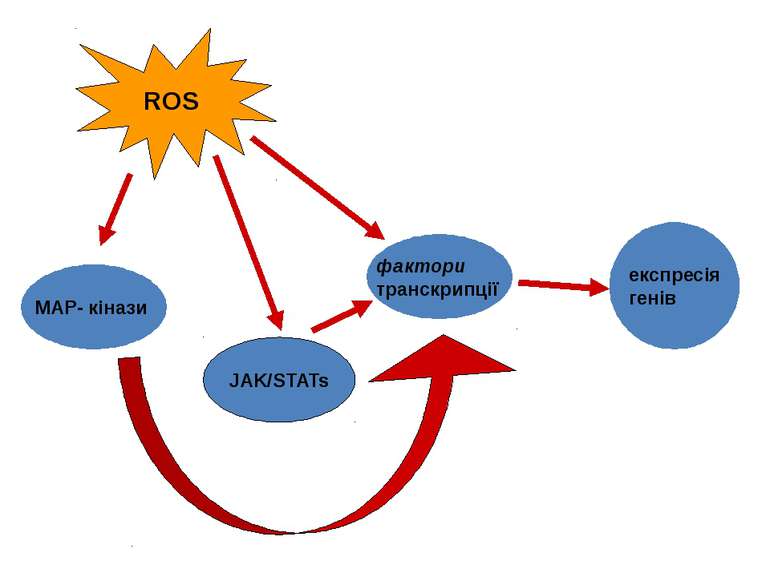
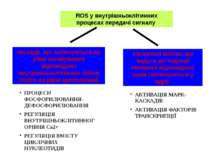
ROS у внутрішньоклітинних процесах передачі сигналу каскади, що закінчуються на рівні активування відповідних внутрішньоклітинних білків (тобто на рівні цитоплазми) сигнальні шляхи, що ведуть до індукції експресії відповідних генів (закінчуються у ядрі) ПРОЦЕСИ ФОСФОРИЛЮВАННЯ-ДЕФОСФОРИЛЮВАННЯ РЕГУЛЯЦІЯ ВНУТРІШНЬОКЛІТИННОГОРІВНЯ Cа2+ РЕГУЛЯЦІЯ ВМІСТУ ЦИКЛІЧНИХ НУКЛЕОТИДІВ АКТИВАЦІЯ MAPK-КАСКАДІВ АКТИВАЦІЯ ФАКТОРІВ ТРАНСКРИПЦІЇ
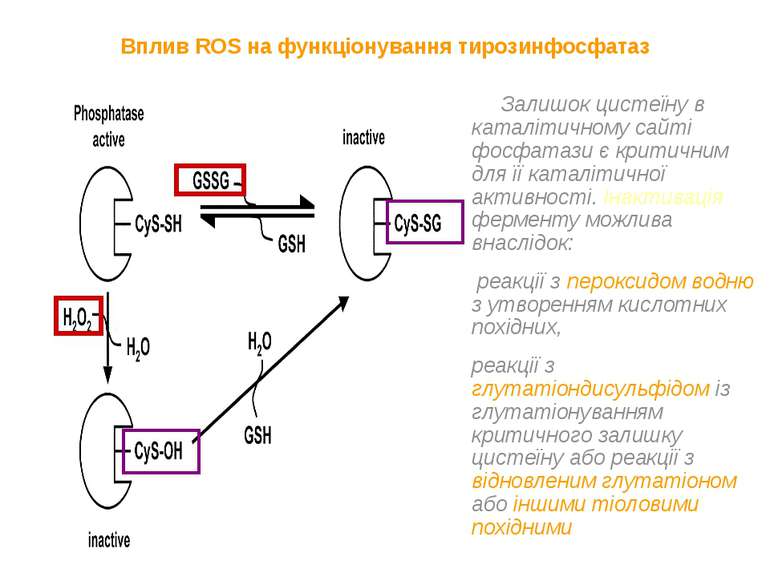
Вплив ROS на функціонування тирозинфосфатаз Залишок цистеїну в каталітичному сайті фосфатази є критичним для її каталітичної активності. Інактивація ферменту можлива внаслідок: реакції з пероксидом водню з утворенням кислотних похідних, реакції з глутатіондисульфідом із глутатіонуванням критичного залишку цистеїну або реакції з відновленим глутатіоном або іншими тіоловими похідними
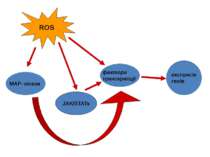
Вплив ROS на функціонування тирозинкіназ ROS та прооксидантні зміни глутатіонового співвідношення посилюють активність деяких тирозинових протеїнкіназ (Lck, Fyn, Syk, і ZAP70) і кіназ Src - родини (p56lck, p59fyn). Фізіологічна роль цього все ще не визначена. Пероксид водню стимулює JAK2, критичний медіатор для активації Ras/Raf/ERK шляхів в фібробластах.
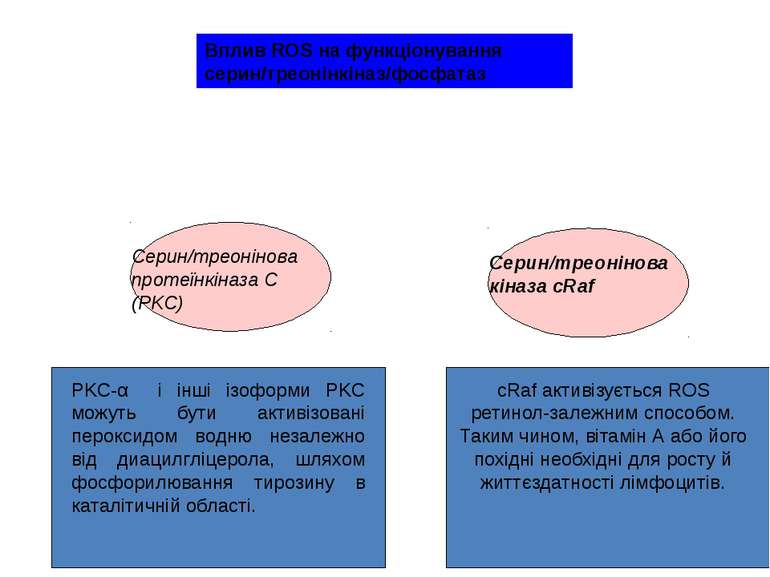
PKC-α і інші ізоформи PKC можуть бути активізовані пероксидом водню незалежно від диацилгліцерола, шляхом фосфорилювання тирозину в каталітичній області. cRaf активізується ROS ретинол-залежним способом. Таким чином, вітамін А або його похідні необхідні для росту й життєздатності лімфоцитів. Вплив ROS на функціонування серин/треонінкіназ/фосфатаз
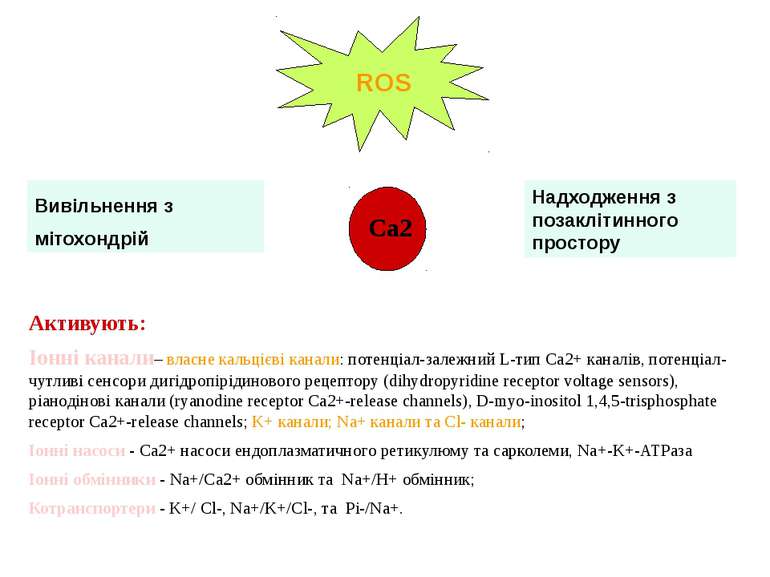
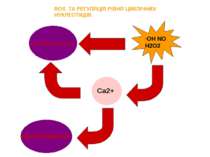
Вивільнення з мітохондрій Надходження з позаклітинного простору Активують: Іонні канали– власне кальцієві канали: потенціал-залежний L-тип Ca2+ каналів, потенціал-чутливі сенсори дигідропірідинового рецептору (dihydropyridine receptor voltage sensors), ріанодінові канали (ryanodine receptor Ca2+-release channels), D-myo-inositol 1,4,5-trisphosphate receptor Ca2+-release channels; K+ канали; Na+ канали та Cl- канали; Іонні насоси - Ca2+ насоси ендоплазматичного ретикулюму та сарколеми, Na+-K+-ATPаза Іонні обмінники - Na+/Ca2+ обмінник та Na+/H+ обмінник; Котранспортери - K+/ Cl-, Na+/K+/Cl-, та Pi-/Na+.
Механізм ROS-індукованої активації іон-транспортних шляхів включає: окислення сульфгідрильних груп іон-транспортних протеїнів; зміну ліпідного оточення внаслідок активації процесів ПОЛ; інгібування мембранозв’язанних регуляторних ферментів і модифікація оксидативного фосфорилювання та рівня АТФ. Наприклад: У клітинах ЦНС ангіотензин II через Rac1 білок активує NADPH-оксидазу, що призводить до підвищеного синтезу супероксиду. У свою чергу, супероксид здатний активувати потенціал-залежні Cd2+-чутливі Ca2+ канали, що призводить до зростання надходження позаклітинного кальцію у клітину, і, таким чином, його внутрішньоклітинного вмісту
Вивільнення Ca2+ з мітохондрій Головні сайти ROS синтезу - комплекс I і комплекс III ROS збільшують активність інозитолтрифосфата та ріанодінових рецепторів, головних каналів виходу Ca2+ з внутрішньоклітинного депо у відповідь на клітинне збудження
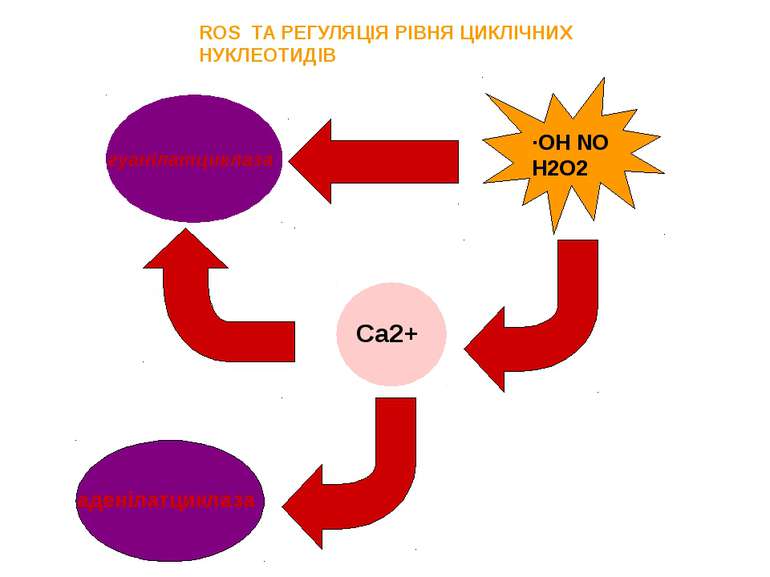
ROS ТА РЕГУЛЯЦІЯ РІВНЯ ЦИКЛІЧНИХ НУКЛЕОТИДІВ гуанілатциклаза ∙ОН NO Н2О2 Ca2+ аденілатциклаза
ROS здатні опосередковано регулювати синтез сАМР ROS через регуляцію рівня Са2+ здатні впливати на активність цього ферменту. можливе ROS-залежне інгібування активності аденілатциклази на рівні блокування проходження сигналу до цього ферменту від рецептора. Наприклад: церамід C2 через Н2О2 вибірково блокує PACAP-активований синтез цАМФ, не впливаючи на фосфоінозитидний каскад. опосередковує роз’єднання аденілатциклазного шляху. Механізм, ймовірно, полягає у ROS-активуванні тирозинових фосфатаз.
Окисна активація MAPK-каскадів (JNK та p38 ) безпосередньо фосфорилювання серинового й/або треонінового залишку в активному центрі ферментів супероксид та Н2О2 залучені у активування ERK-1, ERK-2 і p38 MAPK при дії ангіотензина II та PDGF Н2О2 викликає олігомеризацію GSTp і дисоціацію GSTp-JNK комплексу. опосередковано активування регуляторних систем через ROS-активування тирозинових кіназ Src-родини відбувається активація JNK і p38 В нормі Trx зв’язується з NH2-кінцевою областю ASK1 і інгібує активність цієї кінази. ROS призводить до димеризації Trx і його дисоціації від ASK1, що супроводжується полімеризацією ASK1 та активацією її кіназної активності. Н2О2 може інгібувати фосфатази, ймовірно, шляхом прямого окислення цистеїну в активному центрі цих ензимів.
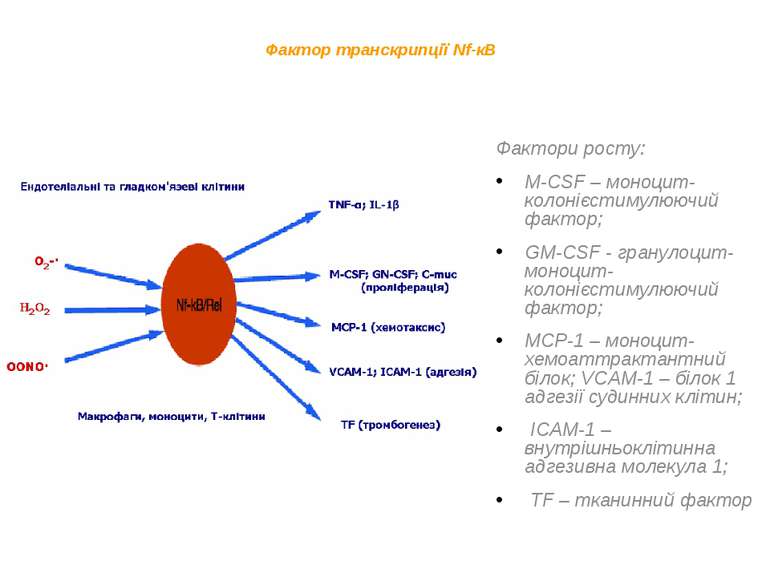
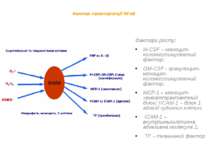
Фактор транскрипції Nf-кB Фактори росту: M-CSF – моноцит-колонієстимулюючий фактор; GM-CSF - гранулоцит-моноцит- колонієстимулюючий фактор; MCP-1 – моноцит-хемоаттрактантний білок; VCAM-1 – білок 1 адгезії судинних клітин; ICAM-1 – внутрішньоклітинна адгезивна молекула 1; TF – тканинний фактор
Активація фактора транскрипції AP 1 Фактор транскрипції AP 1 складається з c-Fos й c-Jun білків і залучений у процеси диференціювання через індукцію mRNA-аз c-Fos та c-Jun відносно низькими концентраціями пероксиду водню, супероксиду, NO, і інших індукторів оксидантного стресу окисною активацією JNK. Ця MAPK фосфорилює серинові залишки 63 й 73 у NH2-термінальному трансактиваційному домені c-Jun, що потрібно для його функціональної активності. Для редокс-чутливого бактеріального білка Oxy і кінази інсулінового рецептора людини, активація AP 1 і регулюючих його сигнальних каскадів може також бути посилена змінами у внутрішньоклітинному глутатіоновому редокс-статусі.
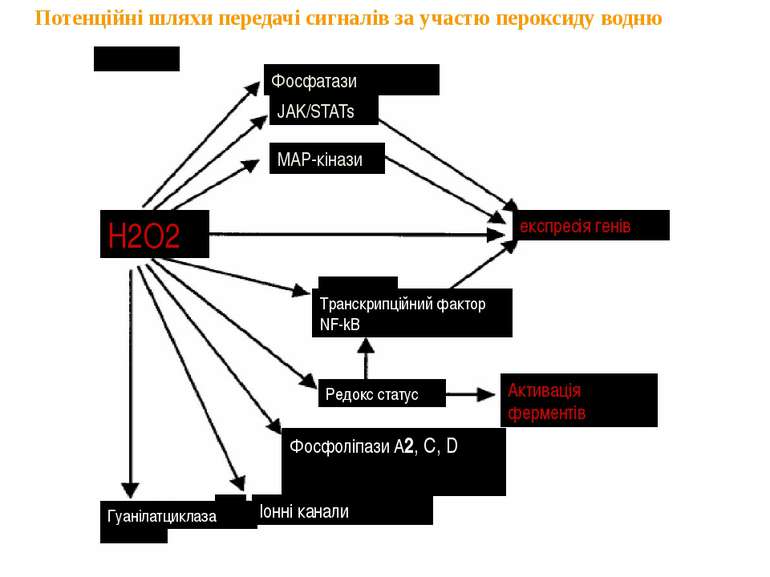
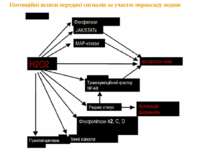
Потенційні шляхи передачі сигналів за участю пероксиду водню Фосфатази JAK/STATs MAP-кінази експресія генів Транскрипційний фактор NF-kB Редокс статус Фосфоліпази А2, С, D Іонні канали Гуанілатциклаза Активація ферментів H2O2
NB!!! ROS не є класичними вторинними мессенджерами !!! білки-мішені класичних вторинних месенджерів мають специфічні зв’язуючі центри, при взаємодії з якими мессенджери і здійснюють свою регуляторну дію за рахунок зміни конформації білків-мішеней. Для ROS подібних структур не існує швидкість як продукції, так й розпаду вторинних мессенджерів набагато нижча, ніж швидкість продукції й розпаду ROS, що забезпечує надійну взаємодію ліганду (мессенджеру) з активним центром мішені. Що стосується ROS, то, завдяки повсюдній присутності потужних механізмів їхнього усунення, їхній стаціонарний рівень надзвичайно низький.
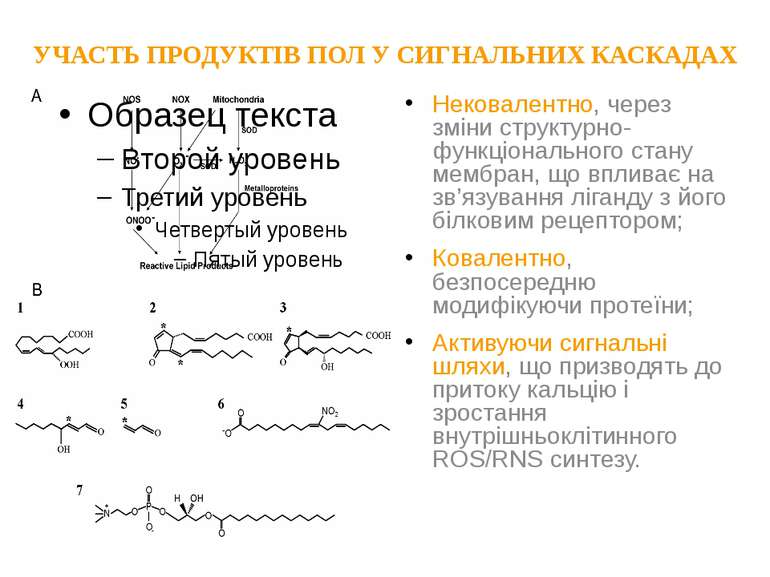
УЧАСТЬ ПРОДУКТІВ ПОЛ У СИГНАЛЬНИХ КАСКАДАХ Нековалентно, через зміни структурно-функціонального стану мембран, що впливає на зв’язування ліганду з його білковим рецептором; Ковалентно, безпосередню модифікуючи протеїни; Активуючи сигнальні шляхи, що призводять до притоку кальцію і зростання внутрішньоклітинного ROS/RNS синтезу.
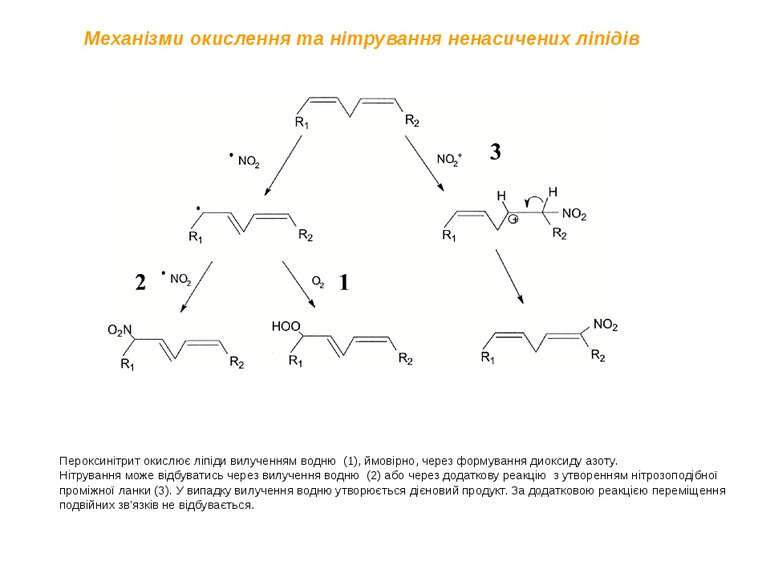
Пероксинітрит окислює ліпіди вилученням водню (1), ймовірно, через формування диоксиду азоту. Нітрування може відбуватись через вилучення водню (2) або через додаткову реакцію з утворенням нітрозоподібної проміжної ланки (3). У випадку вилучення водню утворюється дієновий продукт. За додатковою реакцією переміщення подвійних зв'язків не відбувається. Механізми окислення та нітрування ненасичених ліпідів
УЧАСТЬ НІТРОПОХІДНИХ ЛІПІДІВ У ПРОЦЕСАХ СИГНАЛЬНОЇ ТРАНСДУКЦІЇ можуть трансдукувати NO-сигнальні реакції і опосередковують сигнальні шляхи при запаленні нітролінолеат індукує cGMP-залежні шляхи трансдукції нітролінолеат активує NO-залежне, cGMP-опосередковане розслаблення гладком'язевих клітин через цАМФ-залежні механізми інгібують опосередковану тромбіном агрегацію тромбоцитів знижують мобілізацію кальцію і підвищують фосфорилювання фосфопротеїну, стимульованого вазодилятаторами через активування протеїнкінази А підвищують вміст цАМФ, ймовірно, через інгібування активності фосфодіестераз та активування аденілциклаз через аденілатциклазозалежний каскад інгібують активування лейкоцитів у відповідь на форбол 12-мірістат 13 ацетат (PMA) та N-форміл-метіоніллейцил-фенілаланін (fMLP), що призводить до зниження синтезу супероксиду та експресії інтегрину
Отже, ROS (О2•–, Н2О2, ОН• і пероксиди ліпідів) приймають активну участь у процесах сигнальної трансдукції, здійснюючи регулюючу роль у процесах проліферації, апоптозу, клітинної адгезії, згортання крові і т. д.. ROS посилюють трансдукцію сигналів от різних мембранних рецепторів. Існує позитивний зворотній зв’язок між трансдукцією сигналів від мембранних рецепторів факторів росту, цитокінов чи інших лігандів і відповідною активацією NAD(P)H оксидаз. Активування відповідного рецептору супроводжується посиленням синтезу ROS через цей чи інші рецептори і забезпечує подальшу кооперативність їх дії. Оскільки пероксид водню має відносно довгий період напіврозпаду і може проходити через мембрани, ця кооперативність може навіть простягатися на сусідні клітини. Окрім того, мембранний рецептор може функціонувати одночасно як датчик для позаклітинних сигналів і як датчик для внутрішньоклітинного метаболічного стану індивідуальної клітини.
Отже, Редокс-активація мембранної передачі сигналів рецептора і подальшої сигнальної трансдукції сьогодні недостатньо охарактеризована на молекулярному рівні, але, ймовірно, залучає одночасно окислювальну модифікацію кількох різних редокс-чутливих сигнальних білків. ROS активують сигнальні каскади за участю тирозиновтх протеїнкіназ шляхом інгібування тирозинових фосфатаз. Молекулярний механізм полягає в модифікації цистеїнового залишку в активному центрі ферменту. Також, тирозинові протеїнфосфатази можуть бути інактивовані змінами у внутрішньоклітинному тіол/дисульфідному співвідношенні. ROS залучені в активування сигнальних каскадів за участю JNK, p38 MAPK та фактору транскрипції AP1. У регуляції зазначених каскадів також бере участь ROS-активація тирозинкіназ Src-родини і певних ізоформ PKC та дисоціація JNK/GSTp і ASK1/Trx. ROS і зміни у внутрішньоклітинному тіол/дисульфідному співвідношенні сприяють активації NF-B в різних типах клітин. Модулюють здатність зв’язувати ДНК багатьох, якщо не більшості факторів транскрипції.
Схожі презентації
Категорії