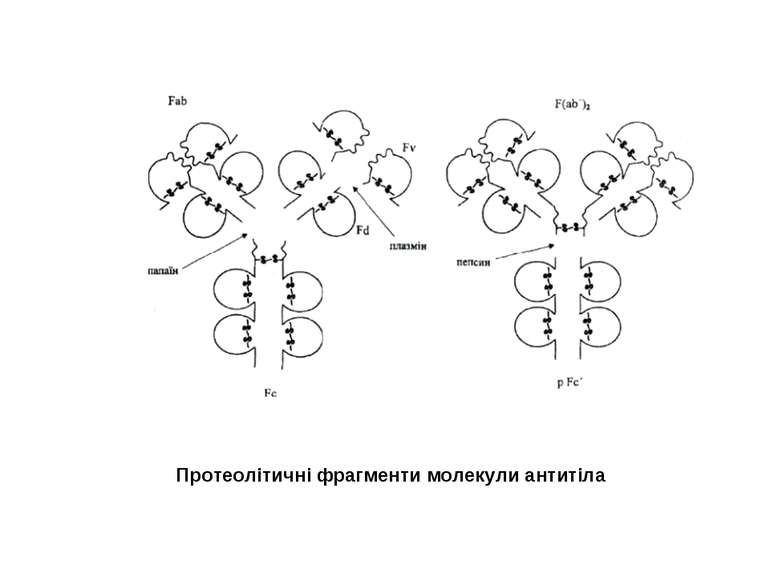
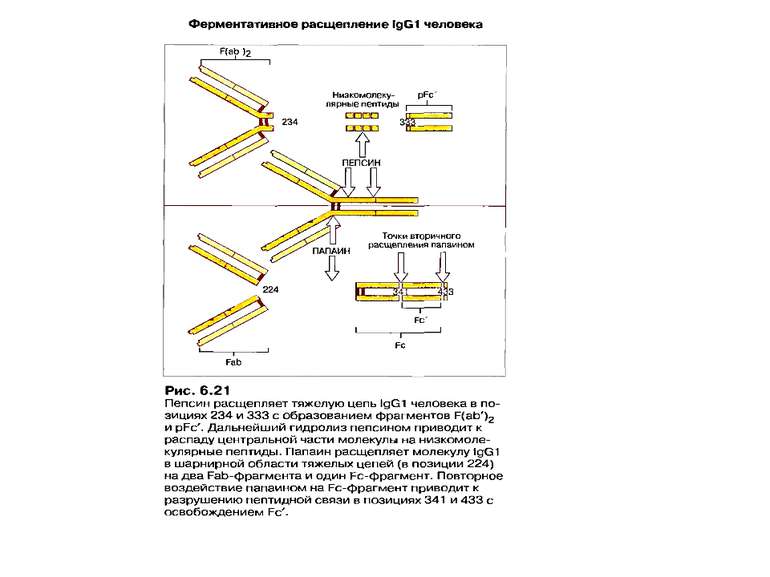
Презентація на тему:
Иммуноглобул_
Завантажити презентацію
Иммуноглобул_
Завантажити презентаціюПрезентація по слайдам:
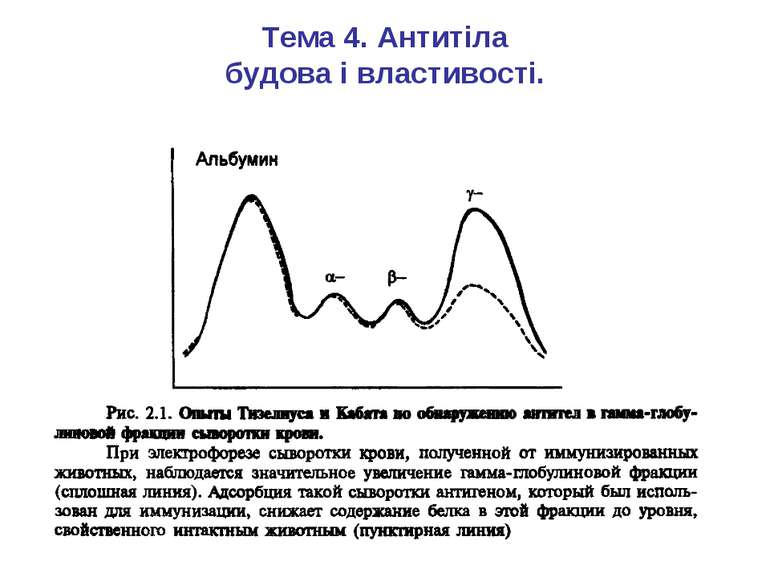
Антитіла – продуковані В- лімфоцитами глікопротеїни, відкриті як γ- глобулінова фракція сироватки крові, що здатні специфічно взаємодіяти з антигеном. В 1972 році Родні Портер із Оксфорду та Джеральд Едельман із Нью -Йорку отримали Нобелівську премію за вивчення структури імуноглобулінів. Згідно з їхніми дослідженнями було створено модель молекули антитіла.
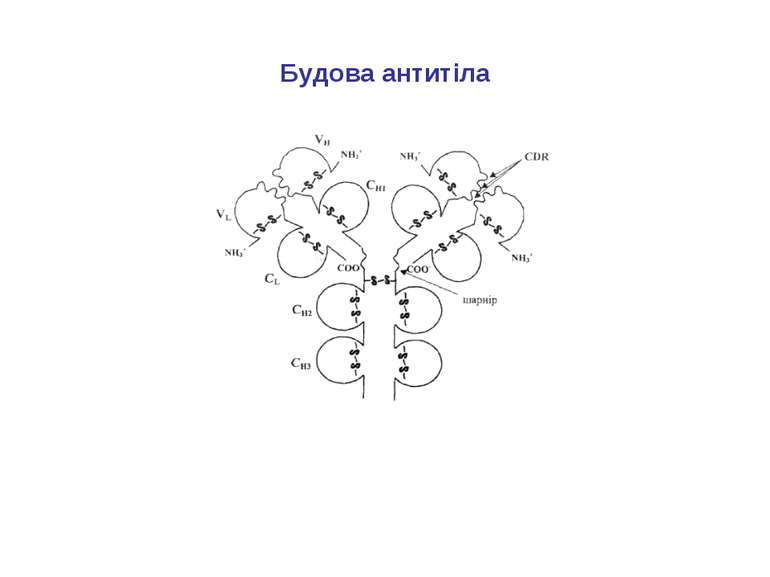
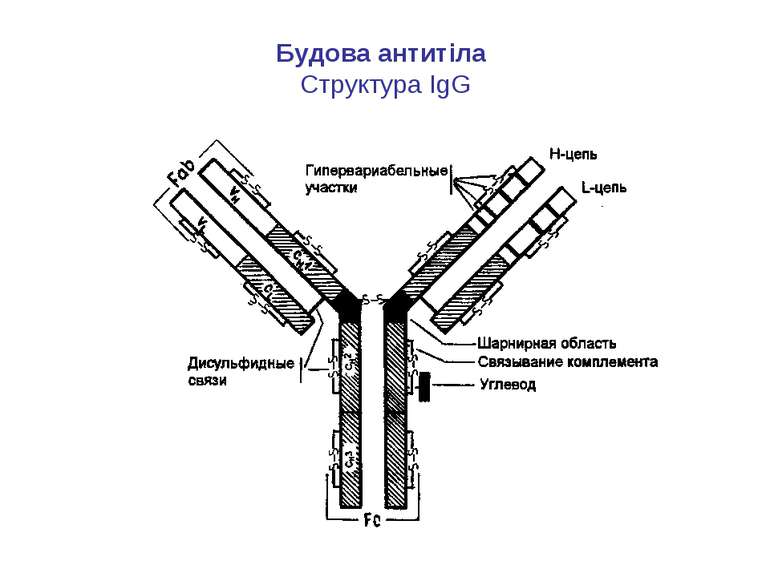
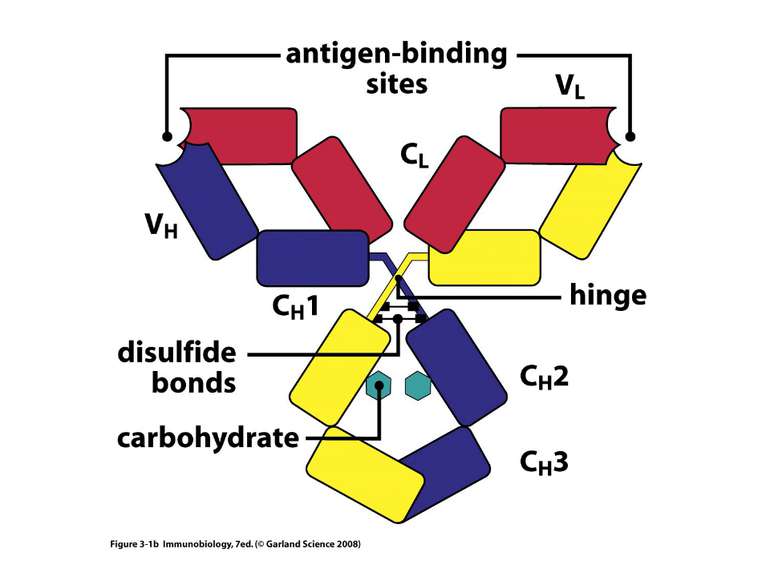
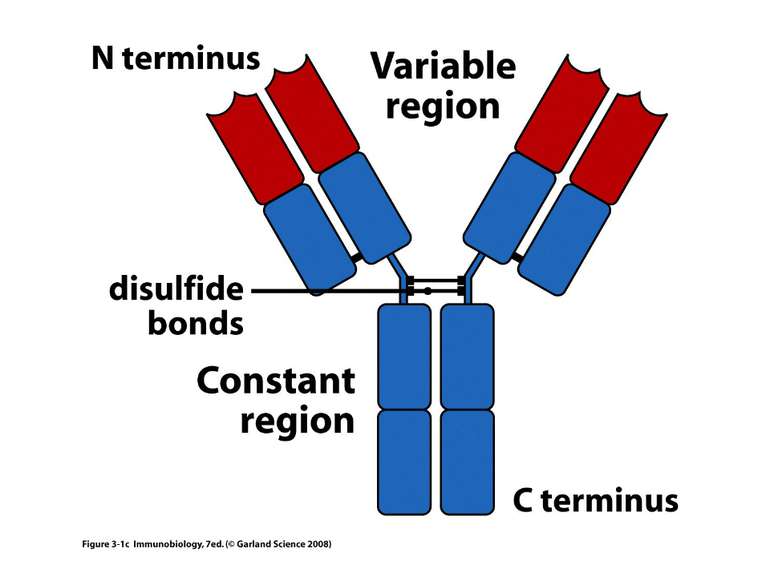
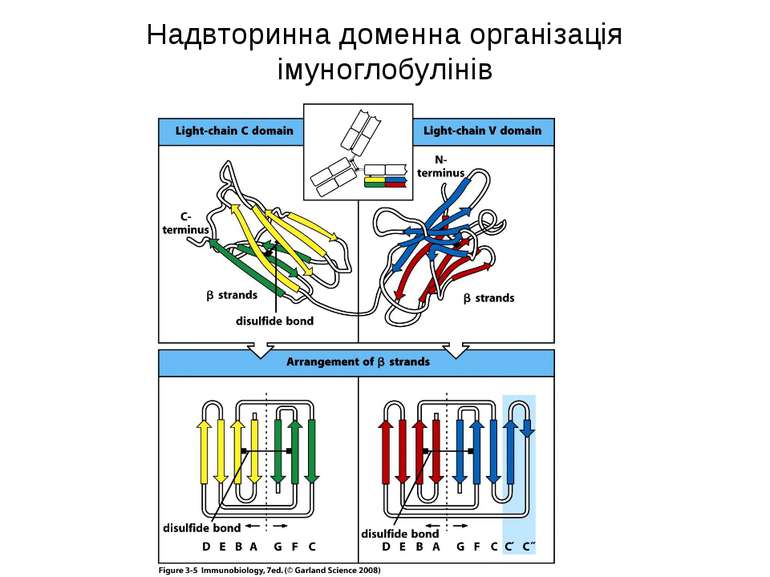
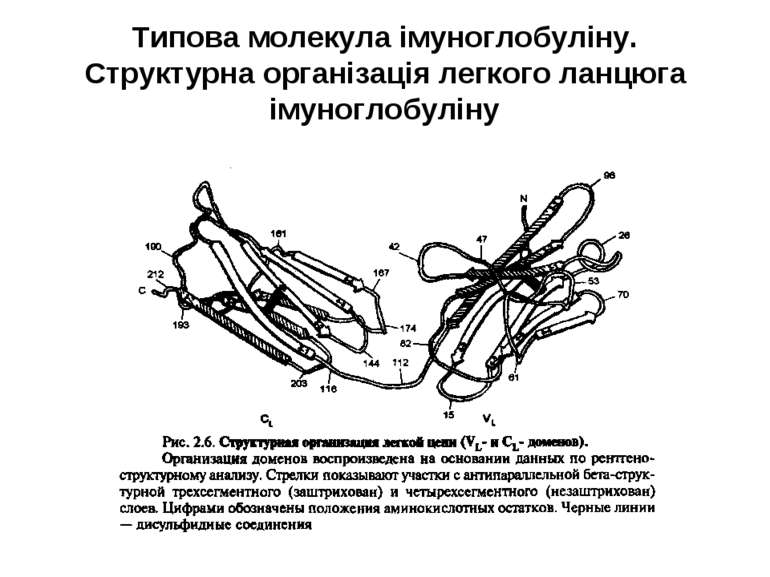
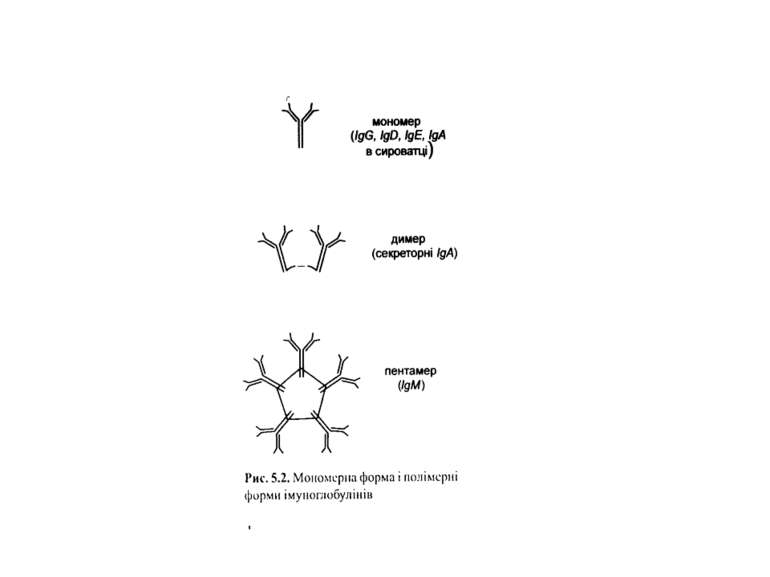
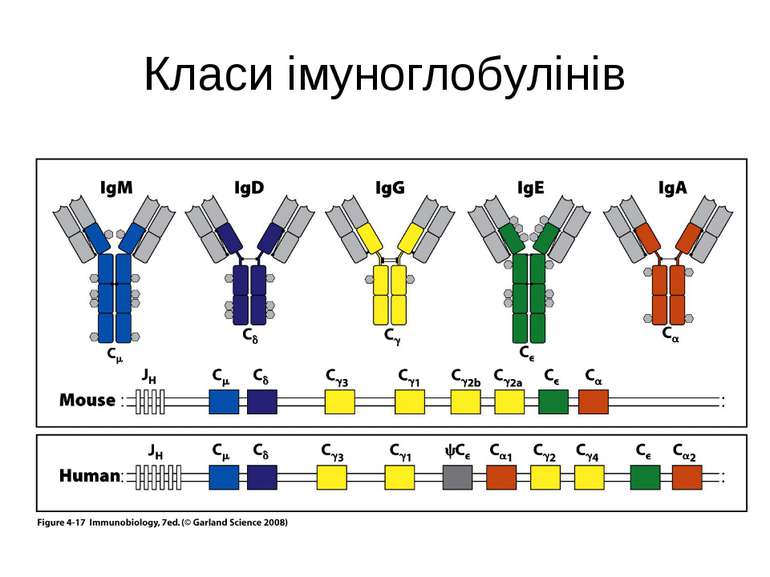
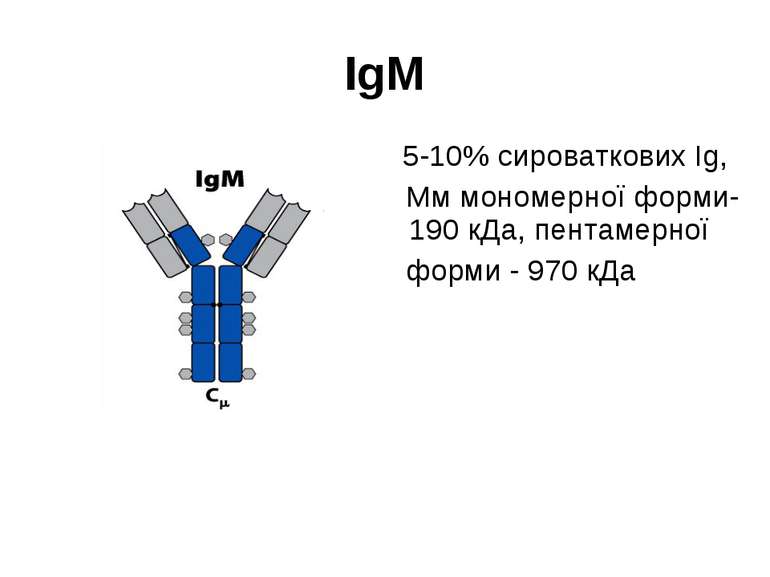
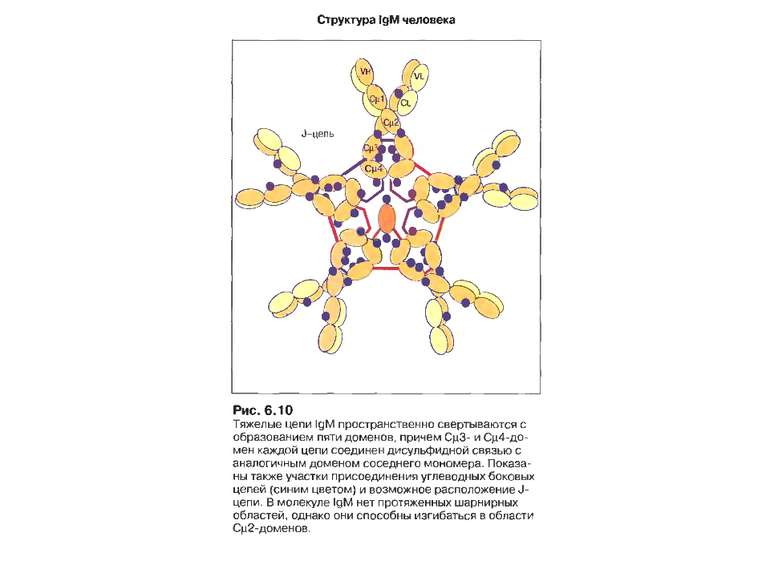
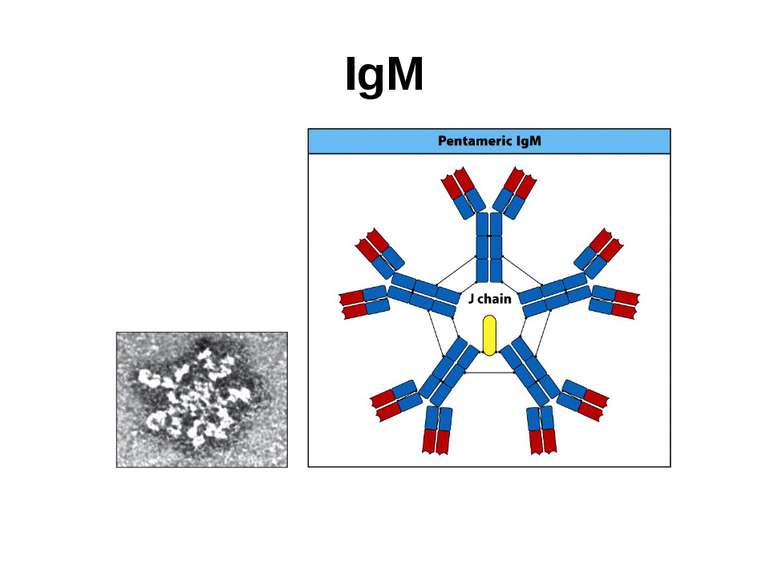
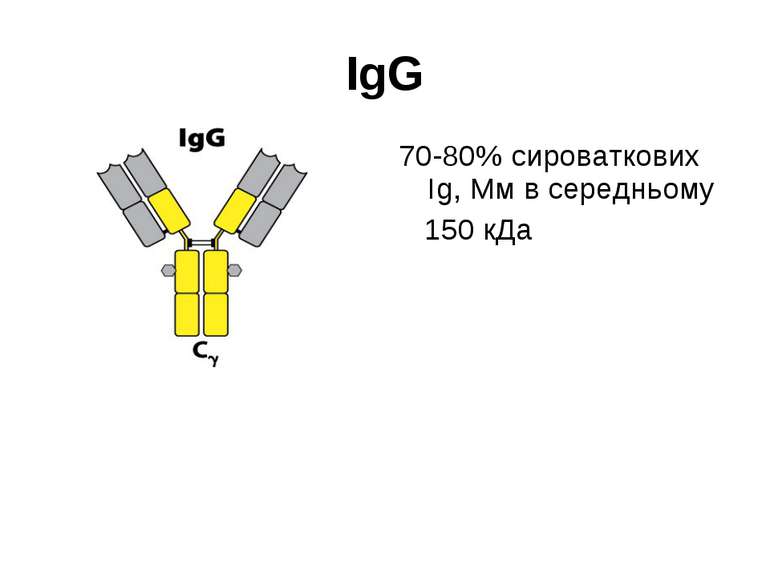
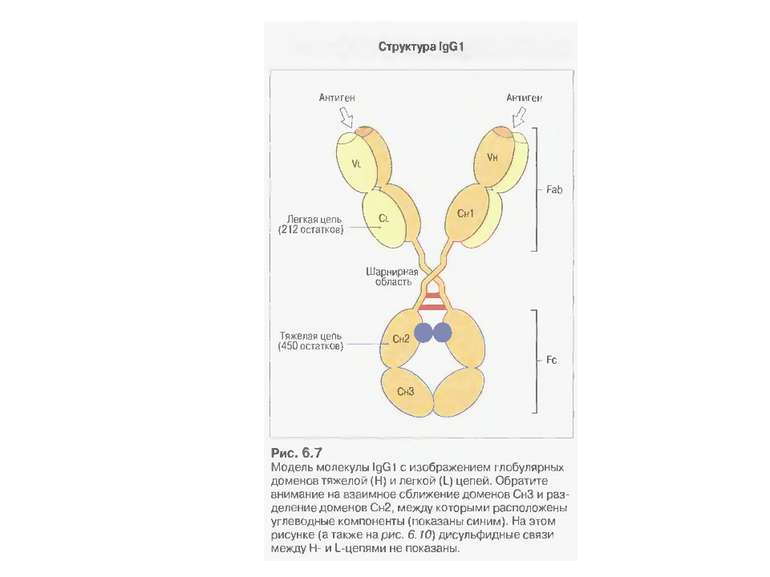
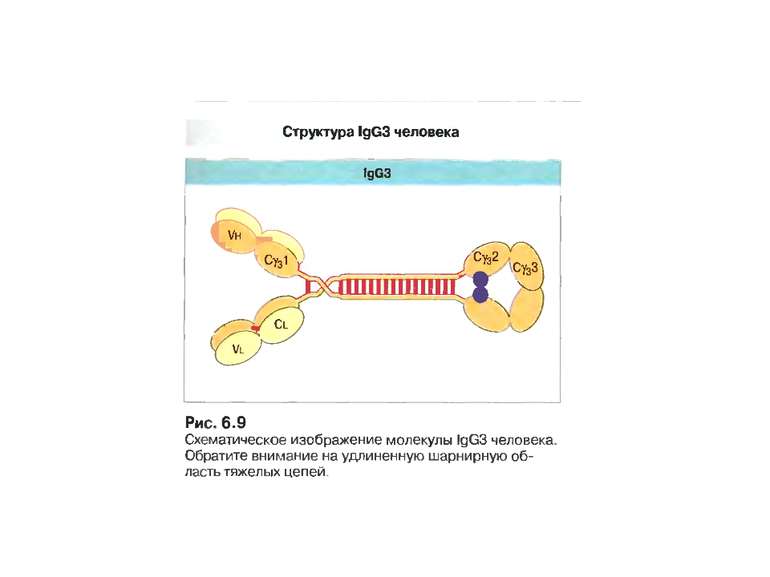
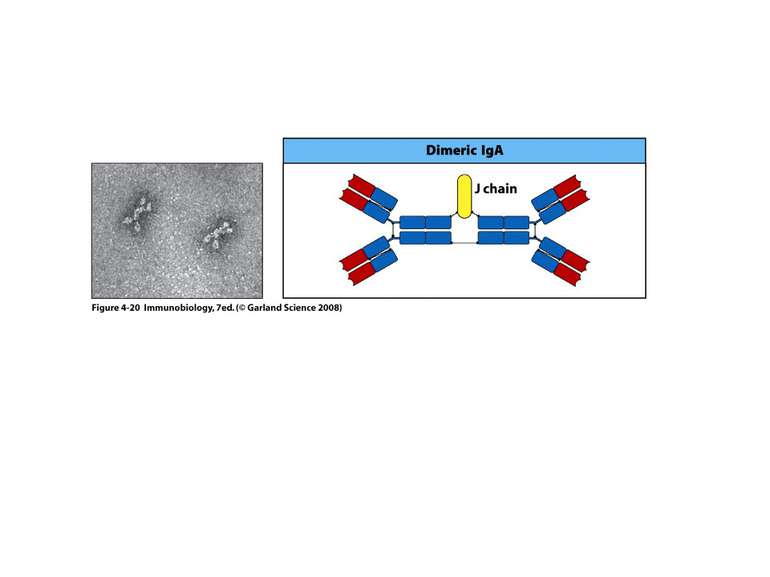
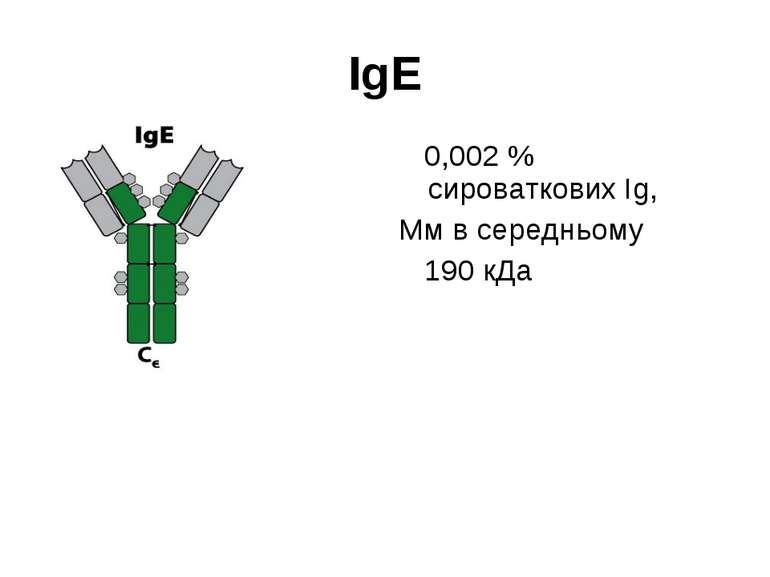
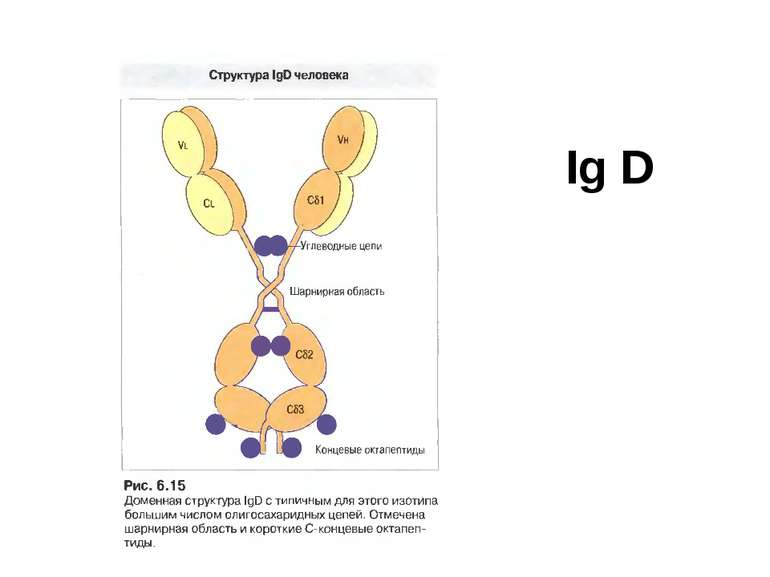
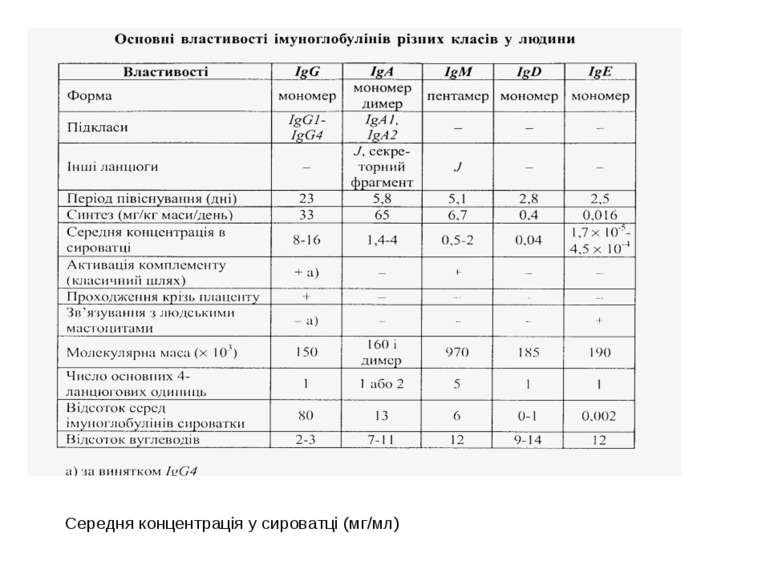
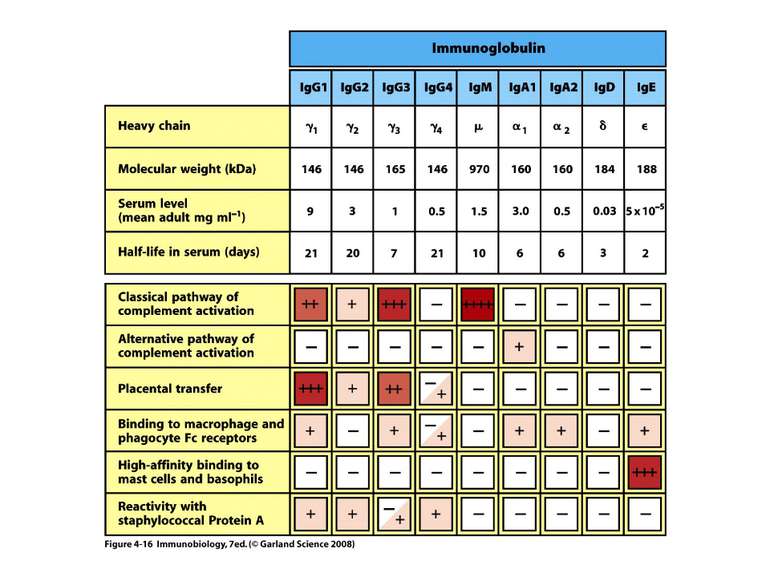
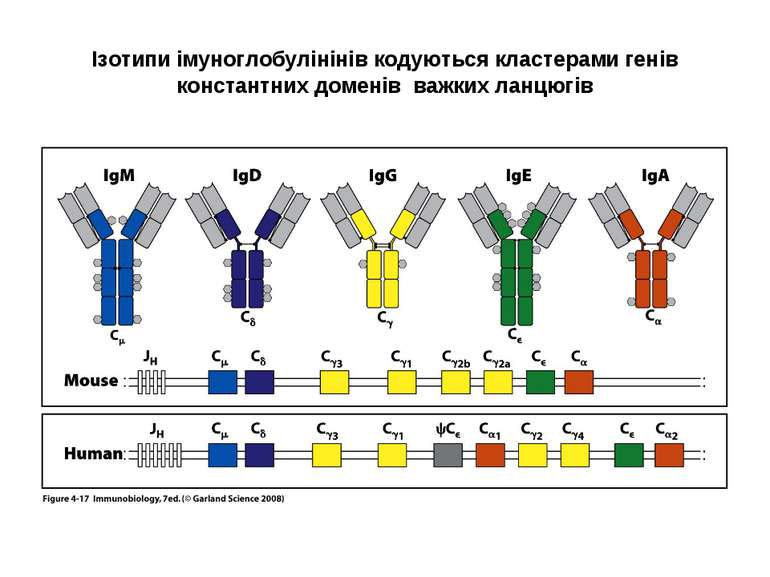
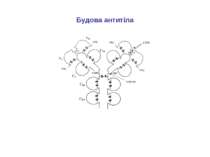
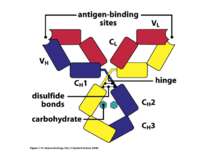
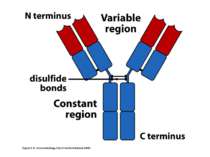
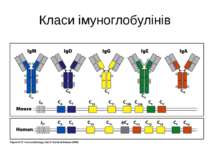
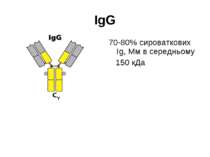
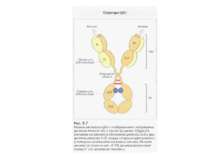
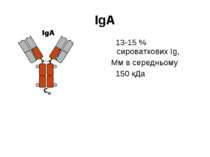
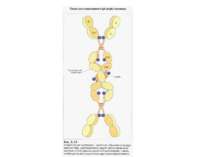
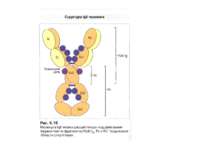
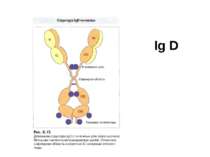
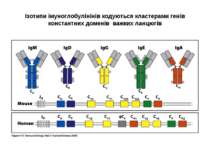
Структура імуноглобулінів Н-важкі поліпептидні ланцюги 5 класів ланцюгів- відповідні класи імуноглобулінів α-Ig A підкласи α 1, α 2 γ-Ig G підкласи γ1, γ2, γ3, γ4 δ-Ig D ε-Ig E μ-Ig M підкласи μ1, μ 2 L-легкі поліпептидні ланцюги 2 типи- κ, λ Підтипи 1κ і 4 λ
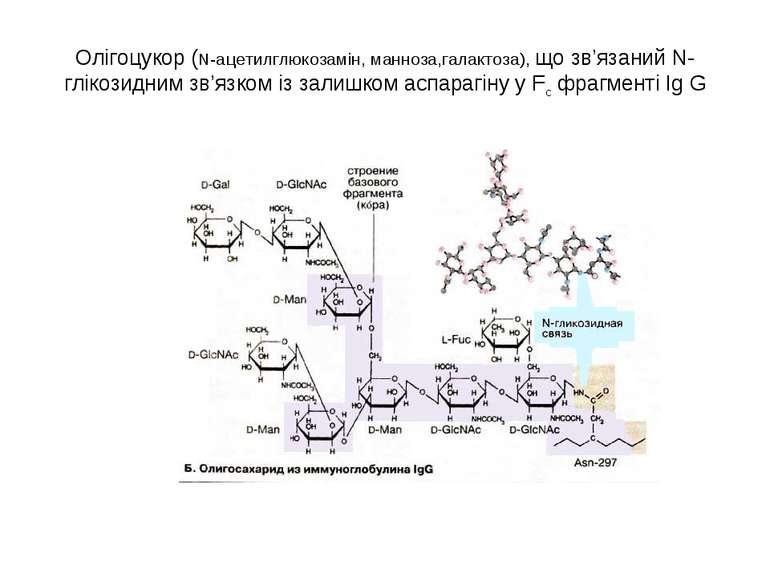
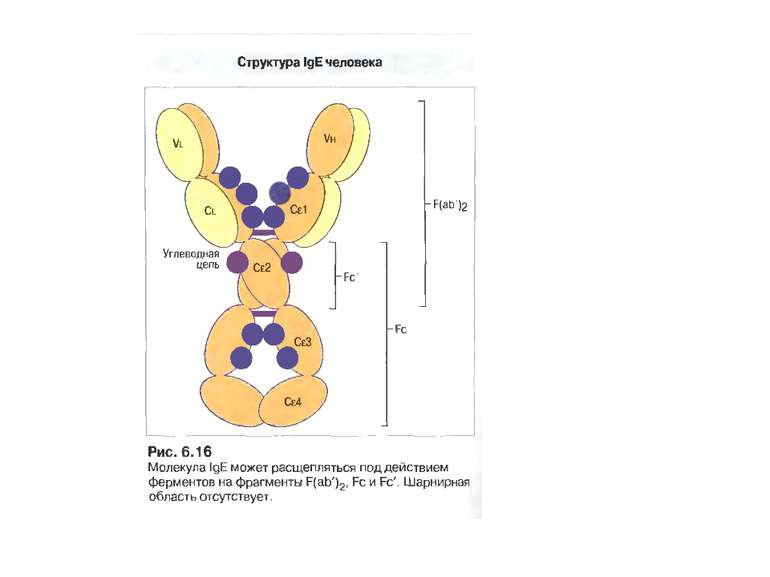
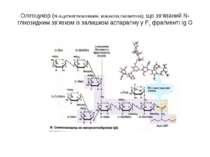
Олігоцукор (N-aцетилглюкозамін, манноза,галактоза), що зв’язаний N-глікозидним зв’язком із залишком аспарагіну у Fc фрагменті Ig G
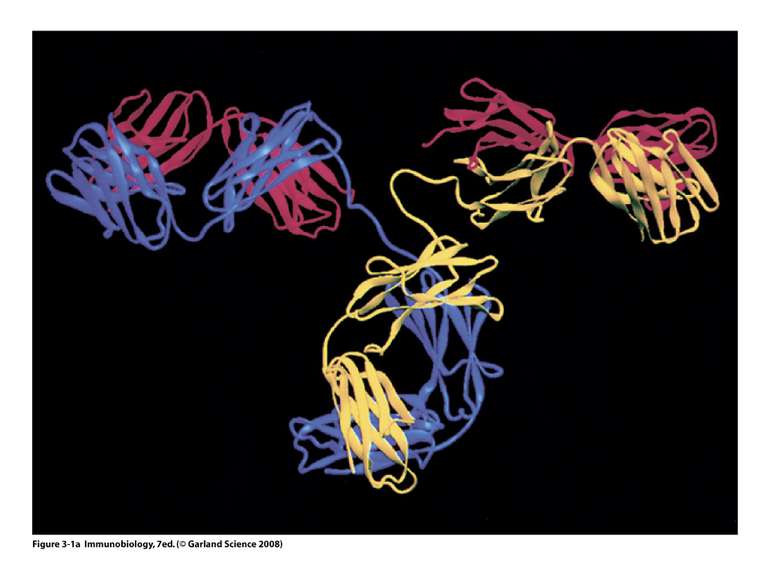
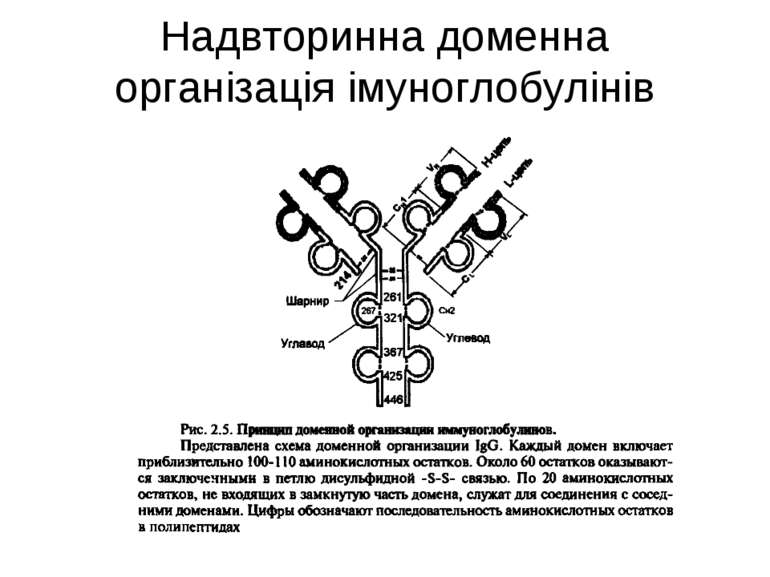
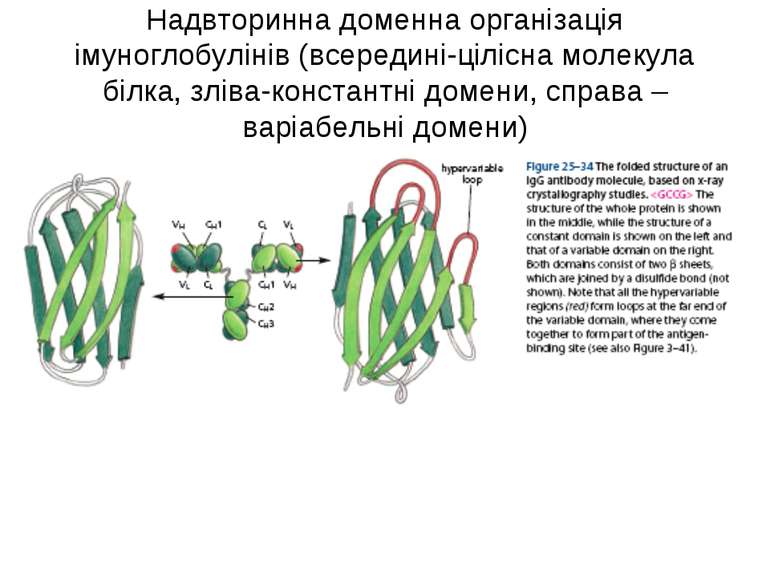
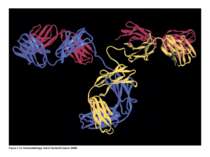
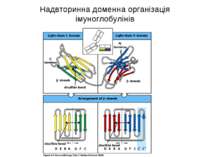
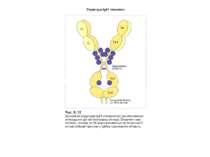
Надвторинна доменна організація імуноглобулінів (всередині-цілісна молекула білка, зліва-константні домени, справа – варіабельні домени)
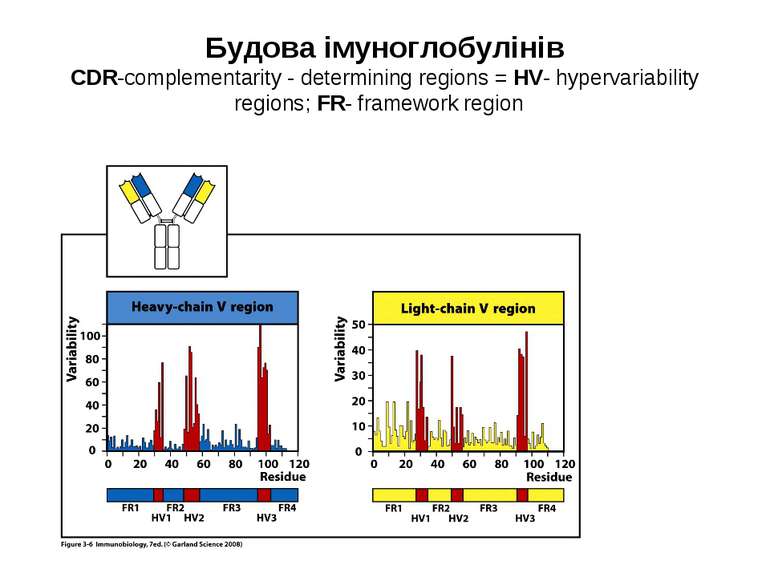
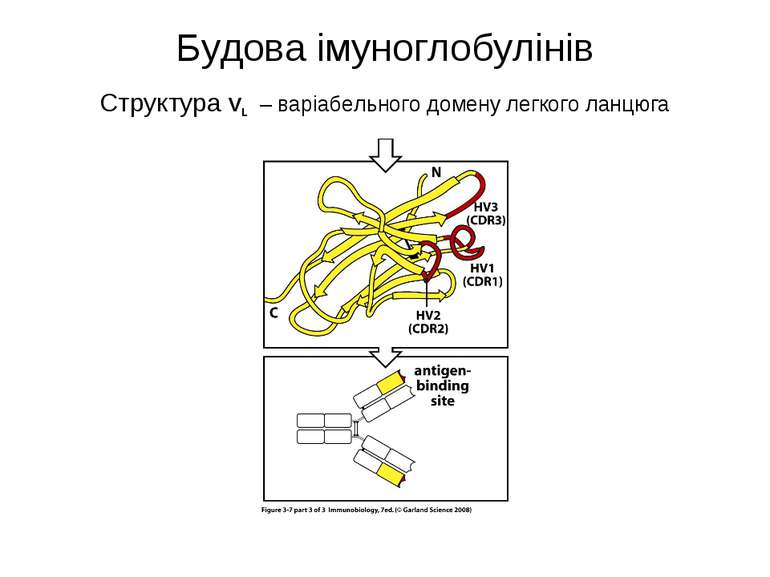
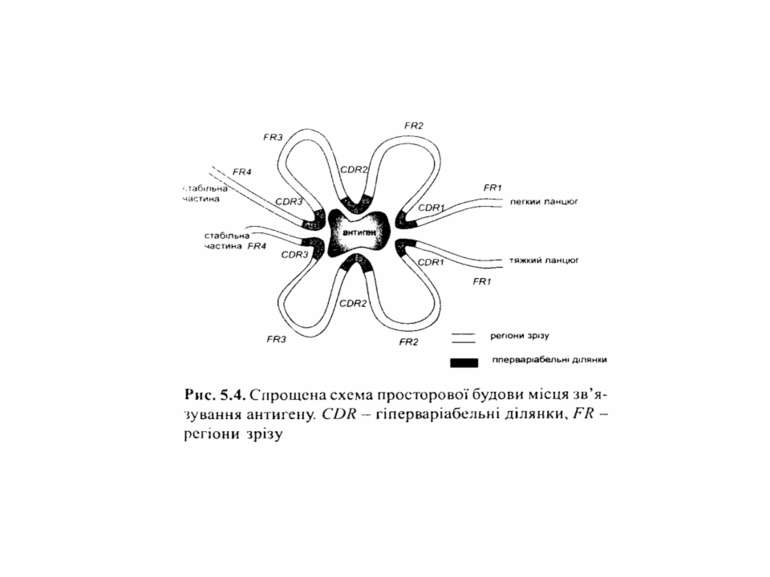
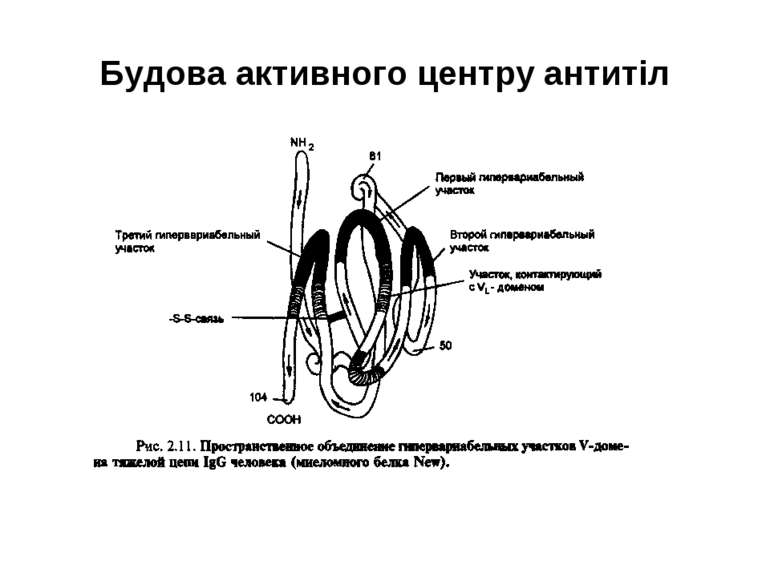
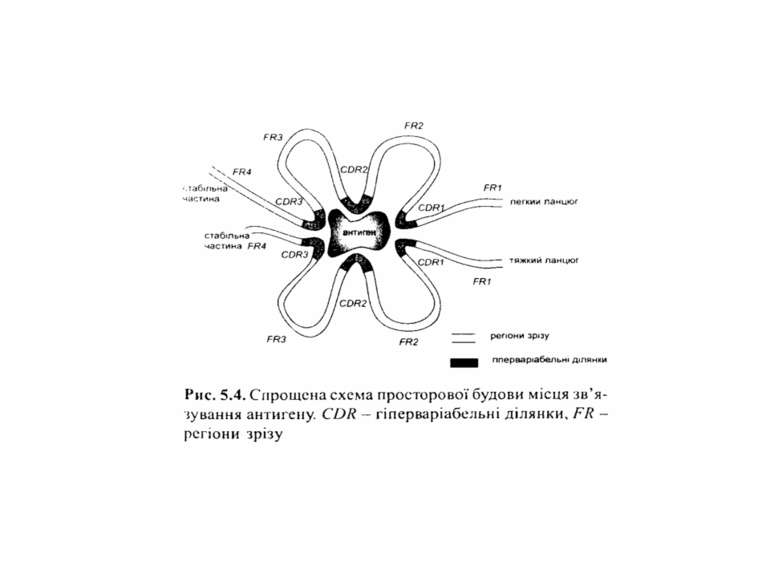
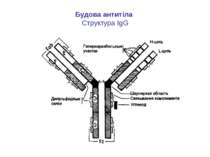
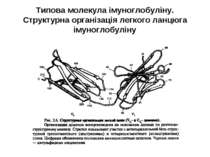
Будова імуноглобулінів CDR-complementarity - determining regions = HV- hypervariability regions; FR- framework region
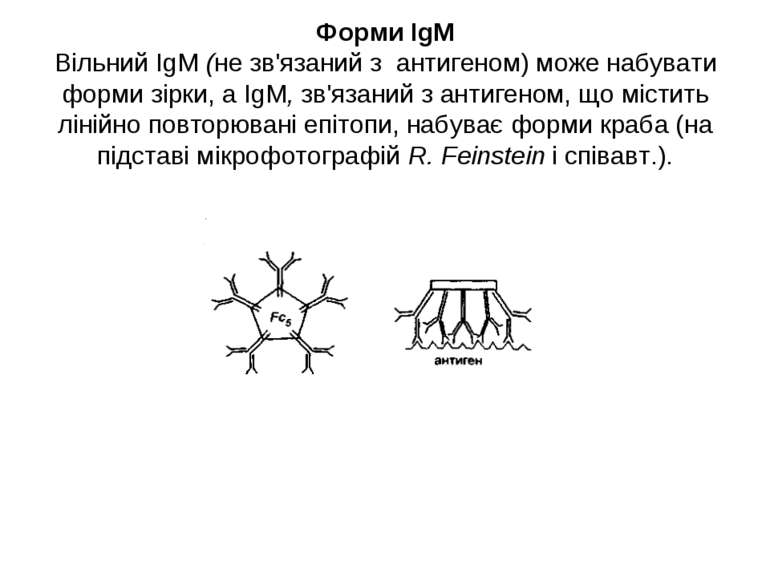
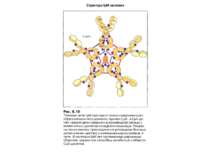
Форми IgM Вільний IgM (не зв'язаний з антигеном) може набувати форми зірки, а IgM, зв'язаний з антигеном, що містить лінійно повторювані епітопи, набуває форми краба (на підставі мікрофотографій R. Feinstein і співавт.).
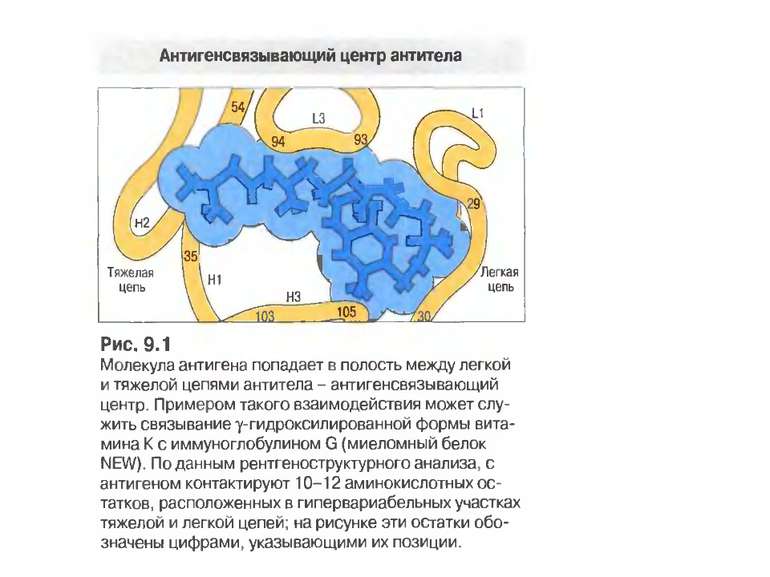
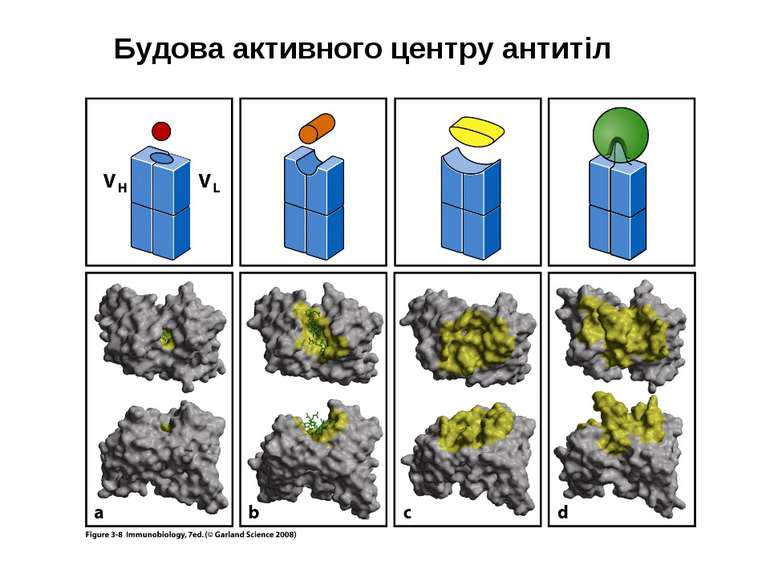
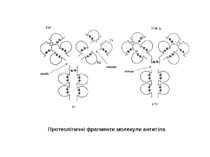
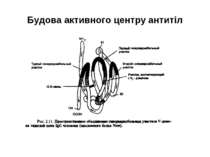
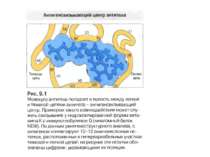
Будова активного центру антитіл 1. До складу активного центру антитіла входять гіперваріабільні амінокислотні залишки. 2. Зв'язок антигену з антитілом не ковалентний, а іонний, водневий , гідрофобний, Ван-дер-Ваальсівський. 3. Розміри активного центру - може розміститися 5-6 залишків амінокислот чи глюкози і розміри активного центру становлять, відповідно, приблизно 1,5х0,6х0,8 нм і можуть варіювати у різних антитіл. 4. Активний центр - це порожнина, заглиблена у Fv фрагмент приблизно на 1,5 нм. 5. У 70-ті роки 20 ст. було зроблено рентгеноструктурний аналіз мієломних імуноглобулінів, який підтвердив дані, отримані раніше, і показав, що активний центр антитіла - це порожнина, в утворенні якої беруть участь гіперваріабільні ділянки Fаb фрагменту, зближені у третинній структурі. За цими ж данними приблизно 10-12 амінокислотних залишків гіперваріабільних ділянок важкого і легкого ланцюга беруть участь у контактуванні з антигеном.
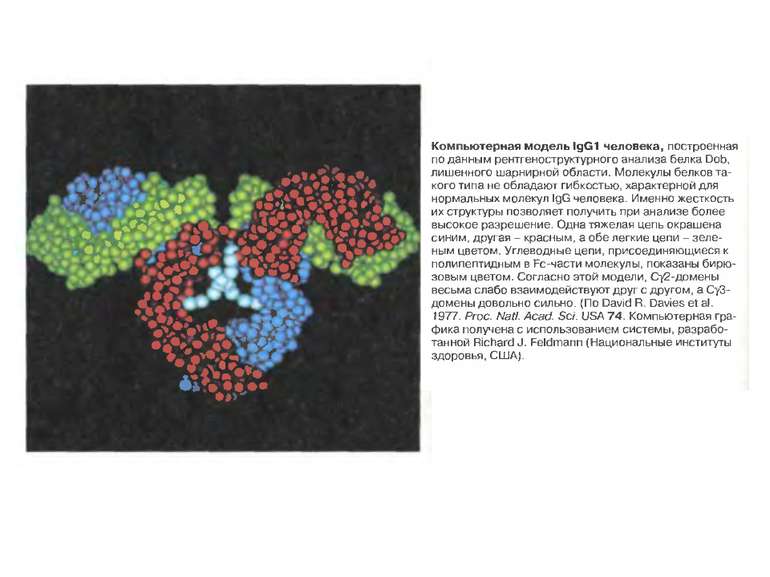
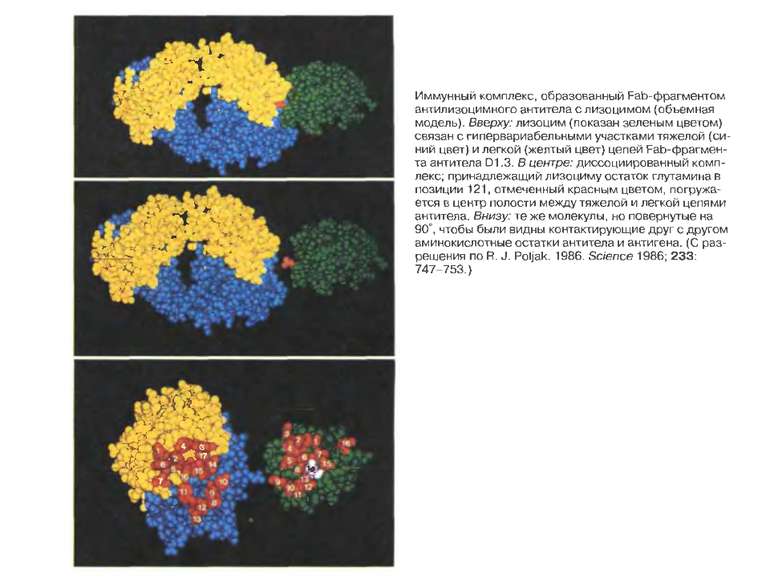
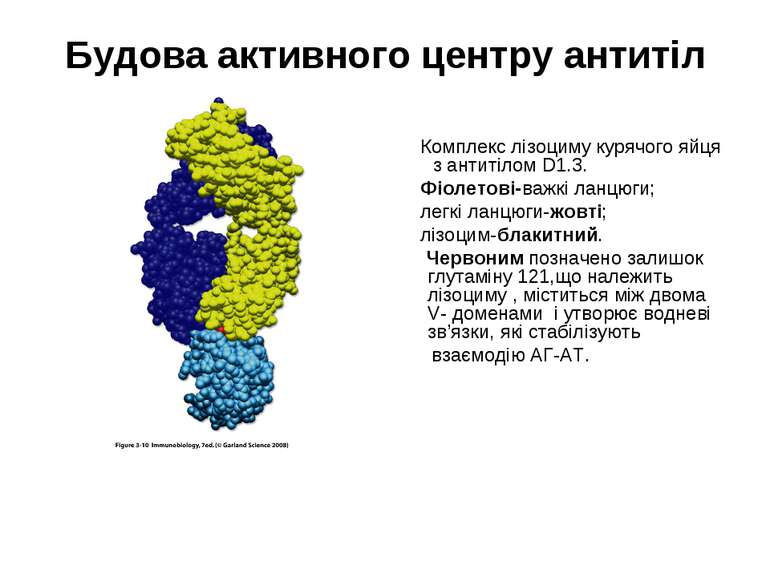
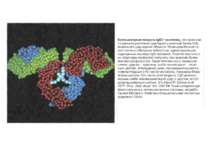
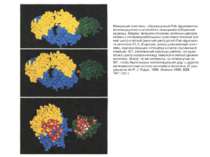
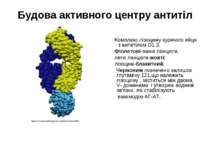
Будова активного центру антитіл Комплекс лізоциму курячого яйця з антитілом D1.3. Фіолетові-важкі ланцюги; легкі ланцюги-жовті; лізоцим-блакитний. Червоним позначено залишок глутаміну 121,що належить лізоциму , міститься між двома V- доменами і утворює водневі зв’язки, які стабілізують взаємодію АГ-АТ.
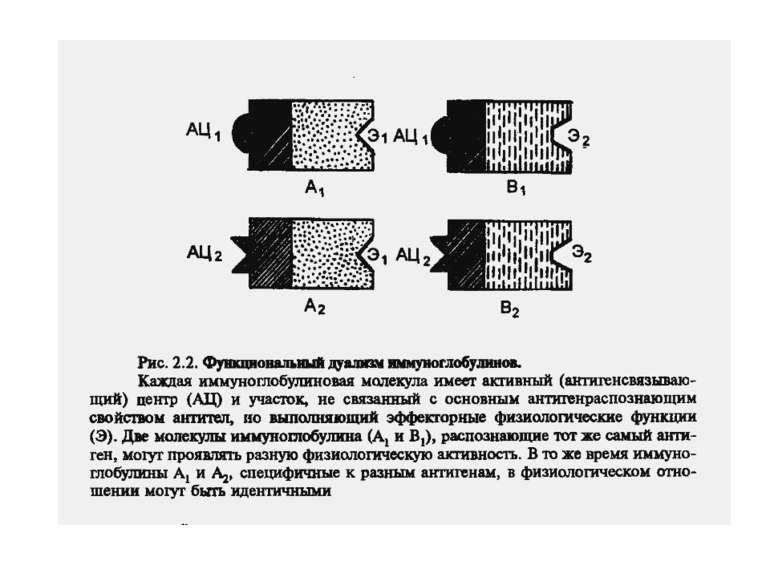
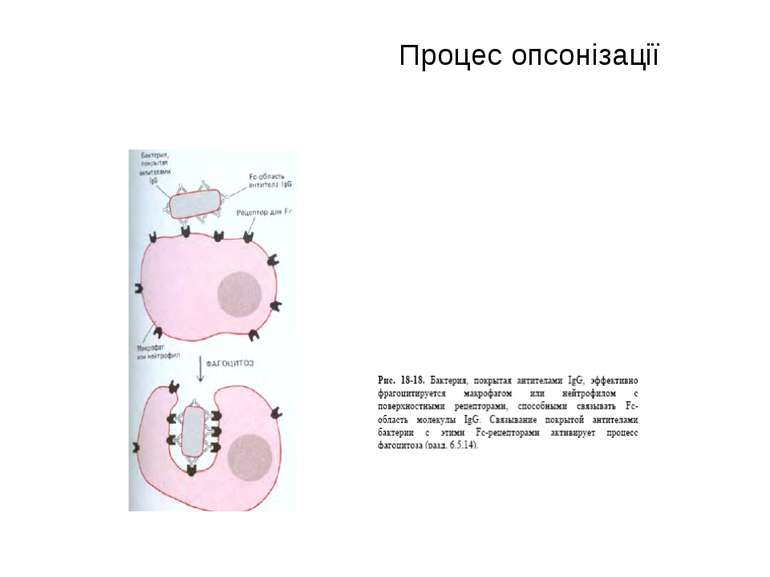
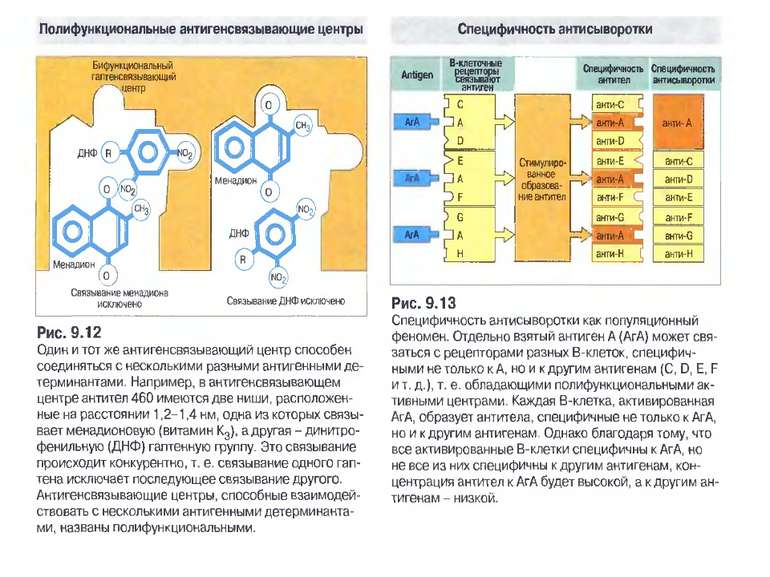
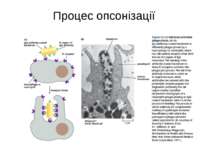
Чотири риси гуморальної імунної відповіді 1) універсальність: антитіла можуть бути виробленими проти будь-якого хімічного угрупування. Важко уявити, скільки повинно бути варіантів антитіл, якщо вважати, що кожний антиген потребує окремого антитіла; 2) специфічність: антитіла розрізняють о- чи p-положення функціональних груп, стереоізомери, білки, що відрізняються на один амінокислотний залишок; 3) гетерогенність: на один антиген виробляється багато типів (популяцій) антитіл, інколи більше 100 на одну антигенну детермінанту; 4) поліфункціональність: одне антитіло здатне зв'язувати більш, ніж один антиген. Поліфункціональність антитіл сприяє універсальності імунної відповіді, а гетерогенність - її високій специфічності.
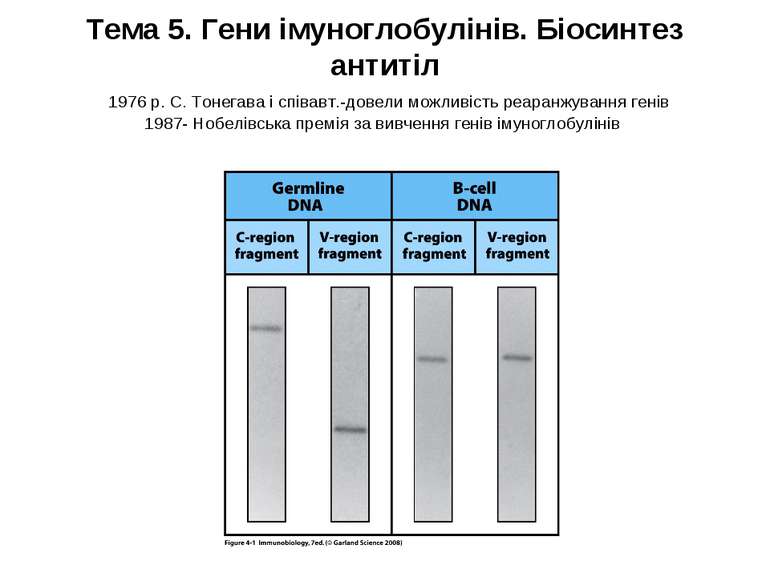
Тема 5. Гени імуноглобулінів. Біосинтез антитіл 1976 р. С. Тонегава і співавт.-довели можливість реаранжування генів 1987- Нобелівська премія за вивчення генів імуноглобулінів
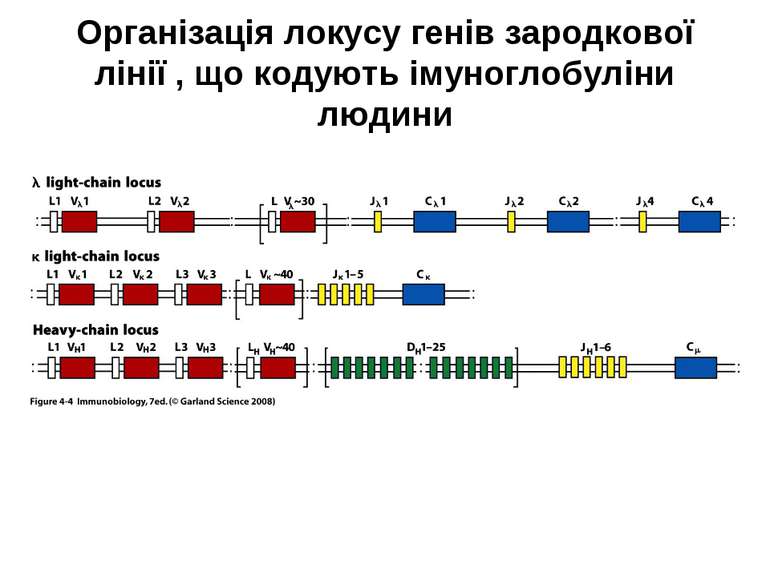
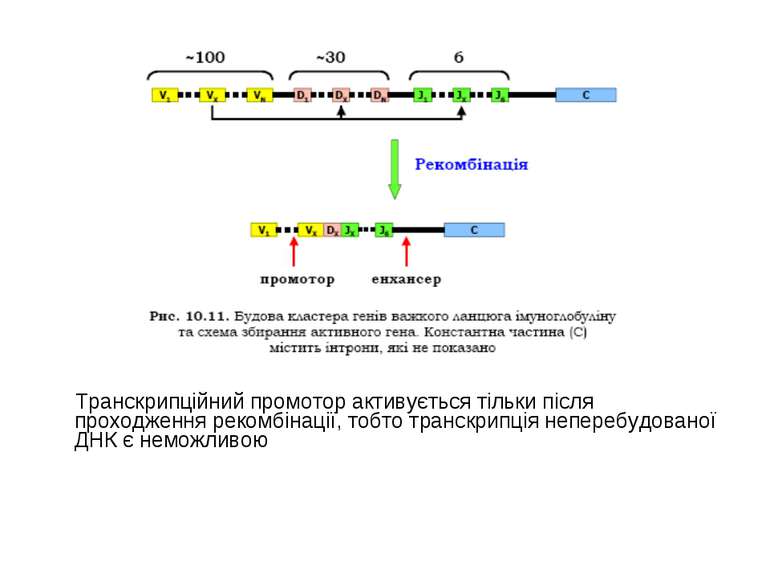
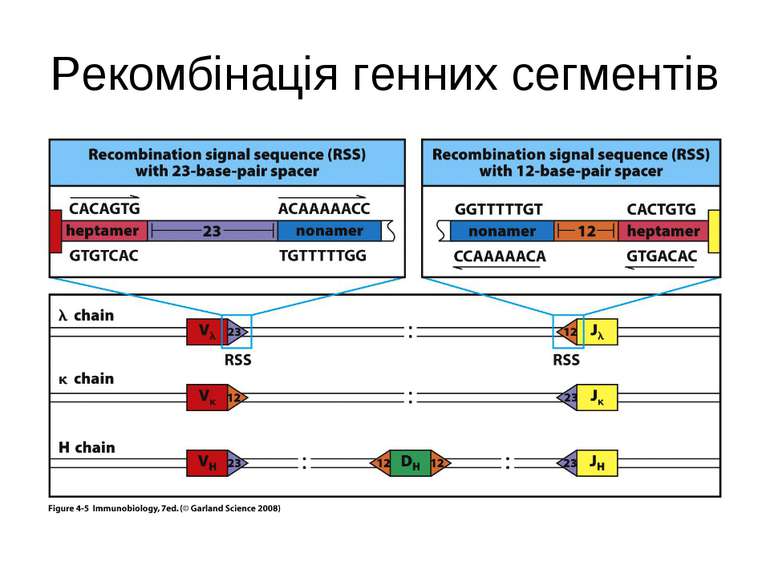
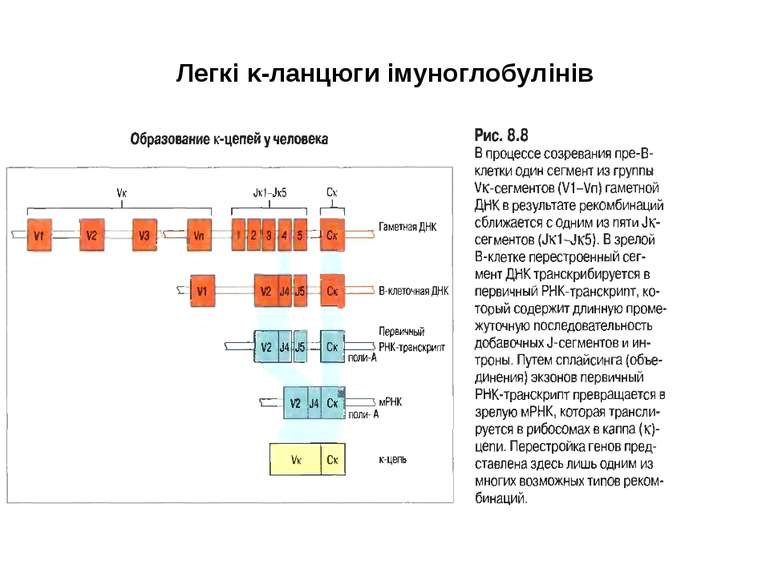
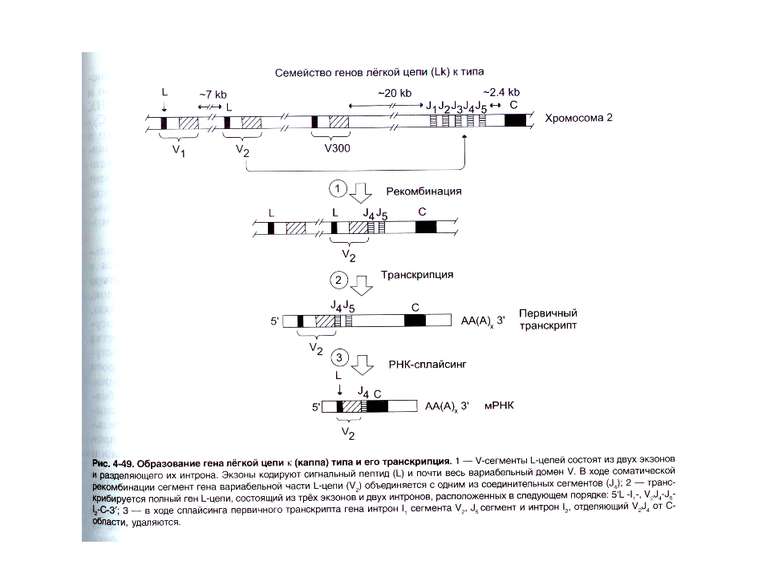
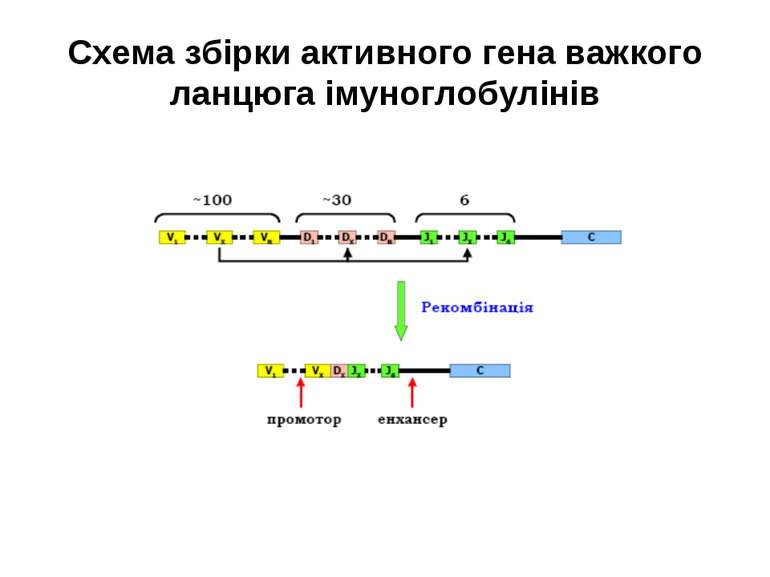
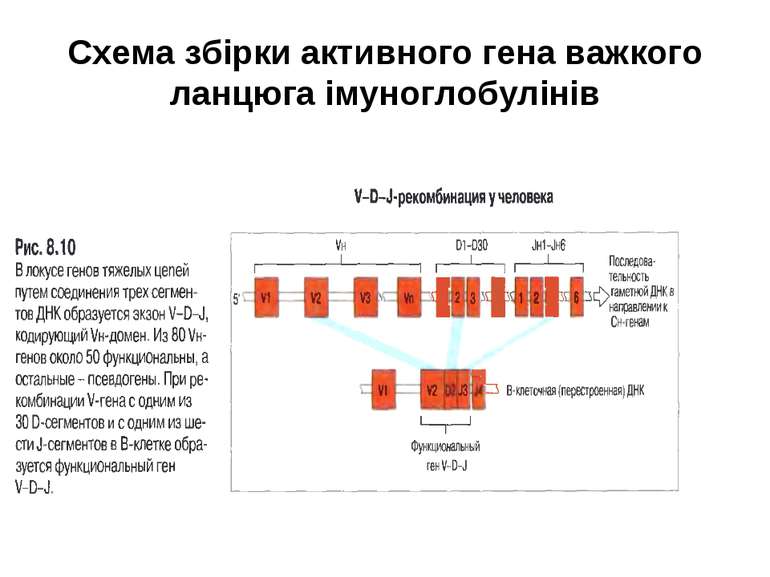
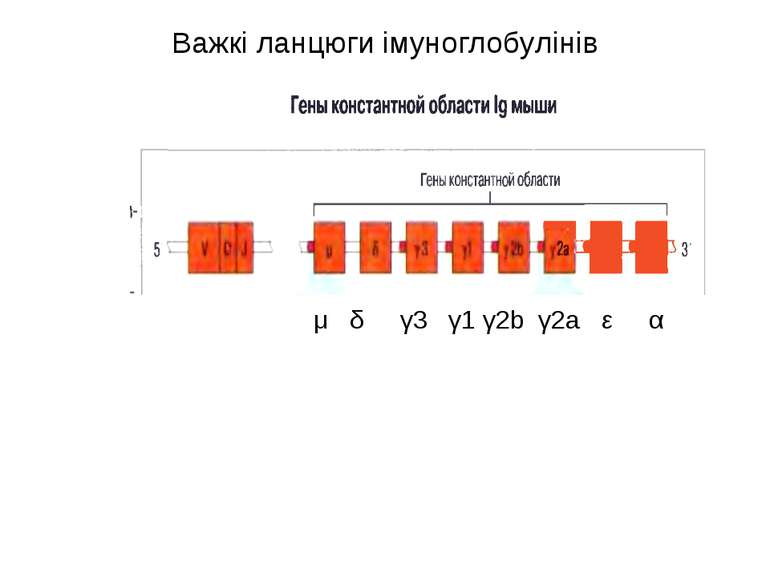
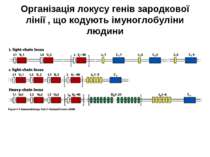
Гени імуноглобулінів. Біосинтез антитіл Три кластери (локуси) генів імуноглобулінів: Н, κ, λ. У людини – Н- 14 хромосома, κ- 2 хромосома, λ-22 хромосома. У миші- Н- 12 хромосома, κ- 6 хромосома, λ-16 хромосома. Входять- V, C гени важких і легких ланцюгів, J-гени (joining) , D-гени (diversity). Кластер генів λ -ланцюга . 30 V генів, 4 (6) пар J λ -і Сλ –генів-є зчепленими між собою. 2. Кластер генів κ –ланцюга. 40 V генів, 5 J-генів, 1 С κ -ген. Кластер генів Н-ланцюгів. Більше 1000 V- генів (функційні –51), 27 D-генів, 6 J-генів та С-гени всіх класів імуноглобулінів. V-сегменту передує ділянка ДНК, що кодує лідерний пептид (L).
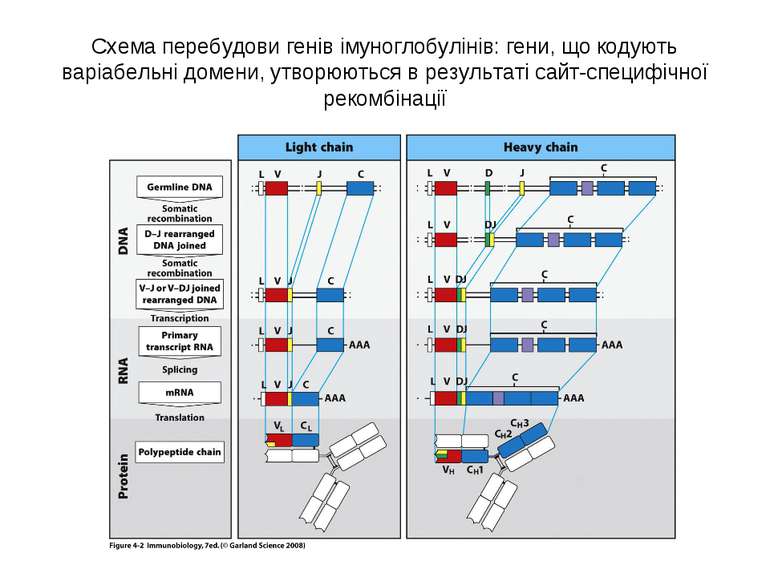
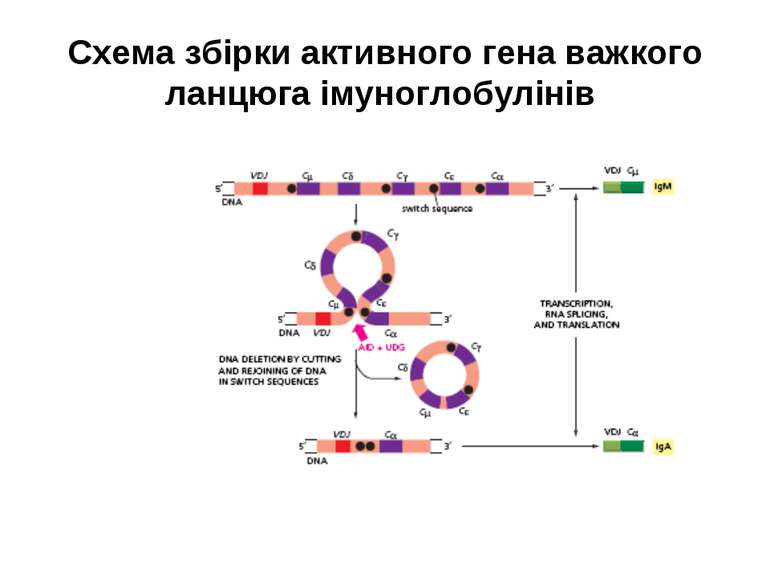
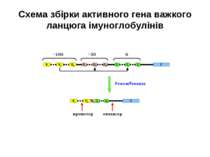
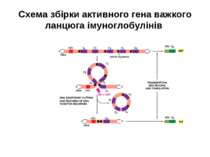
Реорганізація (реаранжування) генів імуноглобулінів 1) сайт-специфічна рекомбінація VJ ( для генів легких ланцюгів)-одна рекомбінаційна подія; 2) сайт-специфічна рекомбінація DJ (1) і V+DJ (2)- для генів важкого ланцюга- дві рекомбінаційні події; 3) транскрипція цілого блоку V(D) J- intron- С; 4) сплайсинг РНК з утворенням функціонального транскрипту V(D)JC; 5) трансляція; 6) посттрансляційне відщеплення лідерної послідовності.
Транскрипційний промотор активується тільки після проходження рекомбінації, тобто транскрипція неперебудованої ДНК є неможливою
Схема перебудови генів імуноглобулінів: гени, що кодують варіабельні домени, утворюються в результаті сайт-специфічної рекомбінації
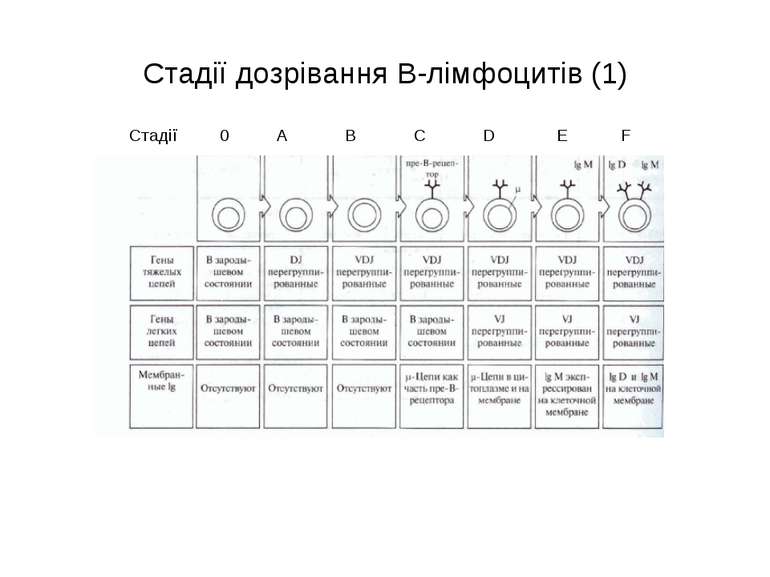
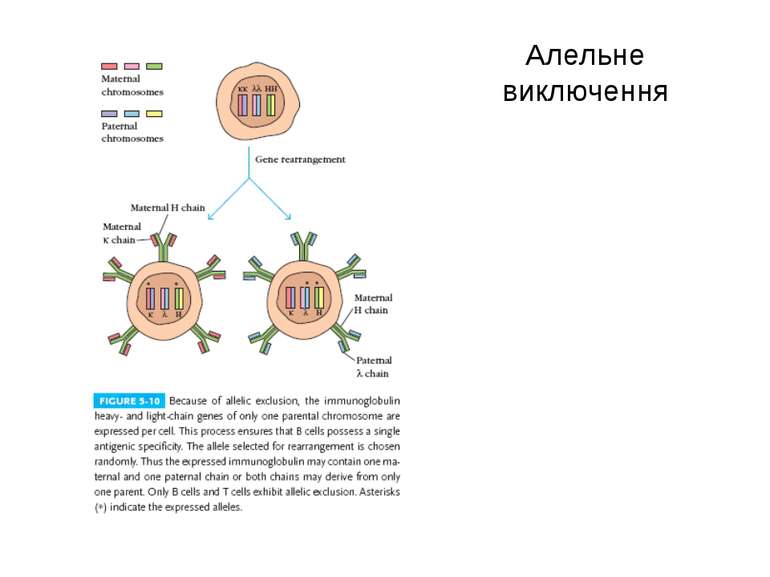
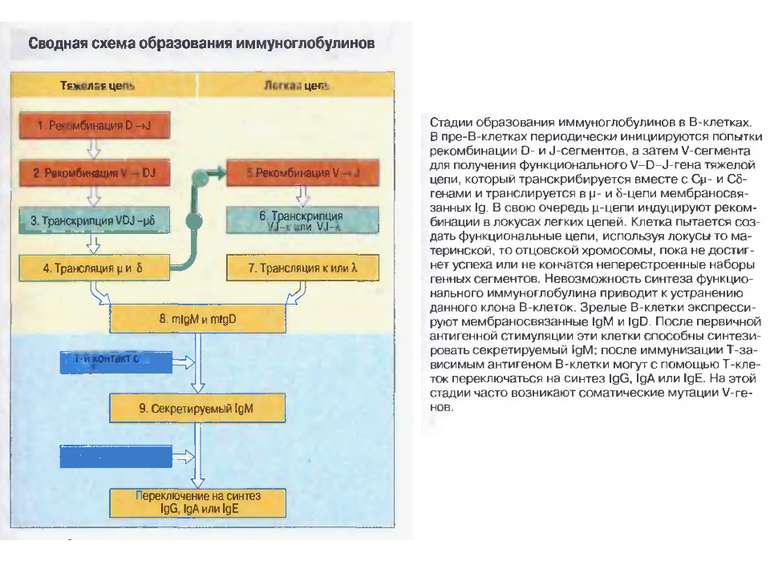
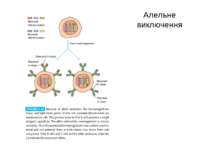
Стадії дозрівання В-лімфоцитів (2) 0-лімфоїдна стовбурова кровотворна клітина. А-ранні про-В-клітини-не мають рецепт. В клітин, початок реаранжування DJ-сегментів в локусі важкого (Н) ланцюга імуноглобулінів, може відбуватись в обох гомологічних хромосомах. В- пізні про-В-клітини- V- DJ реаранжування генів- підлягає алельному виключенню- тобто проходить лише в одній хромосомі. Отже на цій стадії перебудовуються гени і екс- пресується важкий ланцюг в комплексі з сурогатним легким, що є сигналом для позитивної селекції цих клітин. С- великі пре-В-клітини- експресують пре-В-клітинний рецептор, мають форму бластів, утворюють клони : 6 поділів, не працюють рекомбінази. D- малі пре-В-клітини, перебудова генів легкого κ–ланцюга, який експресується на мембрані разом з перебудованим μ- важким ланцюгом. Непродуктивність одного гена-включається інший, ні - перебудова генів в λ-локусі. E- незрілі В-клітини, мають сформовані Ig M-рецептори, але підлягають негативному відбору. На цій стадії В клітини виходять з кісткового мозку до селезінки і вступають на стадію дозрівання. F- зрілі наївні В-клітини, які рециркулюють (до зустрічі з антигеном) . Таким чином, перебудова генів та синтез білкового продукту пов’язана з: А) перебудовою важкого ланцюга Іg на стадії про-В-клітини Б) На стадії пре-В-клітин- перебудова легкого ланцюга Іg.
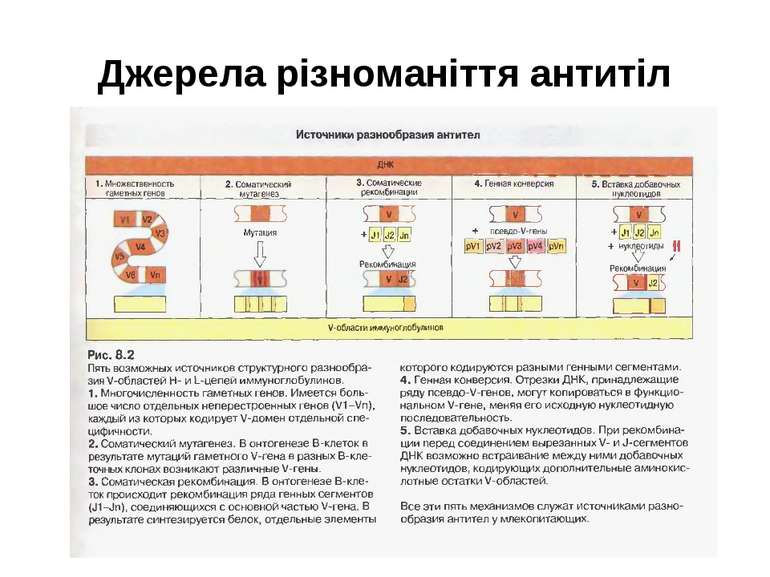
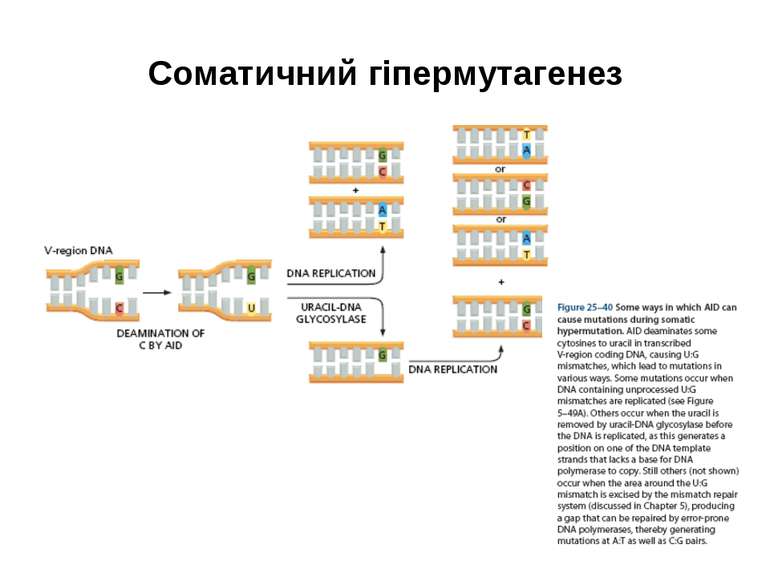
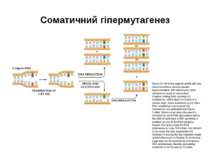
Джерела різноманіття антитіл Виділяють 6 можливих джерел різноманіття Іg : 1) множинність гаметних генів (існування копій майже кожного генного сегмента); 2) соматичні рекомбінації (урізноманітнення за рахунок сайт- специфічної рекомбінації варіабельних ділянок молекули); 3) вбудовування (інсерції) та делеції додаткових нуклеотидів=junction diversity=урізноманітнення з'єднань; 4) механізм комбінаторної диверсифікації (утворення можливих варіантів імуноглобулінів); 5) соматичний мутагенез; 6) генна конверсія (активація роботи псевдо-генів).
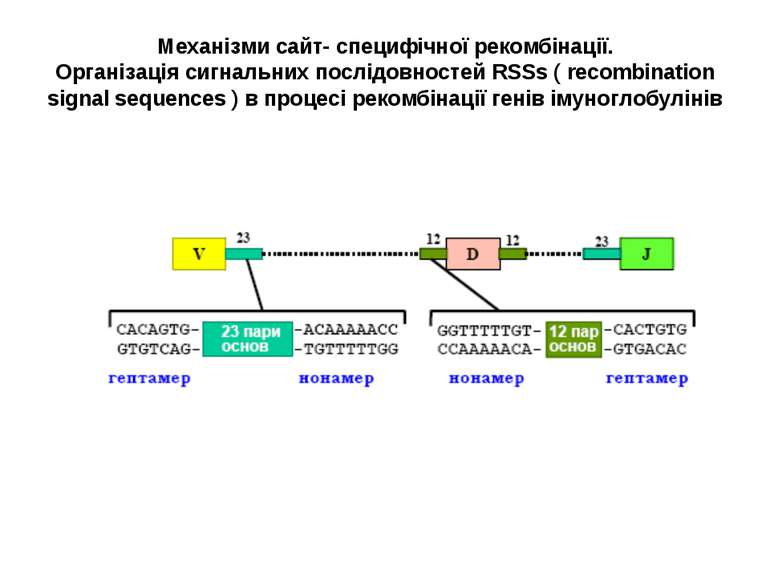
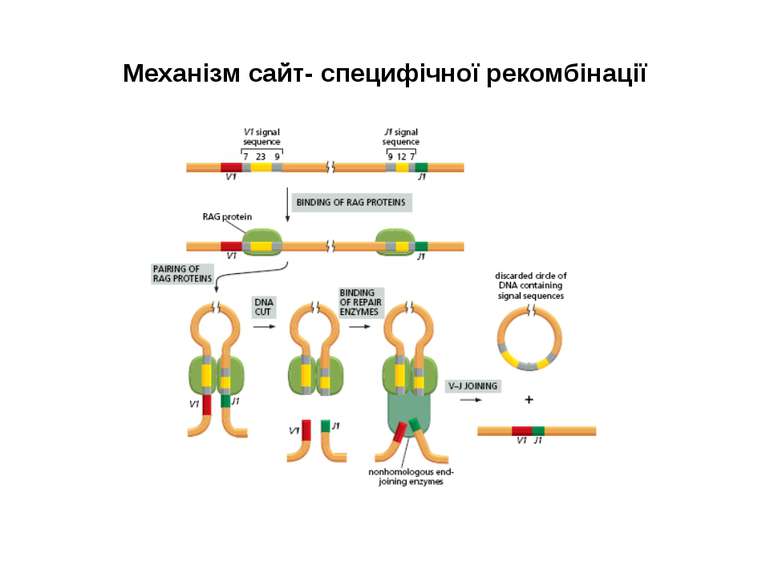
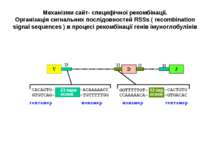
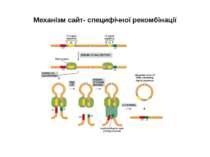
Механізми сайт- специфічної рекомбінації. Організація сигнальних послідовностей RSSs ( recombination signal sequences ) в процесі рекомбінації генів імуноглобулінів
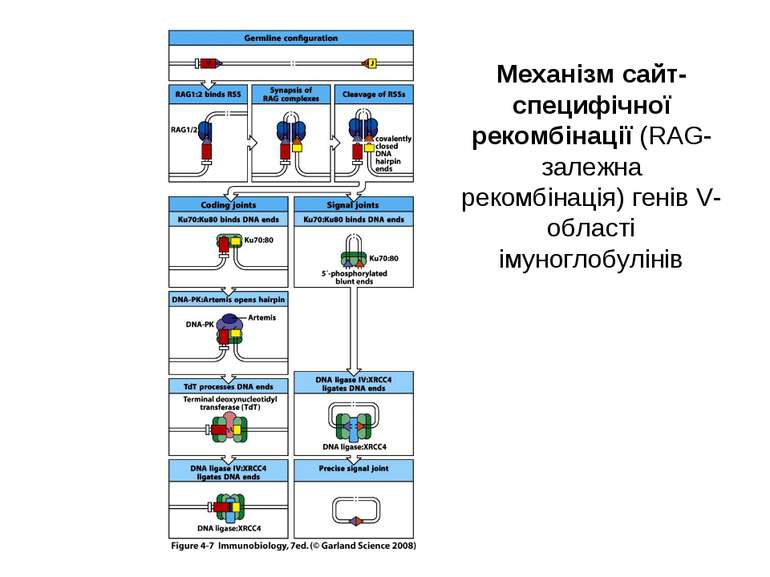
Механізми сайт- специфічної рекомбінації. На етапах рекомбінації залучені: Продукти генів RAG1 і RAG2 -рекомбінази. Саме початок експресії цих генів є сигналом для початку перебудови генів імуноглобулінів. Крім того у складному процесі рекомбінації на етапі з'єднання кінців ДНК беруть участь білки, які працюють в системі репарації дволанцюгових розривів ДНК- [ консервативний процес NHEJ = nonhomologous DNA end-joining = негомологічне з'єднання кінців ДНК], модифікації кінців розривів і т. д., а саме: ДНК-залежна протеїнкіназа (DNA-PK) , білок Ки (гетеродимер Ки 70:80), який асоціює з DNA-PK, ендонуклеаза Artemis, процес лігування відбувається за участі ДНК-лігази IV та ДНК-репараційного білка XRCC4 , ендо- та екзонуклеази, термінальні дезоксинуклеотидил-трансферази (TdT), полімерази та інші.
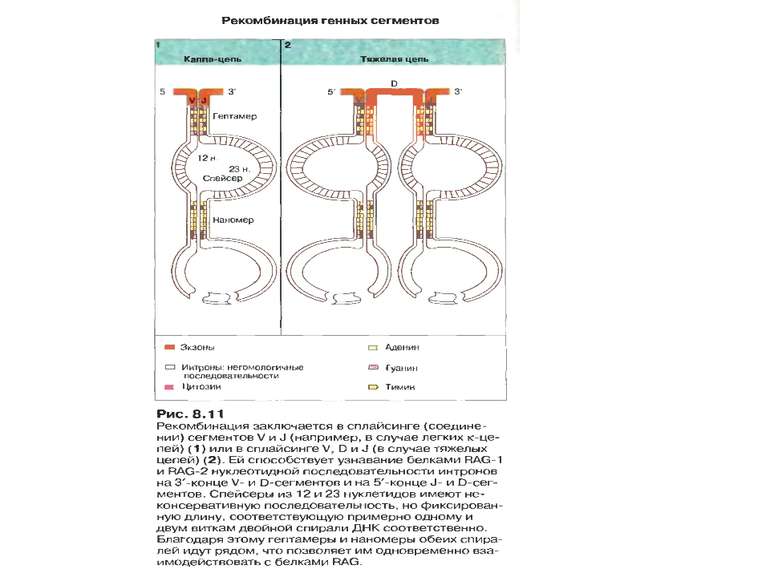
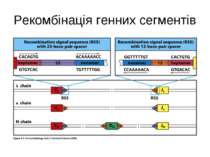
Механізм сайт- специфічної рекомбінації (RAG-залежна рекомбінація) генів V-області імуноглобулінів
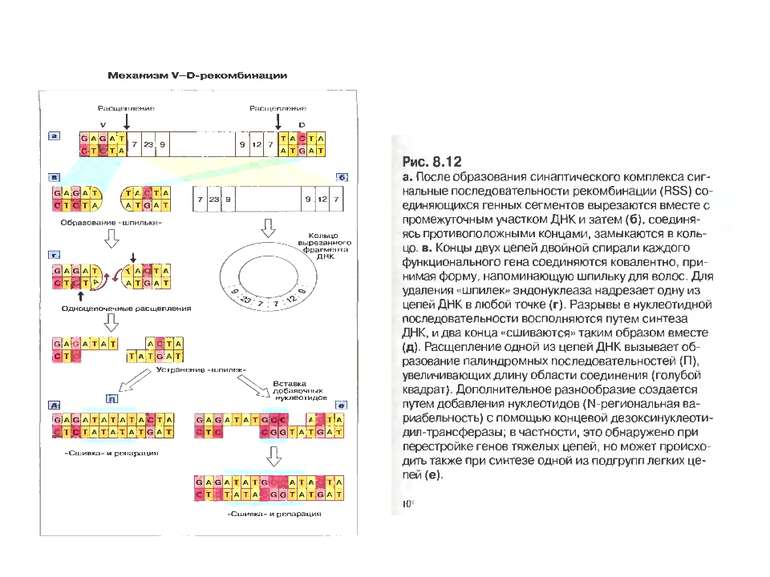
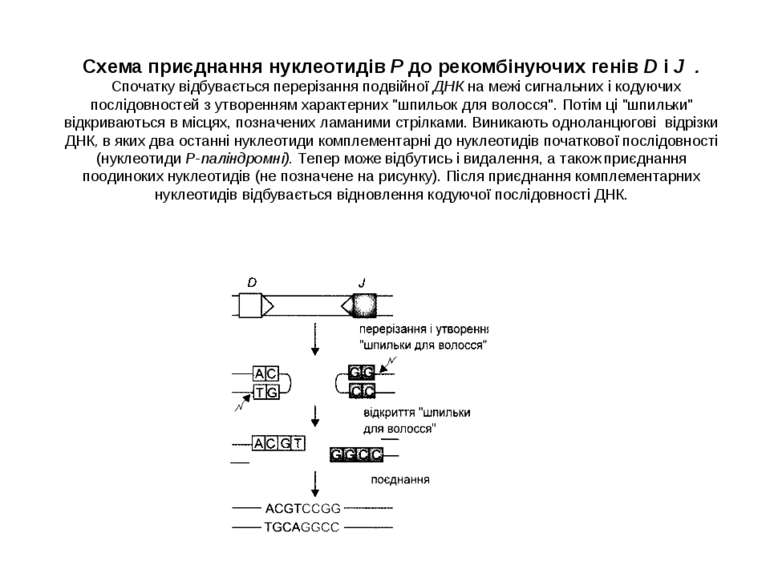
Схема приєднання нуклеотидів Р до рекомбінуючих генів D і J . Спочатку відбувається перерізання подвійної ДНК на межі сигнальних і кодуючих послідовностей з утворенням характерних "шпильок для волосся". Потім ці "шпильки" відкриваються в місцях, позначених ламаними стрілками. Виникають одноланцюгові відрізки ДНК, в яких два останні нуклеотиди комплементарні до нуклеотидів початкової послідовності (нуклеотиди Р-паліндромні). Тепер може відбутись і видалення, а також приєднання поодиноких нуклеотидів (не позначене на рисунку). Після приєднання комплементарних нуклеотидів відбувається відновлення кодуючої послідовності ДНК.
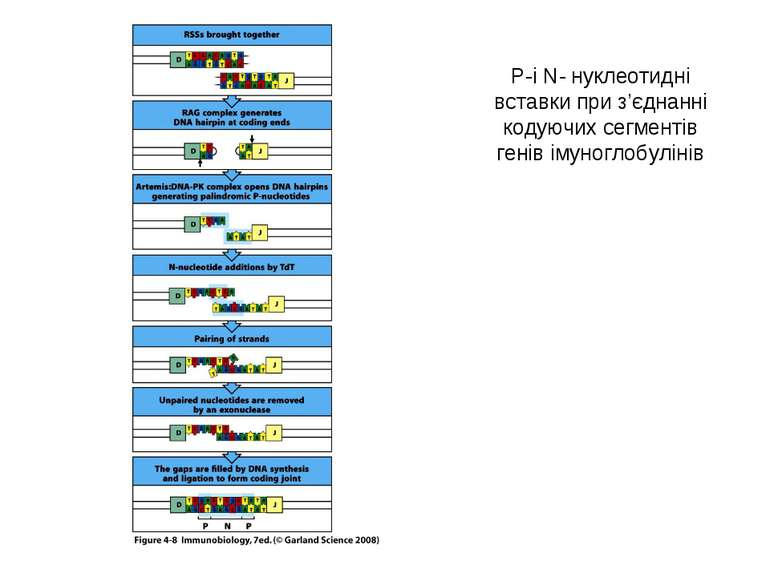
Механізми диверсифікації (різноманітності) =(diversification) імуноглобулінів Комбінаторна диверсифікація (див. табл.кластерів генів) 1) L -ланцюги : λ -ланцюг - VJ: 30Vх 4J λ = 120; κ –ланцюг- VJ: 40V х 5Jк =200; 120 + 200= 320 варіантів L-ланцюга 2) Н ланцюги: DJ: 27D х 6J = 162; V(DJ): 51 х 162 = 8262; D ген має три вірогідні рамки зчитування: 8262 х 3 = 24786 варіантів Н-ланцюга. 3) Комбінація Н х L: 320 х 24786 = 7,9 х 106 4. Мутації у сайтах рекомбінації, генна конверсія, випадковість сайтів розщеплення за участі ендонуклеази Artemis, додавання Р і N-нуклеотидів - додають різноманітності >108
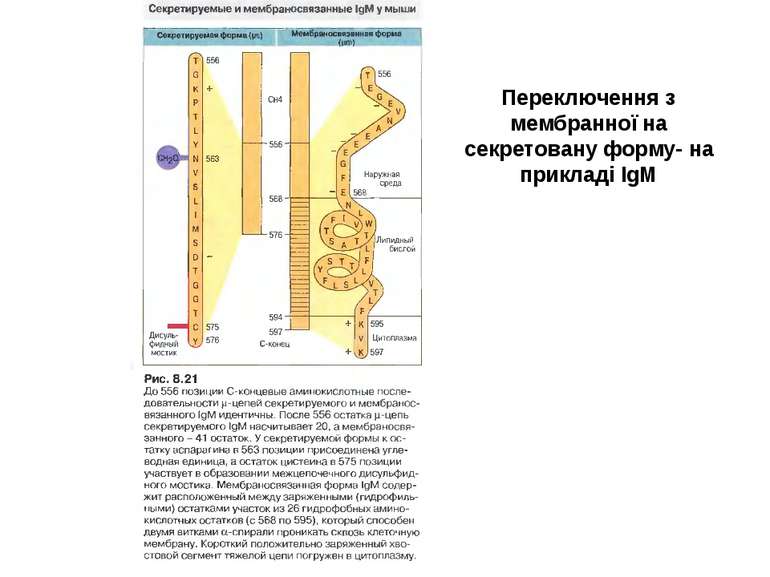
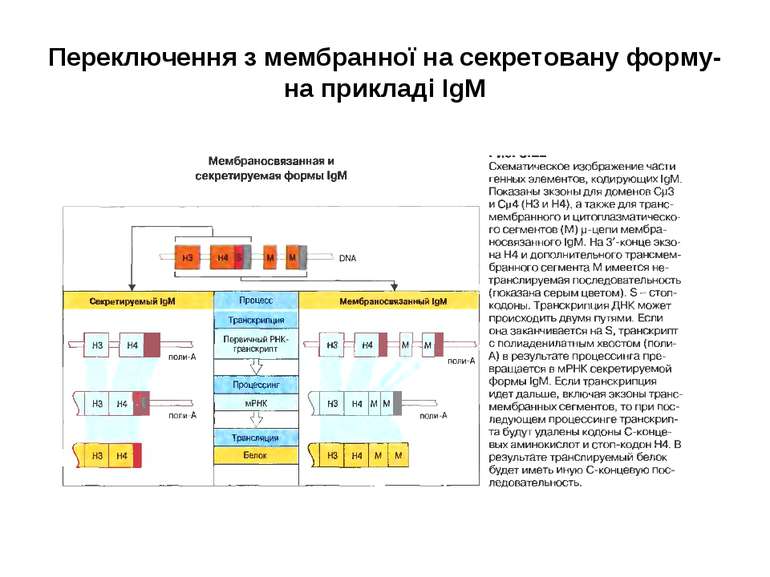
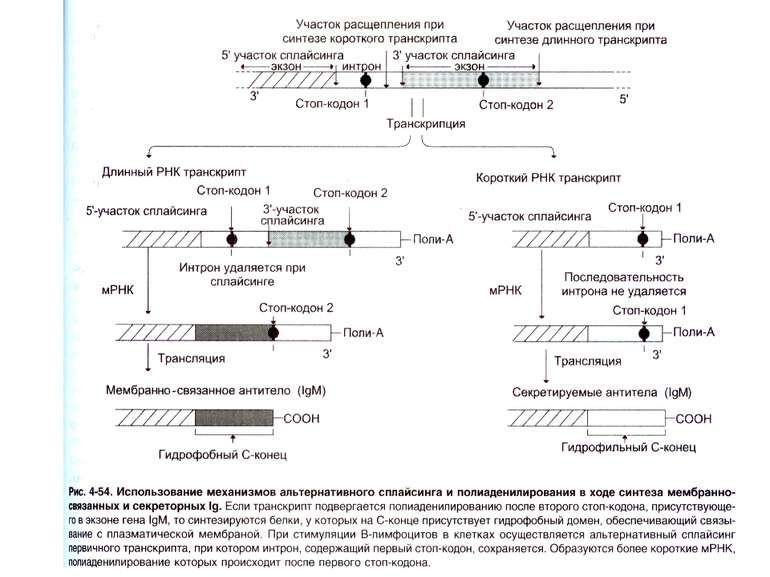
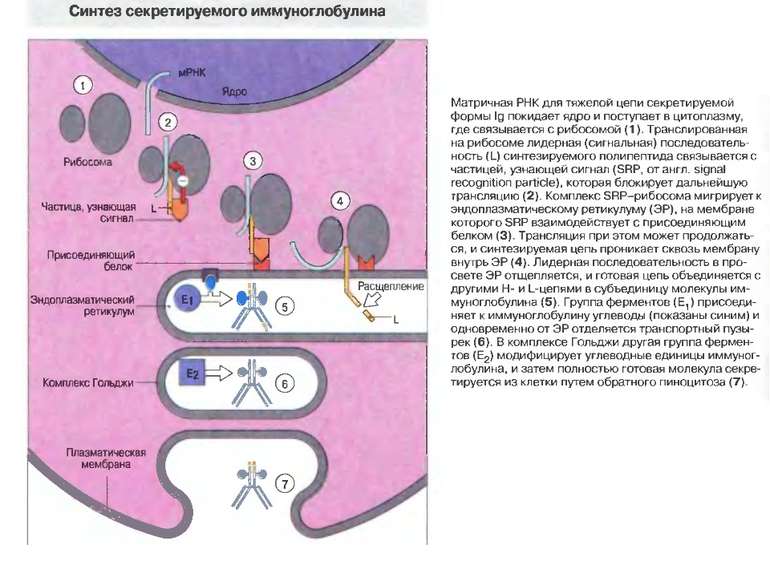
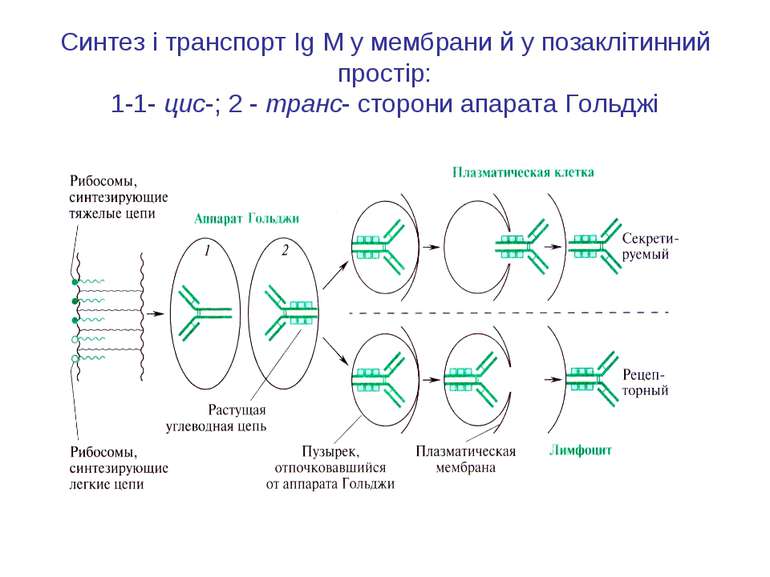
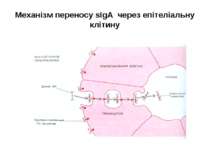
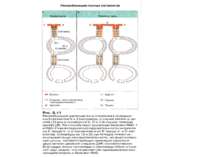
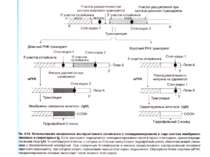
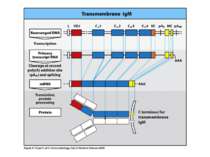
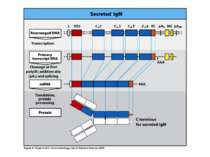
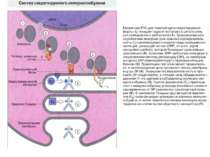
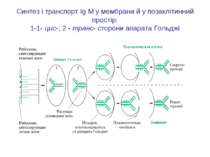
Синтез і транспорт Ig М у мембрани й у позаклітинний простір: 1-1- цис-; 2 - транс- сторони апарата Гольджі
Схожі презентації
Категорії