Презентація на тему:
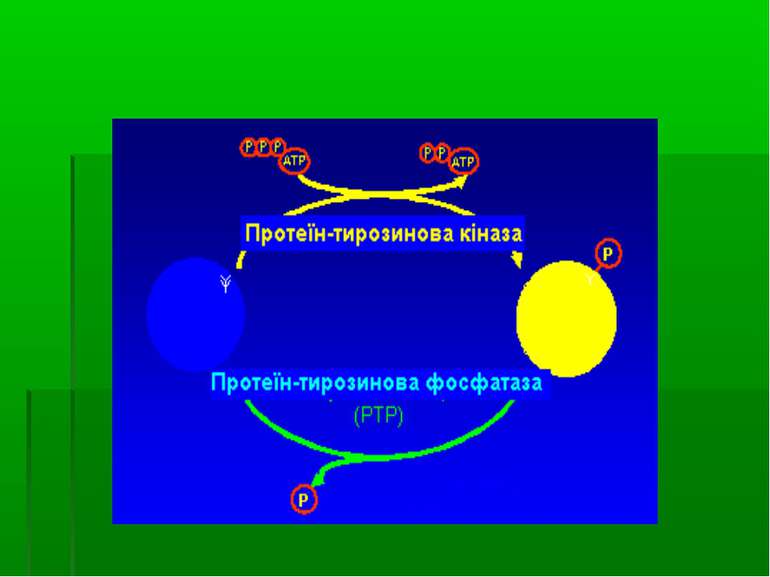
Фосфорилювання тирозину
Завантажити презентацію
Фосфорилювання тирозину
Завантажити презентаціюПрезентація по слайдам:
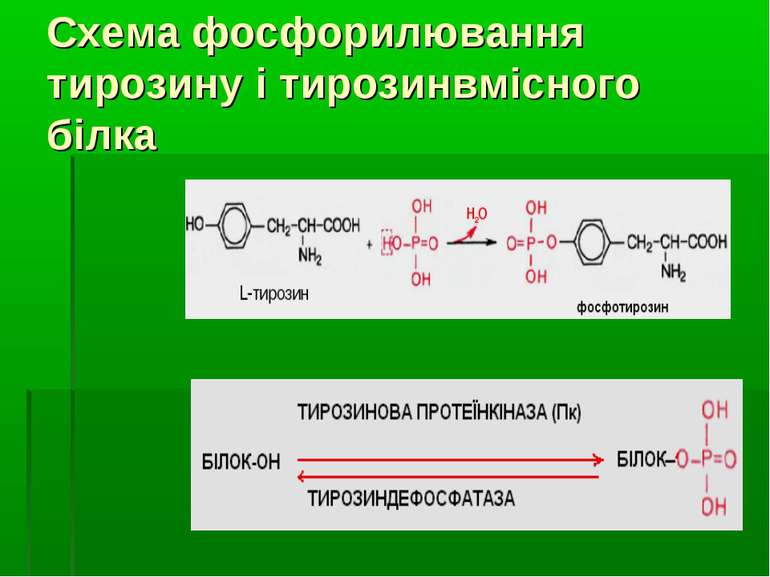
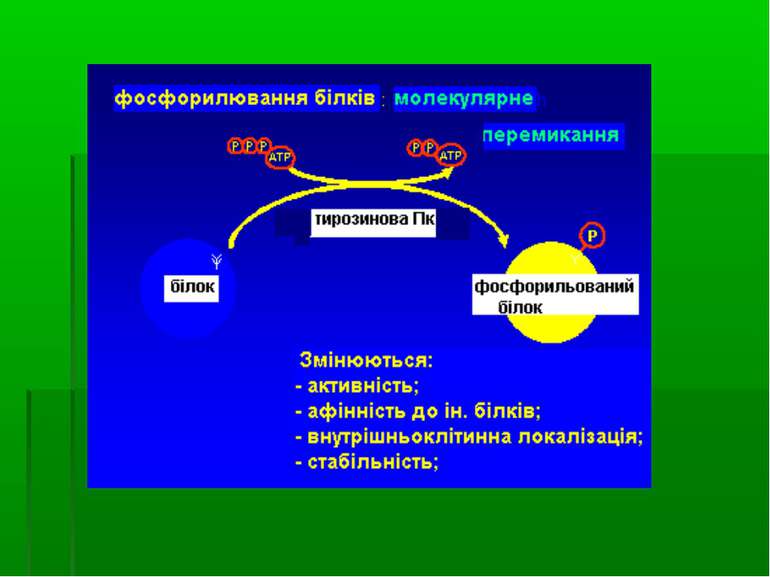
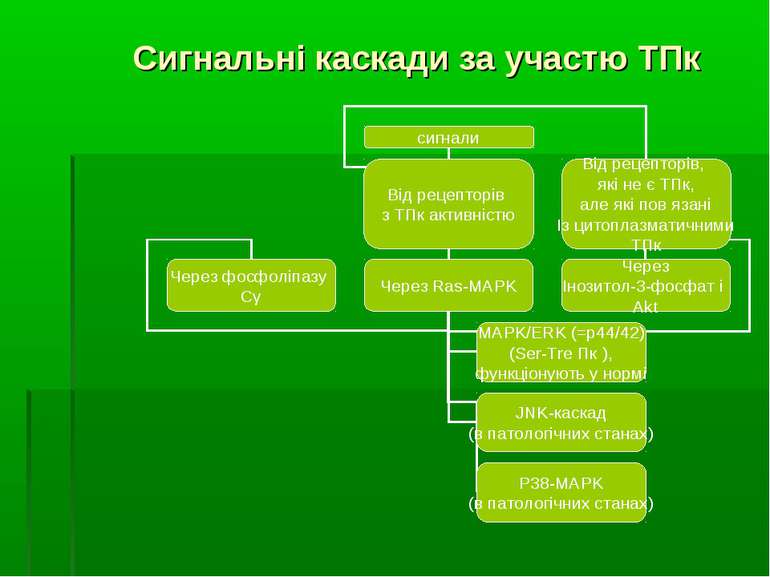
ФОСФОРИЛЮВАННЯ ТИРОЗИНУ ЯК МЕХАНІЗМ ВНУТРІШНЬОКЛІТИННОЇ РЕГУЛЯЦІЇ шляхом фосфорилювання ОН-групи залишку тирозину
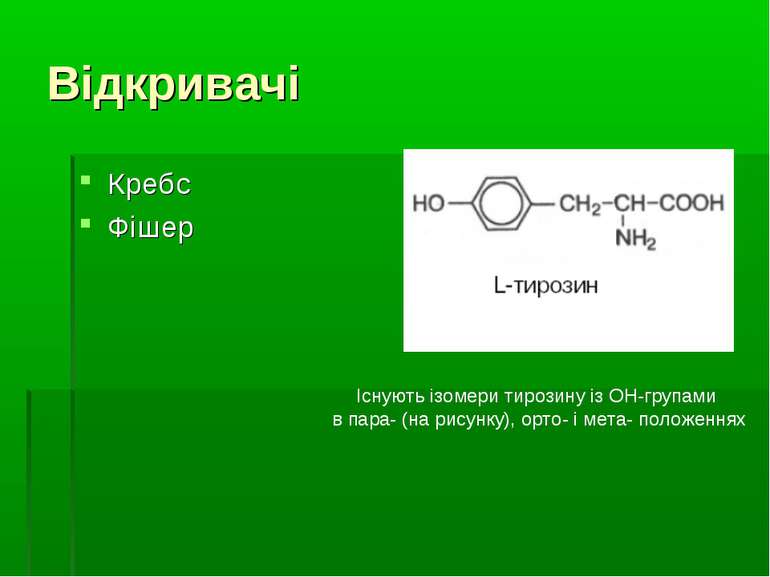
Відкривачі Кребс Фішер Існують ізомери тирозину із ОН-групами в пара- (на рисунку), орто- і мета- положеннях
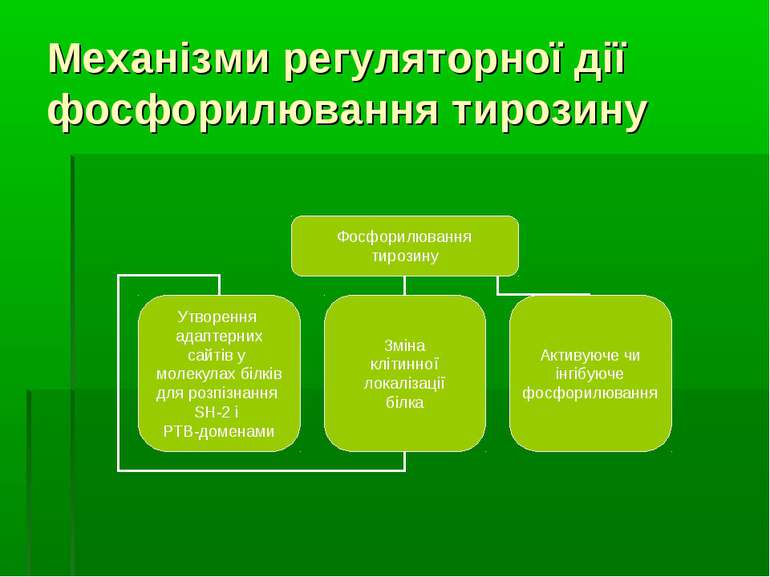
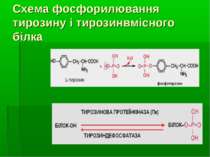
Для розуміння ролі фосфорилювання тирозину у функціонуванні цитоплазматичних білків необхідно розглянути поняття “білкових модулів” (=“адаптерних доменів”)
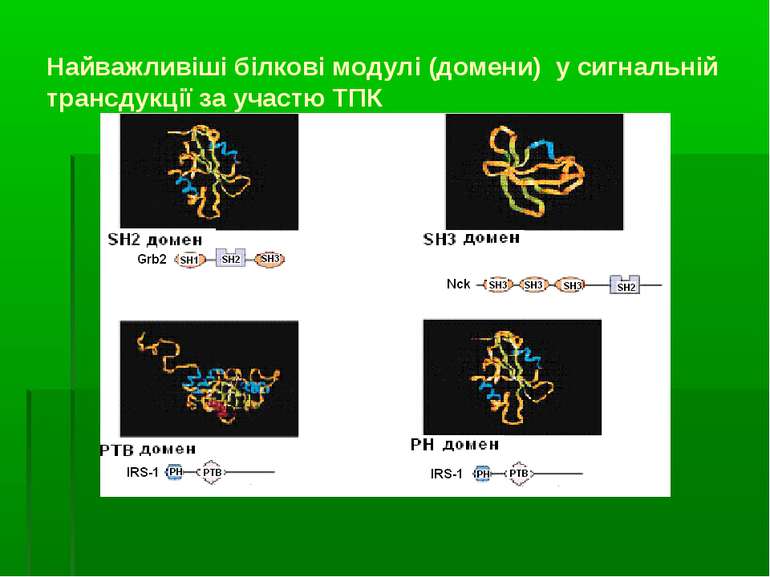
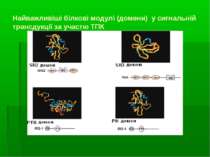
Найважливіші білкові модулі (домени) у сигнальній трансдукції за участю ТПК Сигнальна трансдукція в клітині відбувається завдяки білок-білковим й білок-фосфоліпідним взаємодіям, що базуються на існуванні “білкових модулей”. Білки з 2-ма (чи більше) білковими модулями асоціюють із 2-ма (або більше) партнерами по зв язуванню, що результується в утворенні “функціональних комплексів” – або з активованим поверхневоактивним рецептором, або вільно у цитоплазмі Найважливіші сигнальні білкові модулі: А) ті, що розпізнають олігопептидні мотиви: SH2-домени (Src homology region 2 ) – (біля 100 а/к), високоафінно зв язуються із пептидними мотивами, що містять фосфотирозин). Вони присутні в усіх нерецепторних ТПК і в основному локалізовані на їх N-кінці. Вони також у великій к-ті є у інших білках. РТВ-модулі (Phosphotyrosine binding domane, інша назва - Phosphotyrosine Interaction Domain, PID ) – також розпізнають і зв язують фосфотирозинові послідовності, але за іншим механізмом SH3- (біля 60-ти амінокислот), WW-модулі – зв язують пролін-багаті послідовності мішені (8 – 10 залишків проліну); Б) ті, що розпізнають білки й ліпіди: РН (pleckstrin homology, біля 100 а/к) - забезпечують локалізацію білків у ПМ і дозволяють білкам асоціювати з утворенням сигнального комплексу. Деякі з них діють, безпосередньо зв язуючись із мемебранними ліпідами. Механізми: зв язування РН домену з 3-фосфорильованими інозитоловими ліпідами, що швидко генеруються у мембрані через дію РІ3-кінази. Інші PH-домени мають меншу спорідненість до мембранних ліпідів, але зв язуються із білками. PH-домени містять більшість регуляторних малих ГТФ-зв язуючих білків (напр., Ras and Rac/Rho), велика к-ть важливих протеїнкіназ (ПкВ (= Akt), тирозинова Пк Брутона (Bruton's tyrosine kinase, =Btk).
Приклад: утворення адаптерного SH2-домену та його структура Центральна вісь SH2 домену складається із ділянок складчастого шару A, B, C і D. Зв язваний фосфопептид роз єднує шари так, що фосфотирозин лежить з одного боку, а пептидні залишки від pTyr+1 до pTyr+5 - з іншого. Ключовий залишок Arg, що відповідає за координацію фосфотирозину, є серед усіх SH2 доменів. Залишки в BG і EF петлях визначають специфічність різних SH2 доменів відносно залишків амінокислот, що розташовані на С-кінці від фосфотирозину. Малюнок: -β-складчастий шар – зелений; -α-спіралі – сині - сполучна петля - померанчева - зв язаний пептид: атоми С – сірі; N – блакитні; О - червоні; Р – ліловий - показані позиції фосфотирозину й амінокислотних залишків 1, 2 і 3 на С-кінці від нього У вкладці показано 2 залишки аргініну (Arg): один із спіралі А, а інший – з шару В, що здійснюють ключові контакти з фосфотирозином (pTyr).
Специфічне розпізнання SH2-доменом фосфотирозин-вмісних мішеней Src-подібні SH2 домени (Src, Fyn, Hck and Nck) специфічні до негативно заряджених залишків у позиціях pTyr+1 і pTyr+2, і використовують гідрофобний «карман» для вибору аліфатичних залишків у положенні pTyr+3. Фосфоліпаза С-подібні SH2 домени використовують довгий гідрофобний «ключ» для вибору аліфатичних залишків у положеннях від pTyr+1 до pTyr+5. Позитивно заряджені залишки Арг взаємодіють із 2-ма атомами кисню фосфатів негативно зарядженого фосфотирозину через водневий зв язок; це спричиняє або пряму активацію білка, або його власне фосфорилювання. Т.я. всі SН2-домени зв язуються із фосфотирозином, вони не взаємодіють із нефосфорильованим тирозином
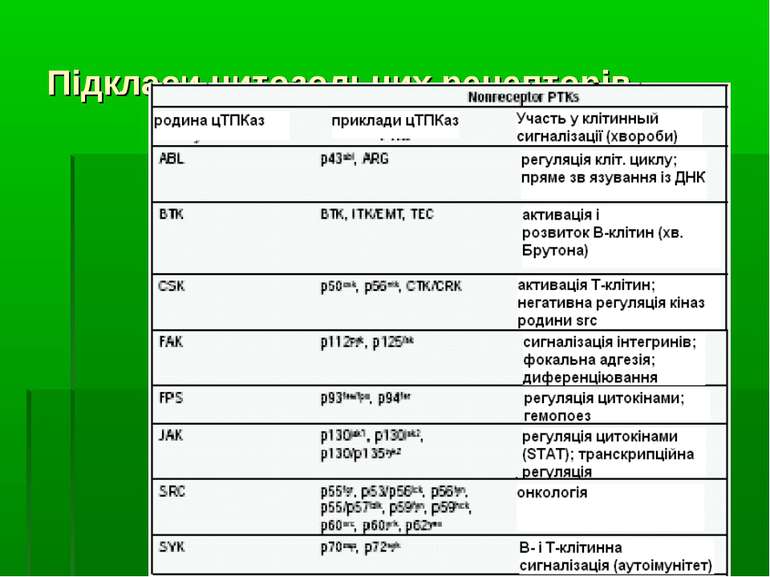
Основні групи білків, що містять SH2- і SH3- домени: Група І - білки, що мають ферментативну активність або відомі функції: 1. Цитоплазматичні тирозинкінази родин Src, Abl, Csk (SH2-домен и SH3- домен). 2. Фосфоліпаза Сγ (два SH2-домени й SH3- домен). 3. GAP-120 (білок, що активує ГТФазу білка Ras (SH2-домен и SH3- домен)). 4. Тирозинфосфатази PTP1C (два SH2-домени) й PTP1D (SH-PTP2/SYP) (два SH2-домени). 5. Регуляторна субодиниця p-85 фосфатидилінозитол-3-кінази (два SH2-домени й SH3- домен). Група ІІ (адаптерні білки, що складаються виключно з SH2- SH3- доменів: Білок Shc (SH2-домен), білок Nck (SH2-домен, три SH3-домени), білок Crk (SH2-домен, два SH3-домени), Grb2 (growth-factor-receptor-binding protein – білок, що зв язується із рецепторами факторів росту (SH2-домен, два SH3-домени).
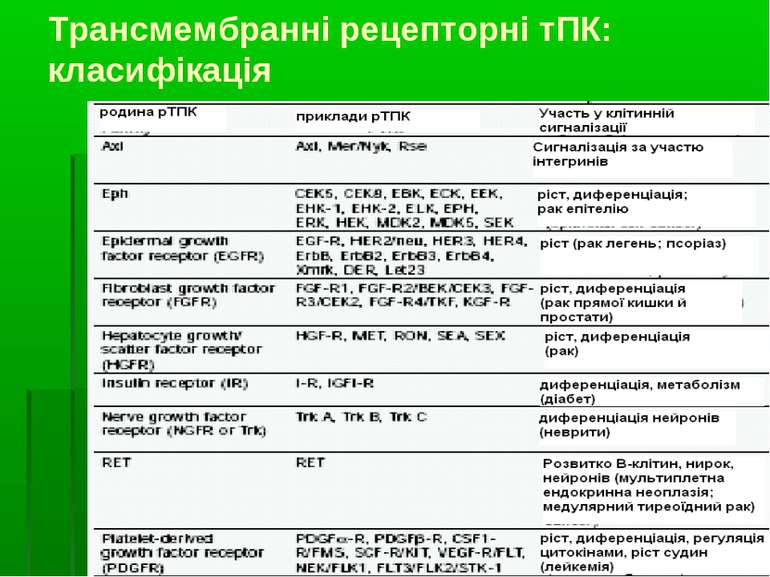
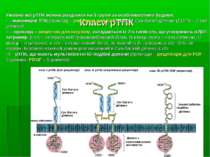
Функція, номенклатура та класифікація тирозинових протеїнкіназ Функція – перенесення залишку фосфорної кислоти на ОН-групу тирозину молекул білків АТФ:протеїн-тирозин-О-фосфотрансфераза КФ 2.7.10.1 (трансмембранні) КФ 2.7.10.2 (цитозольні) 15 підкласів трансмембранних ТПк (різняться за структурою позаклітинних доменів); 8 підкласів цитозольних ТПк (містяться в цитозолі, ЕПР, ядрі та ін.)
Будова трансмембранних ТПк Пронизують ПМ 1 раз Мають: - глікозильований зовнішній ліганд-зв язуючий домен; в його складі різні рТПК можуть мати: - Cys-багаті ділянки; - IG-подібні ділянки; - повтори, характерні для фібронектину ІІІ; - kringle домени; - лейцин-багаті ділянки. Позаклітинний домен містить зв язуючий сайт для лігандів рТПК. Лігандами можуть бути як водорозчинні фактори і білки позаклітинного матриксу, так і поверхневі білки, що експресуються на інших клітинах. Позаклітинний домен також може бути залучений у димеризацію рТПК – процес, критичний для активації внутрішньої тирозинкіназної активності. - трансмембранний домен, що 1 раз пронизує ПМ - гідрофобний сегмент із 22-26 амінокислот, розташований у ПМ. Він обмежений пролін-багатою ділянкою на N-кінці і кластером лужних амінокислот – на С-кінці. Між різними рТПК в цій ділянці дуже низький ступінь гомології – навіть між близькими рТПК - внутрішньоклітинний домен, що складається із каталітичного домену й низки сайтів для аутофосфорилювання, що регулюють каталітичну функцію й служать “докерними сайтами” для SH2-вмісних білків. Каталітичний домен рТПК є висококонсервативним і за структурою подібним до каталітичних доменів (SH1-доменів) нерецепторних (цитозольних) ТПК
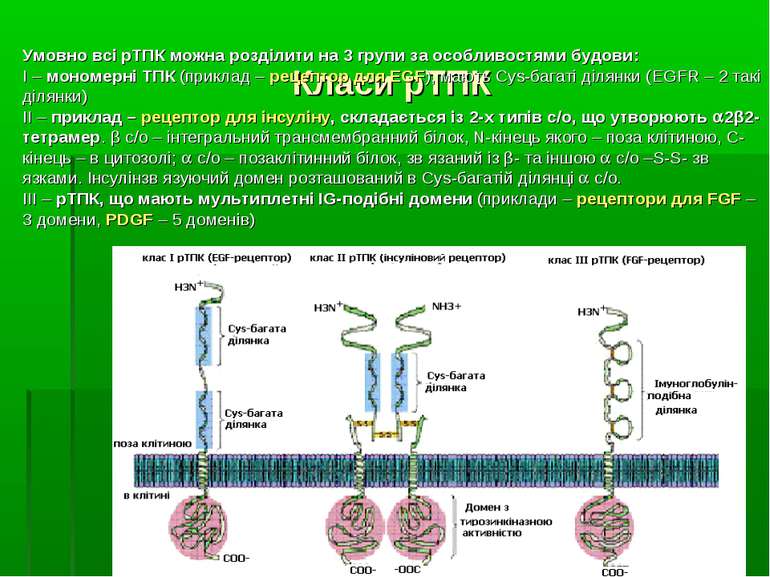
Класи рТПК Умовно всі рТПК можна розділити на 3 групи за особливостями будови: І – мономерні ТПК (приклад – рецептор для EGF), мають Cys-багаті ділянки (EGFR – 2 такі ділянки) ІІ – приклад – рецептор для інсуліну, складається із 2-х типів с/о, що утворюють 2β2-тетрамер. β с/о – інтегральний трансмембранний білок, N-кінець якого – поза клітиною, С-кінець – в цитозолі; с/о – позаклітинний білок, зв язаний із β- та іншою с/о –S-S- зв язками. Інсулінзв язуючий домен розташований в Cys-багатій ділянці с/о. ІІІ – рТПК, що мають мультиплетні IG-подібні домени (приклади – рецептори для FGF – 3 домени, PDGF – 5 доменів)
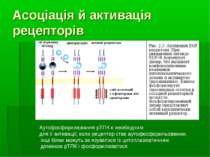
Як функціонують рТПК? Сигнальна трансдукція пов язана із гормон-індукованою асоціацією рецепторів. Зв язування гормону запускає конфомаційні зміни у позаклітинному домені, що індукує асоціацію олігомерів. Остання дозволяє взаємодіяти цитоплазматичним доменам, що результується у стимулюванні цитоплазматичної тирозинкіназної активності і у аутофосфорилюванні цих доменів Напр., для інсулінового рецептору: зв язування гормону індукує взаємодії між 2-ма половинками (α,β): α,β+ α,β Аутофосфорилювання залишків тирозину дозволяє рТПК залишатися активними навіть після того, як гормон, що подіяв, дисоціює від рецептора Тирозинкіназна активність рецептору може бути заінгібована фосфорилюванням Сер/Тре залишків внутрішньоклітинного домену за участю ПкС, ПкА, що вказує на прямий зв язок між рТПК і кількома вторинними месенджерами (цАМФ, І3Ф, ДАГ, Са++) ЗАГАЛЬНА СХЕМА ФУНКЦІОНУВАННЯ рТПК: Зв язування ліганду → димеризація → активація тирозинкінази → аутофосфорилювання С-кінцевих залишків тирозину → утворення ділянок для зв язування білків-субстратів, що містять SH2- домени, напр., Src-кінази. Т.ч., SH2-домен робить білок мішенню для фосфорилювання рТПК. Цитоплазматичний -SH2-вмісний білок, що як би “прилип” до рецептору, після фосфорилювання по залишках тирозину сам стає центром зв язування SН2-вмісних цитозольних білків. Внаслідок такої послідовності реакцій на цитоплазматичному боці рецептора може зібратися “гірлянда” білків Фосфорилювання білків-мішеней веде до зміни поведінки всієї клітини, т.я. змінює: - мембранний транспорт іонів й амінокислот, - транскрипцію генів й синтез білків; Механізм таких змін: кіназна, фосфатазна чи ДНК-зв язуюча активність білків-мішеней через присутність у них доменів із відповідними активностями
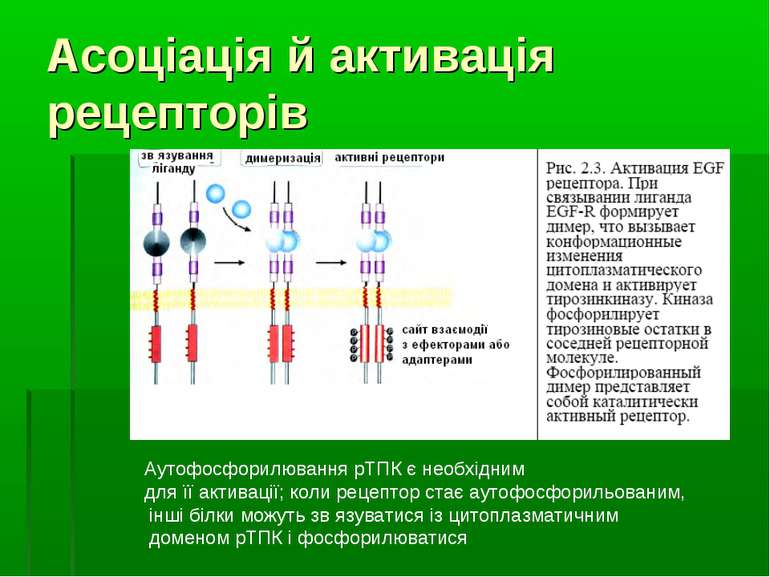
Асоціація й активація рецепторів Аутофосфорилювання рТПК є необхідним для її активації; коли рецептор стає аутофосфорильованим, інші білки можуть зв язуватися із цитоплазматичним доменом рТПК і фосфорилюватися
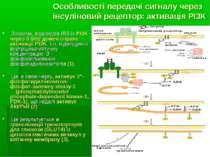
Особливості передачі сигналу через інсуліновий рецептор Сигналізація через інсуліновий рецептор є критичною для регуляції внутрішньоклітинного і кров”яного рівня глюкози Зв язування інсуліну із його рецептором веде до аутофосфорилювання β-с/о й активації кінази. Надалі з фосфотирозиновим залишком інсулінового рецептора через РТВ-домен зв язується IRS1 - білок-субстрат інсулінового рецептору (insulin receptor substrate (IRS). Активована кіназа цитоплазматичного домену рецептору фосфорилює IRS1 по тирозину – останній при цьому стає мішенню для зв язування SH2-вмісними білками. Велика к-ть сигнальних шляхів потенційно м.б. опосередковані через активацію інсулінового рецептору в комплексі із фосфорильваною ним молекулою IRS1
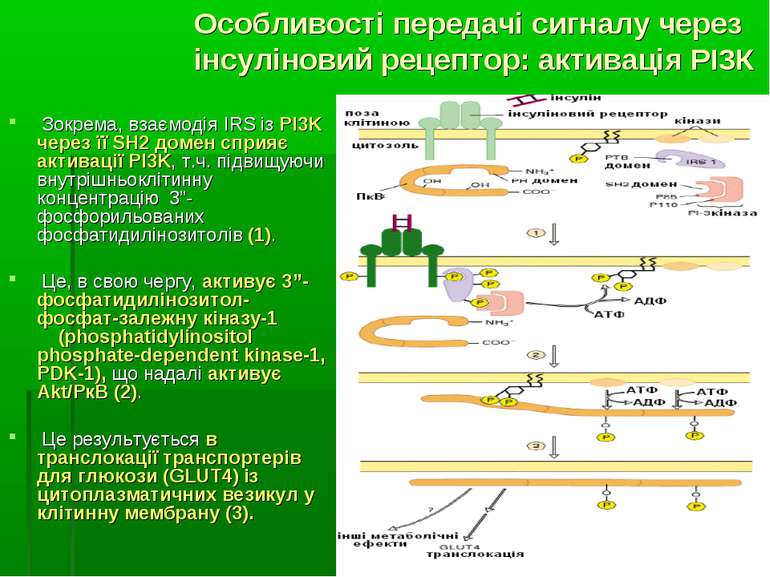
Зокрема, взаємодія IRS із PI3K через її SH2 домен сприяє активації PI3K, т.ч. підвищуючи внутрішньоклітинну концентрацію 3”- фосфорильованих фосфатидилінозитолів (1). Це, в свою чергу, активує 3”-фосфатидилінозитол-фосфат-залежну кіназу-1 (phosphatidylinositol phosphate-dependent kinase-1, PDK-1), що надалі активує Akt/PкB (2). Це результується в транслокації транспортерів для глюкози (GLUT4) із цитоплазматичних везикул у клітинну мембрану (3). Особливості передачі сигналу через інсуліновий рецептор: активація РІ3К
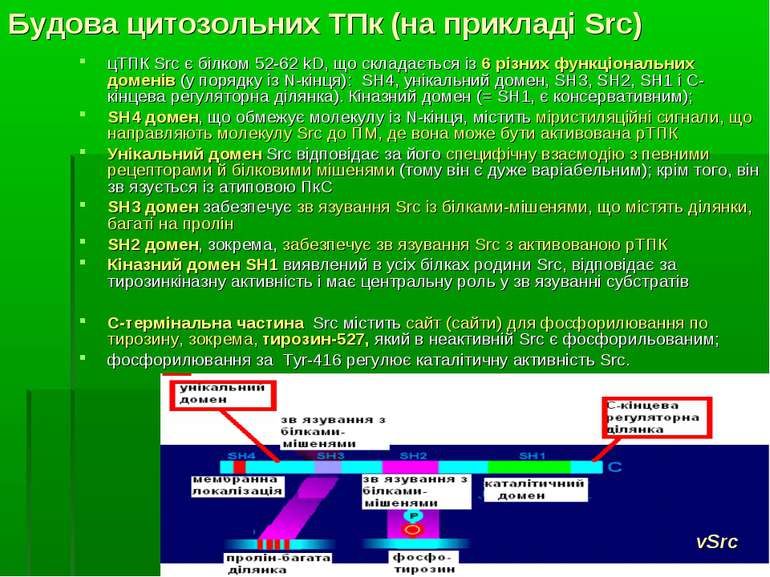
Будова цитозольних ТПк (на прикладі Src) цТПК Src є білком 52-62 kD, що складається із 6 різних функціональних доменів (у порядку із N-кінця): SH4, унікальний домен, SH3, SH2, SH1 і C-кінцева регуляторна ділянка). Кіназний домен (= SH1, є консервативним); SH4 домен, що обмежує молекулу із N-кінця, містить міристиляційні сигнали, що направляють молекулу Src до ПМ, де вона може бути активована рТПК Унікальний домен Src відповідає за його специфічну взаємодію з певними рецепторами й білковими мішенями (тому він є дуже варіабельним); крім того, він зв язується із атиповою ПкС SH3 домен забезпечує зв язування Src із білками-мішенями, що містять ділянки, багаті на пролін SH2 домен, зокрема, забезпечує зв язування Src з активованою рТПК Кіназний домен SH1 виявлений в усіх білках родини Src, відповідає за тирозинкіназну активність і має центральну роль у зв язуванні субстратів С-термінальна частина Src містить сайт (сайти) для фосфорилювання по тирозину, зокрема, тирозин-527, який в неактивній Src є фосфорильованим; фосфорилювання за Тyr-416 регулює каталітичну активність Src. vSrc
Будова цитозольних ТПк (на прикладі Src) v-Src (вірусна) відрізняється від c-Src (клітинної) за структурними відмінами у C-термінальній ділянці, яка відповідає за регуляцію кіназної активності. V-Src завжди присутня у відкритій, активній конформації, тоді як c-Src в нормі інактивна; її неконтрольована активація критично включається у міграцію клітин карциноми й поширення метастазів. Субстрати Src - найбільш відомі містяться у трансформованих клітинах; більшість із них є ключовими компонентами інтегрин-опосередкованої сигнальної трансдукції: вінкулін, кортактін, талін, паксилін, FAK, тензин, ін.; інші субстрати – білки міжклітинних контактів (β - і γ -катенін, ZO-1, окклюдін, p120ctn, коннексин-43, нектин). Міжклітинні взаємодії через щільні (gap) контакти (junctions) не утворюються, коли 2 залишки Tyr в коннексині-43 фосфорилюються v-Src. Інші відомі мішені Srс – ферменти, що включаються у метаболізм фосфоліпідів ( PLC-γ , p85 субодиниця PI3-кінази і сигнальні молекули p190RhoGAP, p120rasGAP і субстрат рецептору EGF
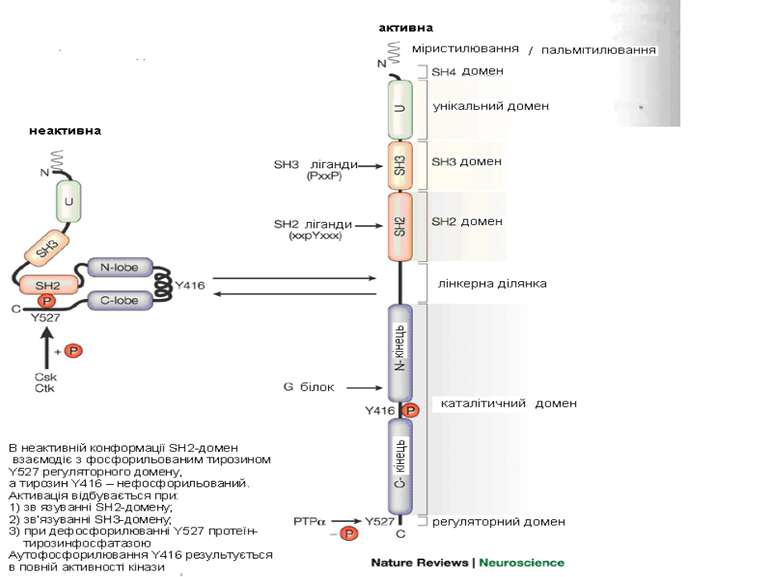
Як функціонує Src-кіназа? В інгібованому стані кінази SH2-ділянка впізнає і взаємодіє зі спеціальними ділянками в структурі регуляторного домену (фосфорильований тирозин-527) однієї й тієї ж молекули ферменту; при цьому каталітичний домен заблокований. Якщо кіназа знаходиться поруч із білками, що в своєму складі містять поліпролінові спіралі (для SH3) або фосфорильований тирозин (для SH2), фермент “розкривається”, адаптерні домени зв язують субстрат, а каталітичний центр ферменту розблоковується і фосфорилює субстрати. При цьому для повної каталітичної активності кінази необхідне її фосфорилювання за залишком тирозину-416
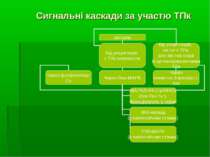
Схема взаємодії рТПК і цТПК Представники родини Src цТПК в нормі регулюються через рТПК Ліганд рецептора індукує димеризацію рецепторів Димери рецептору перехресно фосфорилюються (аутофосфорилювання) з утворенням «рецепторного комплексу» Рецепторний комплекс надалі діє як «платформа» для фосфорилювання по тирозину інших клітинних білків, у т.ч. й членів родини Src. Цитоплазматична Src транслокується до ПМ (через існування SН4 домену), де зв язується із активованим рецептором. Рецептор надалі фосфорилює Src (за тирозином 416), що веде до активації її кіназної активності Активовані Src залишають рецептор і фосфорилюють інші білки по тирозину Одна із нижчележачих мішеней Src – шлях, що залучає МАРК
Роль ТПк у життєдіяльності клітин ТПк є рецепторами до факторів росту, гормонів, цитокінів; Беруть участь у передачі сигналів, які контролюють проліферацію, диференціацію, міграцію клітин Гіперекспресія ТПк є ознакою онкологічних станів
Фосфоліпаза Сγ Активується безпосередньо рецепторами з ТПк активністю (напр., PDGF-R (Platelet-derived growth factor receptor, рецептор фактору росту тромбоцитів) та EGF-R (epidermal growth factor receptor, рецептор епідермального фактору росту) Grb2 (growth-factor-receptor-binding protein),
МАР-кінази МАР-кінази (Mitogen Activated Protein Kinases, протеїнкінази, що активуються мітогенами) належать до групи серин-треонінових протеїнкіназ. Вони активуються у відповідь на різноманітні позаклітинні стимули, які є мітогенами, тобто викликають мітотичний поділ клітин. До таких стимулів належать, зокрема, фактори росту, гормони, цитокіни, стрес. Хоча дуже активна проліферація клітин (мітоз) є необхідною для росту та розвитку молодих організмів, з віком проліферація може бути частіше асоційована із запаленням, крім того, у старих тварин проліферація більш легко спричиняє розвиток онкологічних захворювань. Мітогени в основному діють на поверхні клітини, і передача сигналу ззовні всередину клітини відбувається саме за участю МАР-кіназ. Працюючи за каскадним принципом, вони фосфорилюють і активують одна одну в певній послідовності.
p38, JNK/SAPK і ERK-кінази МАР-кінази – це збірна група білків, містить три родини протеїнкіназ: p38, JNK/SAPK (c Jun N terminal kinase/Stress activated protein kinase) та ERK (Exracellular signal regulated kinase). У більшості випадків активація протеїнкіназ родини ERK сприяє клітинному виживанню та проліферації, тоді як активація ферментів інших двох родин викликає індукцію апоптозу. ERK-кінази активуються різними мітогенами за шляхами, опосередкованими ТПК-рецепторами, G-білок-спареними рецепторами або цитокіновими рецепторами. Як вже зазначалося, в основному вони відіграють роль у клітинній проліферації та диференціації. Навпаки, p38, JNK/SAPK-кінази часто активуються у відповідь на різноманітні види стресів, дію запальних цитокінів та інші апоптозні стимули. Рецептори для подібних стимулів найчастіше невідомі. Прикладом стресорних тригерів, здатних активувати ці шляхи, можуть бути вінбластин, метилметансульфонат, кадмій, арсеніт натрію, саліцилат натрію, церамід, анізоміцин, тепловий шок, ультрафіолет, гіпероксія, гіперосмолярність, низький рН, пероксид водню, ішемія-реперфузія, деякі фактори росту, напр., ТNF . Відомо, що JNK може фосфорилювати Вс1-2, відміняючи їх антиапоптозні властивості та сприяючи звільненню цитохрому с і каспаза-9-опосередковану активацію каспази-3 та інших апоптозних подій. Крім того, мішенню JNK також є білок-супресор пухлини р53 – кіназа фосфорилює його по серину (34), модулюючи його функціонування як ключового регулятора клітинної проліферації та загибелі. Є гіпотези щодо подібного впливу на білок р53 і p38 МАРК. В той же час, включення цих трьох сигнальних систем (ERK, p38, JNK/SAPK-кіназних каскадів) в апоптоз, клітинну проліферацію та диференціацію є комплексним
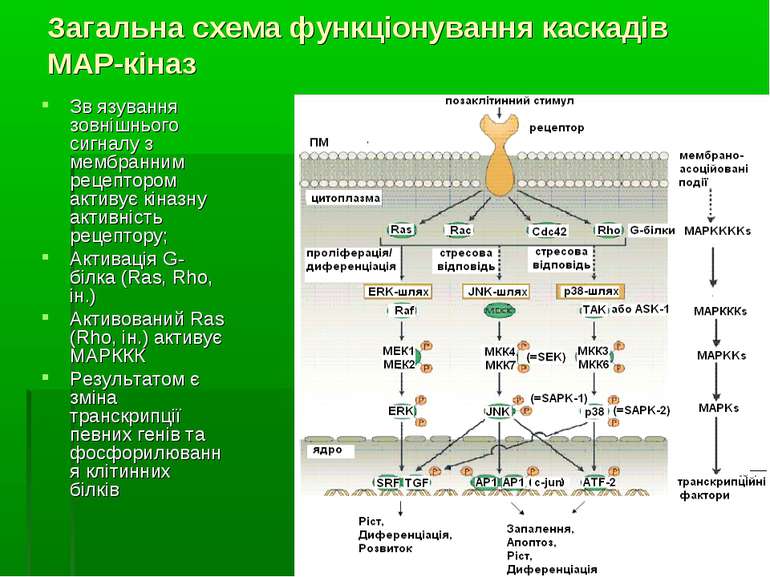
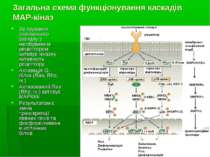
Структура загального МАР-кіназного каскаду Загальний МАР-кіназний каскад включає трьохкіназний модуль. Всередині цього модуля МАР-кіназа (МАРК) фосфорилюється і активується кіназою МАРК (MAPK Kinase, МАРКК; інші назви – МКК, МЕК). А МКК, в свою чергу, фосфорилюється та активується серин-треоніновими кіназами кінази МАРК (MAPK Kinase Kinase, MAPKKK; інші назви – МККК, МЕКК). Подібні трьохкомпонентні каскади ПК є еволюційно консервативними у всіх еукаріот – від дріжджів до людини. Окрім цих членів каскаду, останнім часом виділяють ще один рівень у ланцюзі передачі внутришньоклітинних сигналів, до якого належать малі ГТФази (зокрема, Ras) та протеїнкінази, що беруть участь у регуляції активності МККК та здійсненні специфічності передачі сигналу на трьохкомпонентний протеїнкіназний каскад. Ці білки иожна назвати “кіназа кінази кінази МАРК (MAPK Kinase Kinase Kinase, MAPKKKK; інші назви - МКККК або МЕККК). Основними мішенями МАР-кіназ є фактори транскрипції. В комбінації із низкою інших сигнальних шляхів МАР-кінази здійснюють фосфорилювання цих факторів, змінюючи їх активність. При фосфорилюванні транскрипційних факторів МАРК функціонують всередині ядра та фосфорилюють білки, вже зв’язані із ДНК. Хоча транскрипційні фактори, локалізовані в ядрі, є важливими субстратами МАРК, лише частина активованих в цитоплазмі МАРК транслокується в ядро. Частина МАР-кіназ залишається в цитоплазмі та інших компартментах клітин, де ці ферменти можуть регулювати експресію генів і на посттранскрипційному рівні, використовуючи як субстрати цитоплазматичні білки, що беруть участь у стабілізації мРНК.
Загальна схема функціонування каскадів МАР-кіназ Зв язування зовнішнього сигналу з мембранним рецептором активує кіназну активність рецептору; Активація G-білка (Ras, Rho, ін.) Активований Ras (Rho, ін.) активує МАРККК Результатом є зміна транскрипції певних генів та фосфорилювання клітинних білків
MAPK/ERK-каскад Ефектор – Ras-білок Продукти, що кодуються генами ras ( від Rat sarcoma), належать до родини низькомолекулярних (малих) G-білків. Всі вони є одноланцюговими поліпептидами довжиною в 189 амінокислотних залишки та зв’язані з плазматичними мембранами клітин. Всі вони зв’язують гуанінові нуклеотиди (GTP и GDP), та всі вони є GTP-азами, що гідролізують ГТФ до ГДФ. У ссавців є три майже ідентичних ras-гени, що кодують білки з молекулярною масою 21 кДа ( тому ці білки також відомі під загальною назвою “р21 білки”) Ген ras є протоонкогеном. Пухлинні клітини містять мутантні форми генів ras, які активують численні внутрішньоклітинні Ras-залежні сигнальні системи, у тому числі пов’язані з рецепторами тирозинкінази та мембранними G-білками. Характерний механізм переродження ras – точкові мутації (наприклад, по амінокислотним залишкам 12, 61). Білковий продукт мутованого ras надсилає безперервні сигнали з мембрани в ядро Raf-білки, подібно до Ras, також є протоонкогенами. Дисрегуляція ERK включається у патогенез біля 30 % онкологічних захворювань.
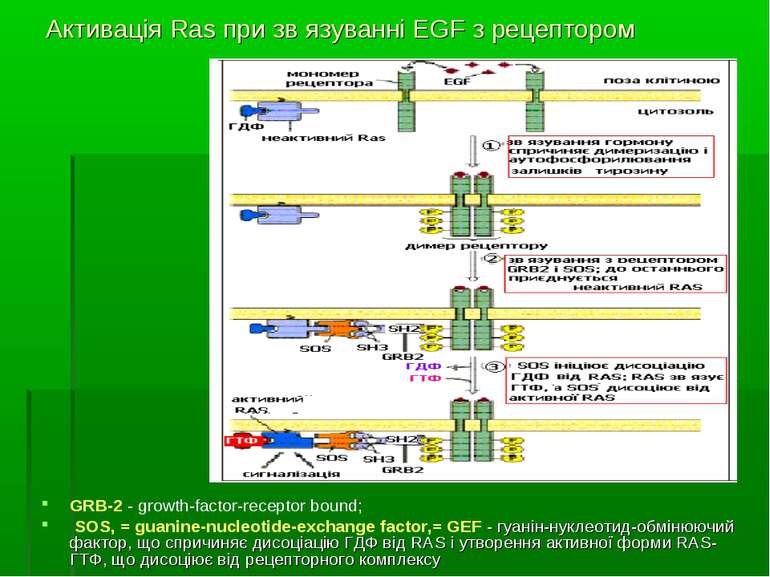
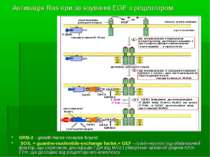
Активація Ras при зв язуванні EGF з рецептором GRB-2 - growth-factor-receptor bound; SOS, = guanine-nucleotide-exchange factor,= GEF - гуанін-нуклеотид-обмінюючий фактор, що спричиняє дисоціацію ГДФ від RAS і утворення активної форми RAS-ГТФ, що дисоціює від рецепторного комплексу
Шлях, що залучає РІ3-кіназу, інозитол-3’-фосфат і ПкВ Пов’язаний або з рецепторами ростових факторів (наприклад, рТПК), або з іншими антиапоптозними сигнальними механізмами (протеїнкіназа А, NF-kB). PI3-K активується або через активацію рецепторів ростових факторів лігандом, або шляхом прямої взаємодії з протоонкогеном ras. Активована PI3-K каталізує утворення 3’-фосфорильованих фосфоінозитидів із фосфоліпідів клітинної мембрани. Утворені фосфоінозитиди надалі зв’язуються і таким чином активують серин|/треонінову кіназу - 3’-фосфатидилінозитол-залежну кіназу-1 (PDK-1), яка, в свою чергу, може активувати різноманітні кінази, включаючи Akt. Механізм активації нижчележачих кіназ передбачає зв язування їх РН домена з 3-фосфорильованими інозитоловими ліпідами, що швидко генеруються у мембрані через дію РІ3-кінази.
Функції Akt-кінази: антиапоптозний фактор У фізіологічних умовах активована ростовими факторами кіназа Akt служить для фосфорилювання білків, що підтримують основні функції клітин, зокрема, транспорт і окислення глюкози. Вона здатна напряму взаємодіяти із прокаспазою-9, інактивуючи її. Точний механізм цього процесу не досліджений. Ділянка фосфорилювання Akt (RXRXXS/T) ідентифікована і в інших білках-регуляторах апоптозу на кожному рівні апоптозного каскаду (каспаза-8, Bcl-2, Apaf-1, IAP, каспаза-7). Порушення Akt-сигнального шляху викликають апоптоз, зокрема, впливаючи на активацію проапоптозних членів родини Bcl-2 (Bad та Вах).
Захворювання, зумовлені дисфункціями ТПказ Протоонкогени: їх постійна активність властива для пухлин Гіперекспресія ERK – ріст гіпертрофії міокарду Гіперекспресія SARK – хронічні запальні процеси, інсульт, цукровий діабет Зниження активності цитозольних ТПКаз – імунодефіцит, а-γ-глобулінемія Зростання їх активності – імунні, запальні захворювання (ревматоїдний артрит, гломерулонефрит, алергії, ...)
Інгібітори ТПк Класичний – тирфостин Інші інгібітори: - алостеричні; - ті, що зв язуються з АТФ-зв язуючим сайтом ферменту - ті, що блокують субстрат-зв язуючий сайт ферменту
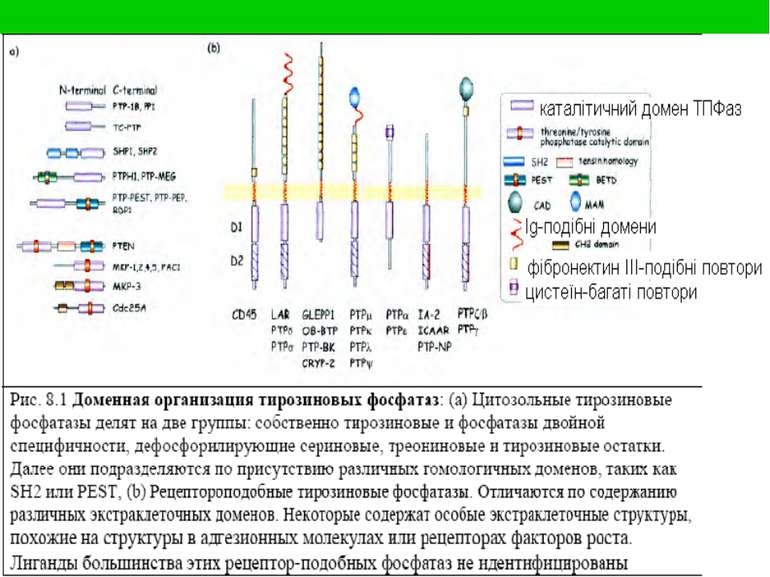
Тирозинові протеїнфосфатази: номенклатура і класифікація Протеїн-тирозинфосфат-фосфогідролази КФ 3.1.3.48 (3 – гідролази) Цитозольні (9 груп) Трансмембранні, або рецепторні (8 груп) Всі є мономерними білками, але мають доменну будову
ТПФази тип ТПФаза Тирозинспецифічні Цитозольні, нерецепторні: PTP1B, SHP-1, SHP-2 Рецепторні, трансмембранні: CD45, RPTPm, RPTPα Фосфатази подвійної специфічності CDC25, KAP, MAP kinase phosphatase-1
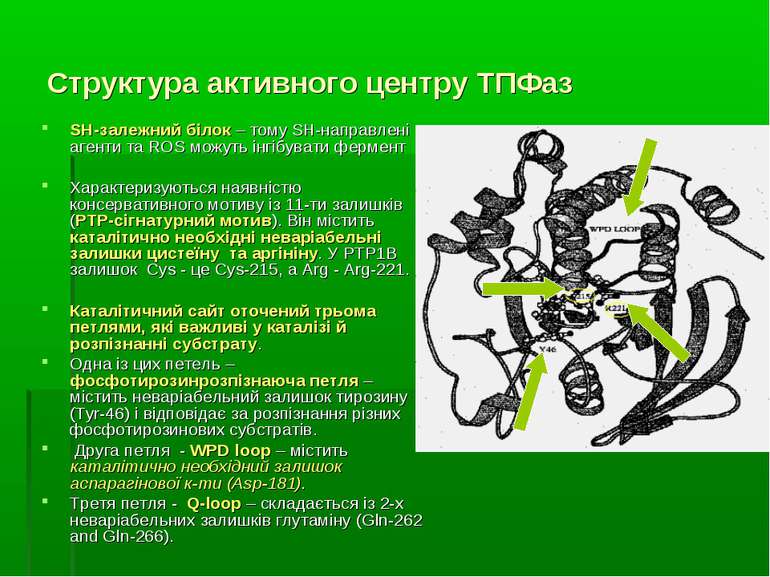
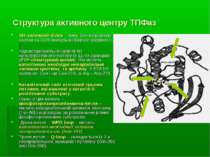
Структура активного центру ТПФаз SH-залежний білок – тому SH-направлені агенти та ROS можуть інгібувати фермент Характеризуються наявністю консервативного мотиву із 11-ти залишків (РТР-сігнатурний мотив). Він містить каталітично необхідні неваріабельні залишки цистеїну та аргініну. У PTP1B залишок Cys - це Cys-215, а Arg - Arg-221. Каталітичний сайт оточений трьома петлями, які важливі у каталізі й розпізнанні субстрату. Одна із цих петель – фосфотирозинрозпізнаюча петля – містить неваріабельний залишок тирозину (Tyr-46) і відповідає за розпізнання різних фосфотирозинових субстратів. Друга петля - WPD loop – містить каталітично необхідний залишок аспарагінової к-ти (Asp-181). Третя петля - Q-loop – складається із 2-х неваріабельних залишків глутаміну (Gln-262 and Gln-266).
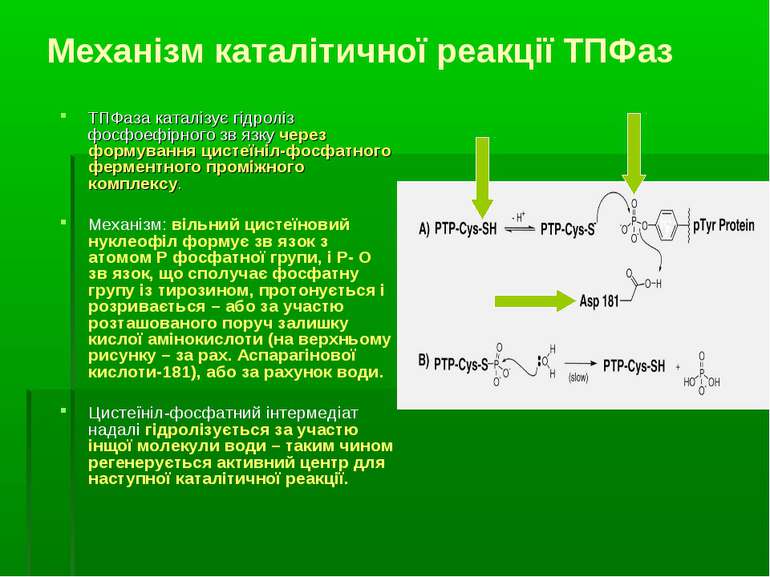
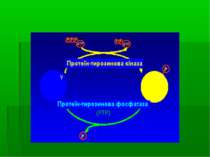
Механізм каталітичної реакції ТПФаз ТПФаза каталізує гідроліз фосфоефірного зв язку через формування цистеїніл-фосфатного ферментного проміжного комплексу. Механізм: вільний цистеїновий нуклеофіл формує зв язок з атомом Р фосфатної групи, і Р- О зв язок, що сполучає фосфатну групу із тирозином, протонується і розривається – або за участю розташованого поруч залишку кислої амінокислоти (на верхньому рисунку – за рах. Аспарагінової кислоти-181), або за рахунок води. Цистеїніл-фосфатний інтермедіат надалі гідролізується за участю інщої молекули води – таким чином регенерується активний центр для наступної каталітичної реакції.
Цитозольні ТПФази Мають 1 консервативний протеїнфосфатазний домен і регуляторний, що надає ферменту специфічної внутрішньоклітинної локалізації і специфічності щодо субстрату Функції: - “-” та “+” трансдукція сигналів від антигенів, інтерферонів, інтерлейкінів, дофаміну, G-білків; Дефосфорилювання ядерних білків (а, отже, і контроль проліферації, чергування фаз клітинного циклу, тощо) Регуляція апоптозу лімфоцитів
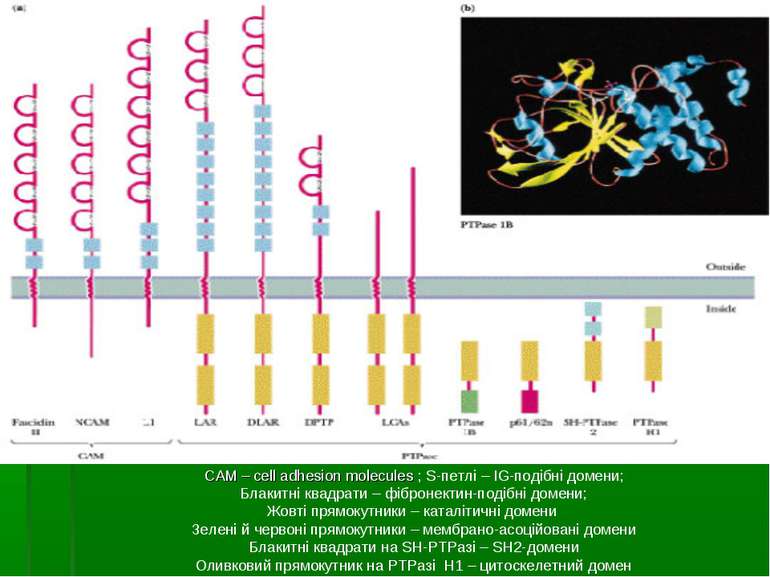
Трансмембранні ТПФази Мають внутрішньоклітинну, позаклітинну і трансмембранну частини Внутрішньоклітинна частина має 2 домени, 1 із яких – D2 - є неактивним, але гомологічно подібним до активного; він служить для димеризації, яка здійснює регуляцію передачі сигналу; D1 – власне каталітичний домен Позаклітинна частина має структуру, подібну до молекул клітинної адгезії (САМ – cell adhesion molecules), з ІG-подібними доменами і фібронектиновими повторами Функції: - регуляція передачі сигналу від антигенів, інтерлейкінів, інтерферонів, мітогенів - дефосфорилювання src-, jaк-родин ТПказ, МАПК - регуляція адгезивних і міграційних властивостей клітин, дефосфорилювання білків цитоскелету Можуть діяти як супресори пухлин, тому їх втрата чи мутація можуть привести до неконтрольованої клітинної проліферації і трансформації
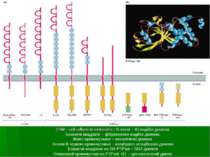
САМ – cell adhesion molecules ; S-петлі – IG-подібні домени; Блакитні квадрати – фібронектин-подібні домени; Жовті прямокутники – каталітичні домени Зелені й червоні прямокутники – мембрано-асоційовані домени Блакитні квадрати на SH-РТРазі – SH2-домени Оливковий прямокутник на РТРазі Н1 – цитоскелетний домен
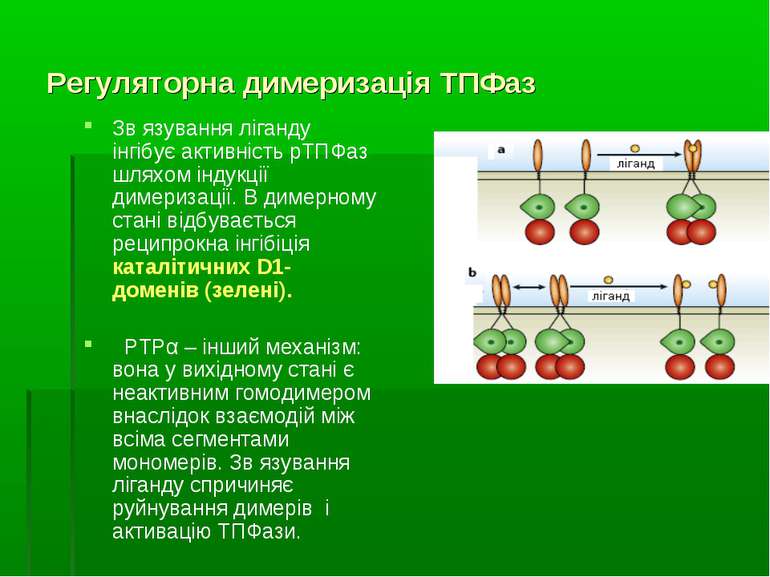
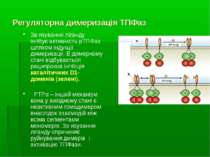
Регуляторна димеризація ТПФаз Зв язування ліганду інгібує активність рТПФаз шляхом індукції димеризації. В димерному стані відбувається реципрокна інгібіція каталітичних D1-доменів (зелені). PTPα – інший механізм: вона у вихідному стані є неактивним гомодимером внаслідок взаємодій між всіма сегментами мономерів. Зв язування ліганду спричиняє руйнування димерів і активацію ТПФази.
СD-45-рецептор – головна трансмембранна ТПФаза лімфоїдних клітин Димеризація – неактивний стан; при зв язуванні СD-45 із лігандом відбувається мономеризація і активація рецептора Є різні ізоформи СD-45 – на різних типах лімфоїдних клітин, а також у клітинах одного типу, але на різних стадіях Ліганди ТПФази СD-45: СD-22, СD-2, СD-3, СD-4, СD-8, СD-90, ... (СD – трансмембранні білки лімфоїдних клітин, “маркери”) Субстрати ТПФази СD-45: кінази, ін. Модулятори активності СD-45: ванадат натрію, молібдат амонію, обмежений протеоліз
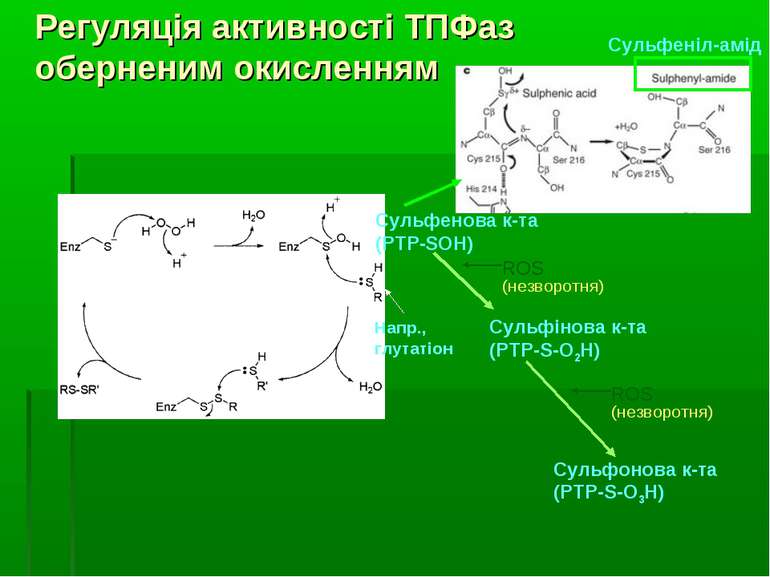
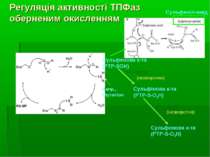
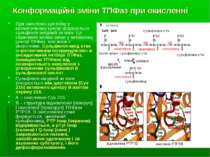
Регуляція активності ТПФаз оберненим окисленням Високореактивний каталітичний цистеїн сигнатурного мотиву ТПФаз може бути окислений до різних кінцевих продуктів під впливом Н2О2, інших ROS та клітинних оксидантів. При утворенні сульфенової кислоти (-SOH) вона надалі може реагувати у внутрішньомолекулярних реакціях з азотом сусідньої аміногрупи – при цьому утворюється сульфеніл-амідна структура. Це веде до конформаційних змін у каталітичному центрі ТПФази. Інші форми зворотньої оксидації – глутатіонування і нітрозилювання реактивного цистеїну. Ці зворотньо окиснені форми можуть відновлюватися, напр., за участю GSH. Утворення сульфінової к-ти (-SO2) і сульфонової кислоти (-SO3) є незворотніми процесами.
Сульфінова к-та (PTP-S-O2H) Сульфонова к-та (PTP-S-O3H) ROS (незворотня) Напр., глутатіон ROS (незворотня) Регуляція активності ТПФаз оберненим окисленням Сульфеніл-амід Сульфенова к-та (PTP-SOH)
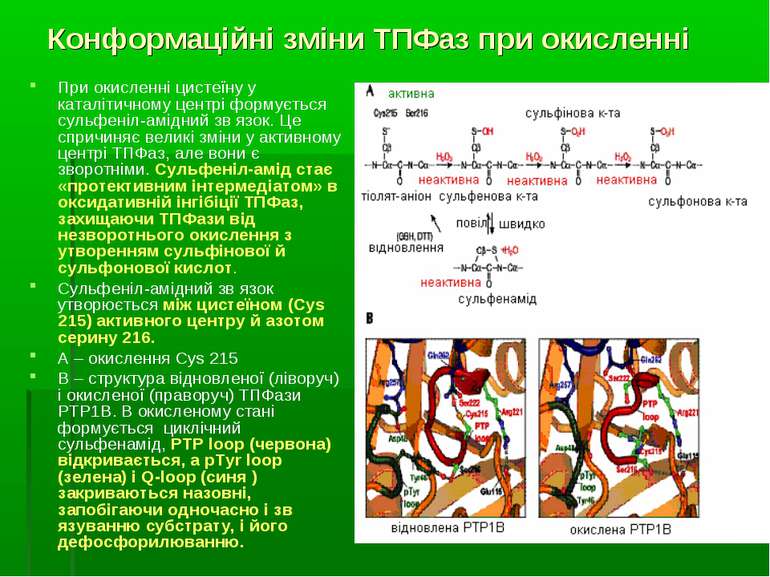
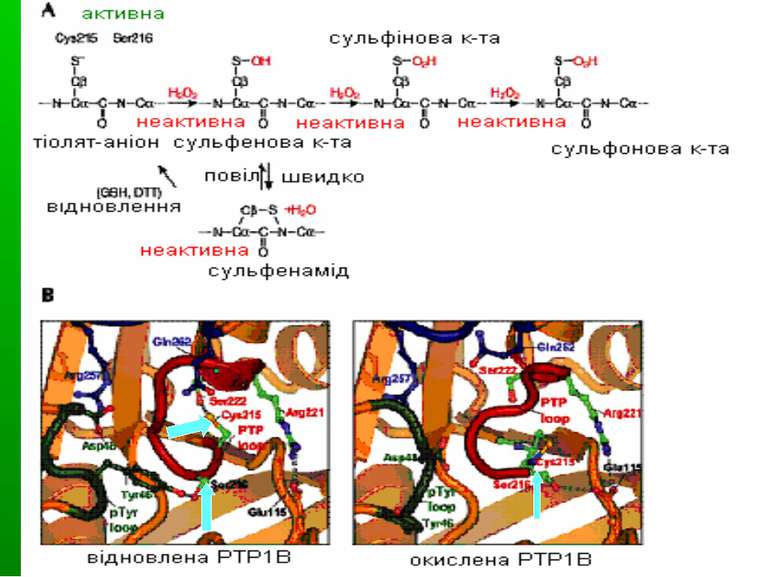
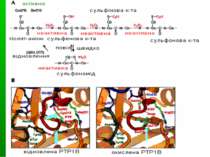
Конформаційні зміни ТПФаз при окисленні При окисленні цистеїну у каталітичному центрі формується сульфеніл-амідний зв язок. Це спричиняє великі зміни у активному центрі ТПФаз, але вони є зворотніми. Сульфеніл-амід стає «протективним інтермедіатом» в оксидативній інгібіції ТПФаз, захищаючи ТПФази від незворотнього окислення з утворенням сульфінової й сульфонової кислот. Сульфеніл-амідний зв язок утворюється між цистеїном (Cys 215) активного центру й азотом серину 216. А – окислення Cys 215 В – структура відновленої (ліворуч) і окисленої (праворуч) ТПФази PTP1B. В окисленому стані формується циклічний сульфенамід, PTP loop (червона) відкривається, а pTyr loop (зелена) і Q-loop (синя ) закриваються назовні, запобігаючи одночасно і зв язуванню субстрату, і його дефосфорилюванню.
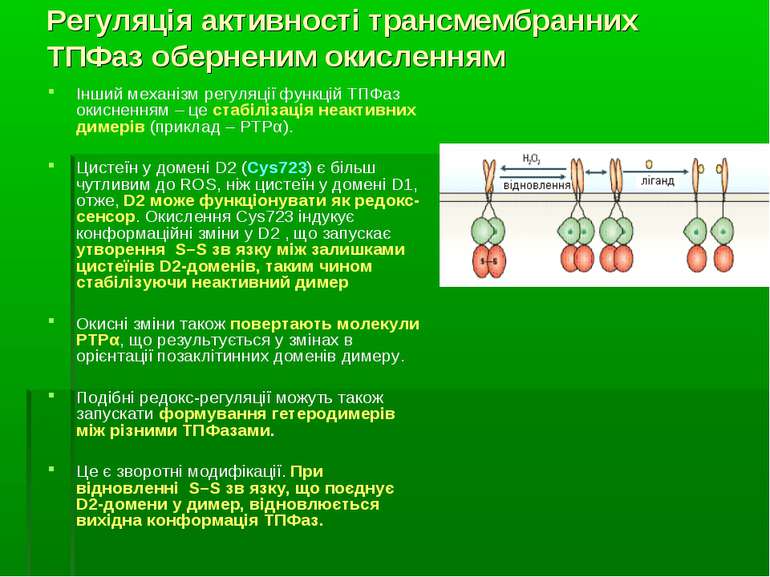
Регуляція активності трансмембранних ТПФаз оберненим окисленням Інший механізм регуляції функцій ТПФаз окисненням – це стабілізація неактивних димерів (приклад – PTPα). Цистеїн у домені D2 (Cys723) є більш чутливим до ROS, ніж цистеїн у домені D1, отже, D2 може функціонувати як редокс-сенсор. Окислення Cys723 індукує конформаційні зміни у D2 , що запускає утворення S–S зв язку між залишками цистеїнів D2-доменів, таким чином стабілізуючи неактивний димер Окисні зміни також повертають молекули PTPα, що результується у змінах в орієнтації позаклітинних доменів димеру. Подібні редокс-регуляції можуть також запускати формування гетеродимерів між різними ТПФазами. Це є зворотні модифікації. При відновленні S–S зв язку, що поєднує D2-домени у димер, відновлюється вихідна конформація ТПФаз.
Захворювання, зумовлені дисфункцією ТПФаз Більшість пухлин (гіперактивація кіназ) Мутації в молекулі ТПФаз – фактор ризику низки аутоімунних захворювань (діабет І типу, ревматоїдний артрит, системна червона вовчанка). При червоній вовчанці в крові хворих з являються антитіла до СD-45
Методи дослідження процесів фосфорилювання і дефосфорилювання тирозину Визначення сайтів фосфорилювання (за допомогою мітки – напр., пероксидази хрону); Визначення вмісту фосфотирозину (використовуються антитіла – кон юговані, що містять і сайт зв язування, і мітку, або некон юговані – первинні і вторинні антитіла, останні містять мітку); Радіомічена АТФ – включається у субстрати, далі досліджується радіоактивність зразку внаслідок включення радіоактивної мітки
Схожі презентації
Категорії