Презентація на тему:
биохімія сполучної тканини (1)
Завантажити презентацію
биохімія сполучної тканини (1)
Завантажити презентаціюПрезентація по слайдам:
БІОХІМІЯ СПОЛУЧНОЇ ТКАНИНИ Функції сполучної тканини: утворює оточення клітин, впливає на проліферацію, диференціацію, організацію та прикріплення (адгезію) клітин; ключова роль у ембріогенезі, органогенезі, загоєнні ран, пухлинній інвазії й метастазах пухлин. Одна з форм сполучної тканини – базальна мембрана – є місцем прикріплення клітин, впливає на їх міграцію, бере участь у регенерації й загоєнні ран. Вона складає 50% маси тіла.
Біомедичне значення позаклітинного матриксу Рух клітин під час ембріогенезу залежить від молекул матриксу Гострі й хронічні запалення супроводжуються в тканинах активною участю молекул матриксу Проблема метастазування пухлин тісно пов язана з позаклітинним матриксом Найбільш популярні захворювання серед людей – ревматоїдний артрит, остеоартрит, атеросклероз – протікають за участі молекул позаклітинного матриксу Широкий спектр колагенових захворювань пов язаний з генетичними порушеннями обміну молекул матриксу Дефекти лізосомних гідролаз спричиняють тяжкі наслідки (мукополісахаридози) Старіння і проблеми косметики тісно пов язані з можливостями впливу на обмін молекул матриксу
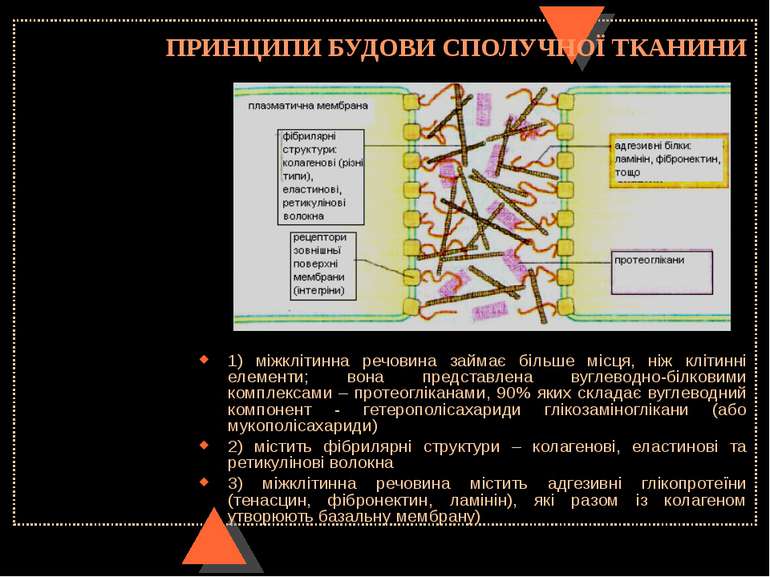
ПРИНЦИПИ БУДОВИ СПОЛУЧНОЇ ТКАНИНИ 1) міжклітинна речовина займає більше місця, ніж клітинні елементи; вона представлена вуглеводно-білковими комплексами – протеогліканами, 90% яких складає вуглеводний компонент - гетерополісахариди глікозаміноглікани (або мукополісахариди) 2) містить фібрилярні структури – колагенові, еластинові та ретикулінові волокна 3) міжклітинна речовина містить адгезивні глікопротеїни (тенасцин, фібронектин, ламінін), які разом із колагеном утворюють базальну мембрану)
ПРИНЦИПИ БУДОВИ СПОЛУЧНОЇ ТКАНИНИ: вікові й патологічні аспекти З віком вміст води і глікозаміногліканів зменшується, а вміст колагену – зростає. Існує група захворювань – колагенози – для якої характерне ушкодження всіх структурних складових сполучної тканини – волокон, клітин та міжклітинної речовини. До неї належать ревматизм, ревматоїдний артрит, системна червона вовчанка, системна склеродермя, дерматоміозит, вузликовий периартеріїт.
Походження компонентів сполучної тканини У більшості органів молекули матриксу утворюються фібробластами або клітинами цієї родини (хондробласти в хрящі, остеобласти – в кістковій тканині), а також макрофагами, тканевими базофілами, адіпоцитами, мезенхімальними клітинами, періцитами – це група т. зв. постійних клітин На молекулярний склад міжклітинної рчовини впливають і транзиторні клітини, які мігрують у сполучну тканину із крові у відповідь на специфічний стимул – лімфоцити, плазматичні клітини, еозинофіли, нейтрофіли, базофіли, ін
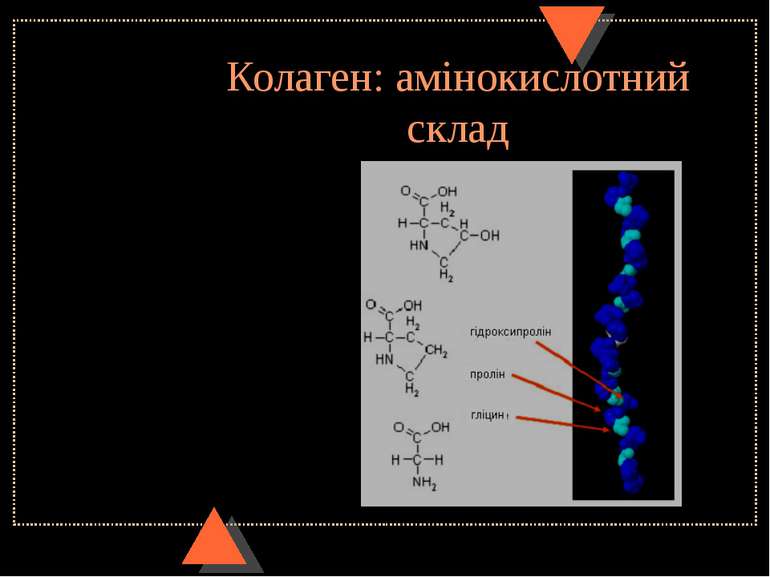
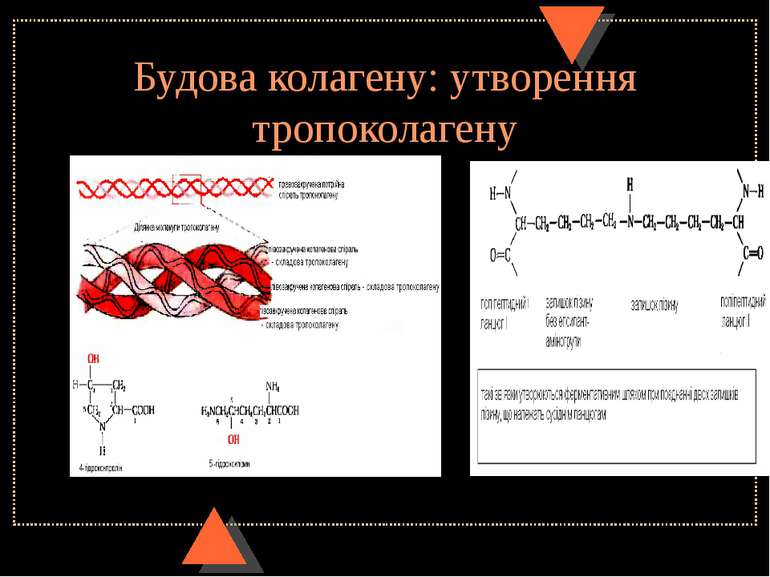
Будова міжклітинного органічного матриксу сполучної тканини. Колагенове волокно. Будова колагену Колагенове волокно - це гетерогенне утворення, що містить білок колаген (інша назва – тропоколаген). Він складає 25-33% всіх білків організму ( 6% маси тіла). Колаген містить 3 поліпептидні ланцюги (кожен з них має назву α-ланцюга колагену), які є лівозакрученими спіралями і мають 3 амінокислотні залишки на 1 виток, що відрізняє їх від α-спіралі глобулярних білків. До того ж, водневі зв язки, характерні для α-спіралей, в колагеновій спіралі не утворюються. Три лівоспіральні α-ланцюги разом закручуються у праву спіраль, як кабель (це надвторинна структура колагену), утворюючи молекулу колагену довжиною 300 нм і діаметром 1,4 нм. На кожен ланцюг припадає біля 1000 амінокислотних залишки, причому кожною третьою амінокислотою в його складі є гліцин (33% - гліцин, 21% - пролін та оксипролін, 11% - аланін, 35% - усі інші амінокислоти). Гідроксипролін та гідроксилізин характерні лише для колагену (гідроксипролін – ще й для еластину). Утворення цих амінокислот відбувається не з відповідних вільних амінокислот, а після включення проліну і лізину до поліпептидного ланцюга колагену за участю ферментів пролінгідроксилази та лізингідроксилази та кофакторів – аскорбінової к-ти та іонів Fe в процесі дозрівання проколагену. Для дії цих ферментів також необхідні як субстрати О2 і альфа-кетоглутарова к-та. Колаген містить мало залишків тирозину, гістидину, метіоніну, не має триптофана і цистеїну. Для колагену є характерною наявність ділянок, які багаті на від’ємно заряджені амінокислоти. Вони зв’язують і концентрують позитивні іони Са та ін. Інтенсивний синтез колагену спостерігається при загоюванні ран; при недостачі вітаміну С, заліза, гіпоксії обидва процеси гальмуються. Надмірне утворення колагенових фібрил характерне для ряду захворювань сполучної тканини – прогресуючого системного склерозу, склеродермії, поліміозиту, а також для фіброзу легень, цирозу печінки. Пригнічення біосинтезу колагену у фібробластах спостерігається під впливом глюкокортикоїдів, активація – при дії мінералокортикоїдів та гормону росту. Причиною вікових змін структури колагену є зміни вмісту ферментів його синтезу та модифікації. До частини залишків оксилізину поліпептидного ланцюга 0-глікозидним зв’язком приєднуються вуглеводи – галактоза або галактозилглюкоза.
Будова міжклітинного органічного матриксу сполучної тканини. Будова колагенового волокна. Катаболізм колагену У людини є 12 типів колагену, які відрізняються первинною структурою, вмістом вуглеводів, органною та тканинною організацією ( колаген І – у шкірі, кістках, сухожиллі, рогівці ока, склері; колаген ІІ – хрящі, склоподібне тіло; ІІІ – шкіра плода, стінки кровоносних судин; ІV – базальна мембрана). Молекули тропоколагену утворюють фібрили , з яких формуються пучки фібрил, волокна та пучки волокон (різні варіанти четвертинної структури колагену). Молекули в паралельних ланцюгах фібрили зміщені одна відносно одної на 64 нм – цим зумовлюється „поперечна посмугованість” колагенових фібрил з періодом 64 нм. У колагенових волокнах завдяки дії лізилоксидази утворюються поперечні колагенові зшивки (між поліпептидними ланцюгами у молекулі тропоколагену, або у межах фібрил). При спадковому синдромі Елерса-Данлоса (V тип) активність цього ферменту відсутня або знижена, тому механічні властивості волокон погіршені. Аналогічні зміни – при гіповітамінозі С. Катаболізм тканинного колагену починається з дії колагеназ; при цьому утворюються поліпептиди, які підлягають гідролізу тканинними протеїназами до амінокислот. Про інтенсивність розпаду колагену судять на основі вмісту вільного оксипроліну у крові та сечі. Його збільшення виявляється при деяких ураженнях сполучної тканини, кісток і суглобів. Активацію катаболізму колагену викликають і глюкокортикоїди.
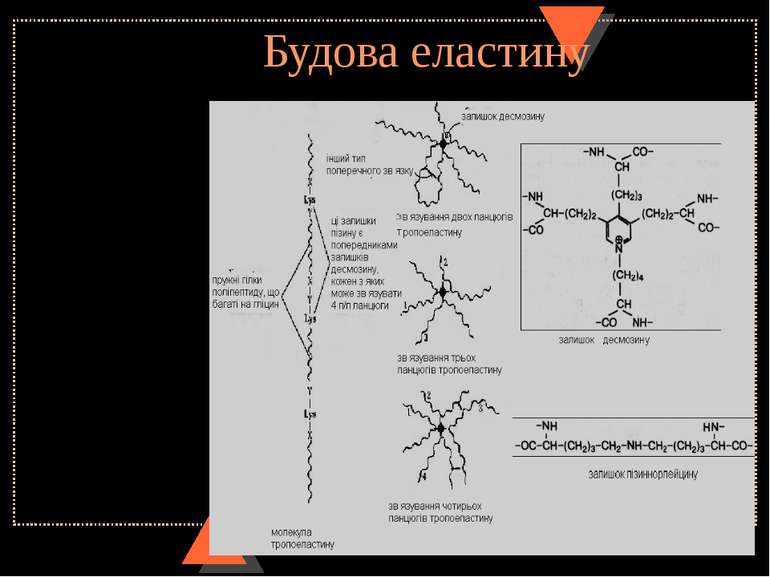
Будова міжклітинного органічного матриксу сполучної тканини. Будова еластинового волокна. Еластин Еластинові волокна містяться у зв’язках, стінках великих артерій, легенях і основним білковим компонентом мають еластин. Як і тропоколаген, він має великий вміст гліцину і проліну, містить оксипролін (в 10 разів менше, ніж в колагені), не містить триптофану і цистеїну. На відміну від колагену, має досить високий вміст валіну і аланіну, менше – глютамінової кислоти і аргініну, тобто малий вміст полярних амінокислотних залишків. Тільки в еластині містяться такі сполуки, як десмозин та ізодесмозин. Завдяки своїй будові (4 залишки лізину, з’єднані радикалами, утворюють заміщене піридинове кільце) вони можуть одночасно входити до складу 4-х поліпептидних ланцюгів і утворювати поперечні ковалентні зшивки. Це пояснює особливість еластину – можливість розтягуватися у 2-х напрямках. Ще одна незвична амінокислота, характерна для еластину – лізиннорлейцин. Вона також забезпечує поперечні зв’язки у молекулі еластину. До складу волокон еластину входять і глікопротеїни – вони впливають на просторову організацію молекул еластину у волокнах.
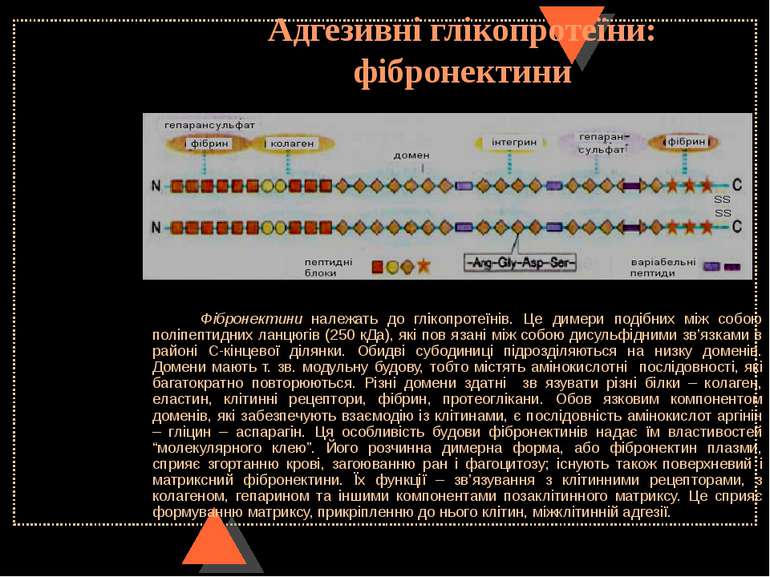
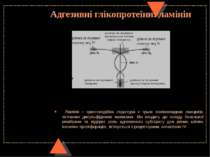
Адгезивні глікопротеїни: фібронектини Фібронектини належать до глікопротеїнів. Це димери подібних між собою поліпептидних ланцюгів (250 кДа), які пов язані між собою дисульфідними зв’язками в районі С-кінцевої ділянки. Обидві субодиниці підрозділяються на низку доменів. Домени мають т. зв. модульну будову, тобто містять амінокислотні послідовності, які багатократно повторюються. Різні домени здатні зв язувати різні білки – колаген, еластин, клітинні рецептори, фібрин, протеоглікани. Обов язковим компонентом доменів, які забезпечують взаємодію із клітинами, є послідовність амінокислот аргінін – гліцин – аспарагін. Ця особливість будови фібронектинів надає їм властивостей “молекулярного клею”. Його розчинна димерна форма, або фібронектин плазми, сприяє згортанню крові, загоюванню ран і фагоцитозу; існують також поверхневий і матриксний фібронектини. Їх функції – зв’язування з клітинними рецепторами, з колагеном, гепарином та іншими компонентами позаклітинного матриксу. Це сприяє формуванню матриксу, прикріпленню до нього клітин, міжклітинній адгезії.
Адгезивні глікопротеїни: тенасцин Тенасцин (молек. Маса 1 900 кДа) – найчастіше зустрічається в ембріональних тканинах. В зрілих тканинах деяка його кількість міститься в речовині сухожиль і хрящів; також він експресується в процесі загоєння ран За формою нагадує колесо, шпицями якого є 6 поліпептидних ланцюгів (субодиниць), зв’язаних дисульфідними зшивками. Кожний поліпептидний ланцюг складається із кількох коротких амінокислотних послідовностей, які повторюються кілька разів (це т. зв. модулі), і мають кілька функціонально різних доменів, одни з яких зв язують фібронектин, а ін. – трансмембранний протеоглікан сіндекан. Тенасцин, в залежності від типу клітин, може або посилювати, або пригнічувати клітинну адгезію – при цьому адгезивні і антиадгезивні властивості забезпечують різні домени білка
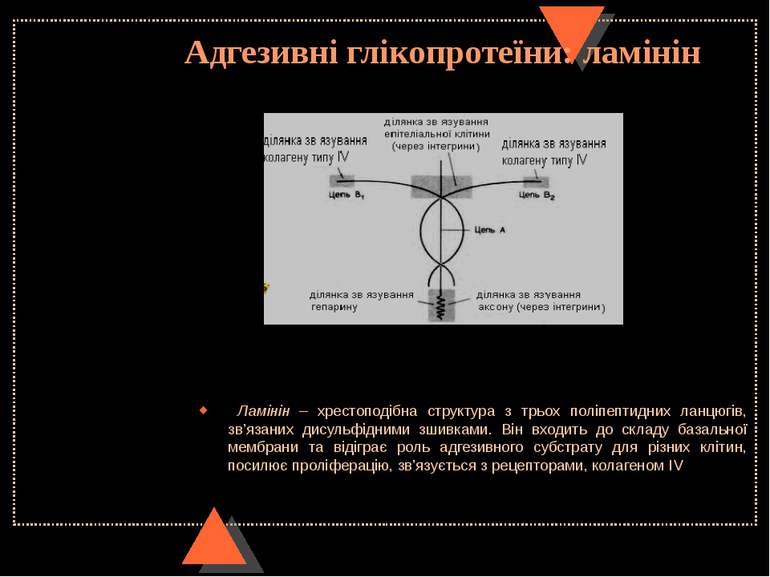
Адгезивні глікопротеїни: ламінін Ламінін – хрестоподібна структура з трьох поліпептидних ланцюгів, зв’язаних дисульфідними зшивками. Він входить до складу базальної мембрани та відіграє роль адгезивного субстрату для різних клітин, посилює проліферацію, зв’язується з рецепторами, колагеном ІV
Протеоглікани. Глікозаміноглікани як їх полісахаридна частина Утворюють основну субстанцію міжклітинного матриксу сполучної тканини (30% сухої сполучної тканини). Полісахаридна частина протеогліканів представлена глікозаміногліканами (мукополісахаридами). Це лінійні полімери, побудовані з дисахаридних одиниць, які повторюються. Вони завжди пов’язані з білком. Мономерами глікозаміногліканів є: 1) залишок глюкозаміну або галактозаміну; 2) D-глюкуронова або L-ідуронова кислота; Попередниками глікозаміногліканів є D-глюкоза та безпосередньо уридиндифосфонуклеотидні похідні N-ацетил-D-глюкозаміну та D-глюкуронової кислоти. Біосинтез глікозаміногліканів гальмується впливом глюкокортикоїдів, активується дією мінералокортикоїдів та гормону росту. Глікозаміноглікани добре розчинні у воді з утворенням в’язких розчинів. Величина в’язкості залежить від форми і розмірів молекул. Завдяки наявності карбоксильних та сульфатних груп всі глікозаміноглікани є поліаніонами. Їх негативний заряд притягує осмотично активні іони натрію, що веде до збільшенню об’єму води в позаклітинному матриксі і протидіє стисканню.
Основні класи глікозаміногліканів Гіалуронова кислота – у склоподібному тілі ока, пупочному канатику, синовіальній рідині суглобів. Має найбільшу в’язкість. Основна функція – зв’язування води та регуляція проникності тканин. У суглобах відіграє роль „мастила”. Мономерами є D-глюкуронова кислота та N-ацетил-D-глюкозамін. Гідроліз гіалуронової кислоти каталізує лізосомальний фермент в-гіалуронідаза, що розщеплює в-1,4-глікозидний зв’язок між дисахаридними одиницями гіалуронової кислоти. В результаті утворюється дисахарид, який розщеплюється лізосомальною в-глікозидазою. У хворих на ревматизм чи артрит знижена в’язкість синовіальної рідини– це пов’язане з де полімеризацією гіалуронової кислоти. Генетично зумовлена недостатність лізосомальних глікозидаз викликає накопичення в клітинах продуктів неповного розщеплення гліозаміногліканів та їх підвищене виведення із сечею. Такі стани мають назву мукополісахаридозів і характеризуються малорухливими суглобами, деформацією скелета, мутною рогівкою ока, затримкою розумового розвитку та росту. Діагностика їх ґрунтується на виявленні метаболітів у сечі та виявленні дефектів ферментів у культурі фібробластів. Під час вагітності для діагностики визначають активності відповідних ферментів у амніотичній рідині. Хондроїтин-4-сульфат та хондроїтин-6-сульфат. Перший міститься у хрящах, кістках, рогівці ока; другий – у шкірі, сухожиллях, зв’язках, пуп очному канатику та в серцевих клапанах. Мономерами є D-глюкуронова кислота та N-ацетил-D-галактозамін-4-сульфат (для „3” - N-ацетил-D-галактозамін-6-сульфат). Також розщеплюються в-гіалуронідазою, сульфатні групи видаляються дією сульфатаз. Дермантансульфат – характерний для шкіри та слизової шлунка. Мономерами є залишок L-ідуронової кислоти та N-ацетил-D-галактозамін-4-сульфат. Кератансульфат – у рогівці ока, у хрящах. Не містить ні D-глюкуронової ні L-ідуронової кислоти: мономерами є D-галактоза та N-ацетил-D-глюкозамін-6-сульфат. Гепарин та гепаринсульфат. Належать до глікозаміногліканів за будовою, а також оскільки синтезується тучними клітинами, які належать до клітинних елементів сполучної тканини. Мономерами гепарину є залишок D-глюкуронат-2-сульфата та N-ацетил-D-глюкозамін-6-сульфат.
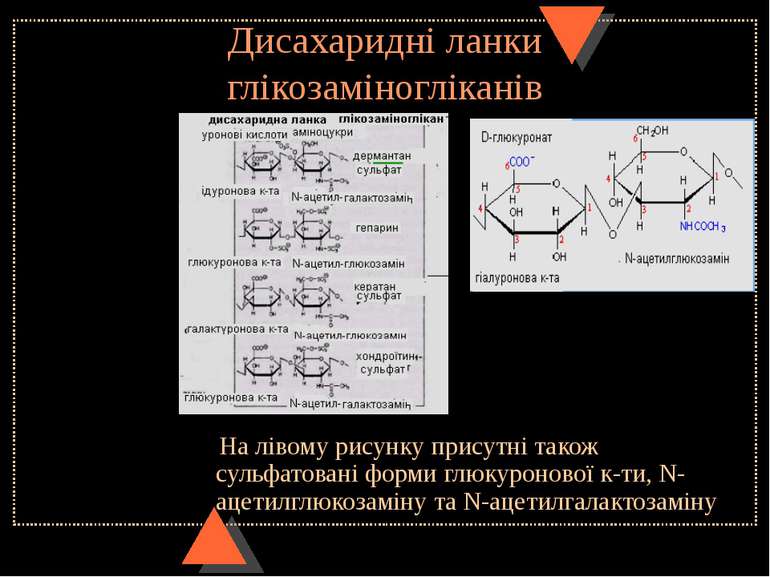
Дисахаридні ланки глікозаміногліканів На лівому рисунку присутні також сульфатовані форми глюкуронової к-ти, N-ацетилглюкозаміну та N-ацетилгалактозаміну
Протеоглікани. Білкові компоненти протеогліканів Білкові компоненти різних протеогліканів (інша назва яких – корові білки) відрізняються між собою; вони поєднуються із глікозаміногліканами через залишки серину; молекули хондроїтинсульфату приєднуються до „корового” білку зв’язком між серином та посередником – ксилозою, яка, не входячи до складу глікозаміноглікану, служить для його зв’язування із білком. При гідролізі протеогліканів їх білкова частина розщеплюється катепсинами. Найважливіші протеоглікани: агрекан (210 кД, міститься у хряшах, де виконує опірну ф-цію; містить хондроїтин- та кератансульфат), перлекан (міститься у базальній мембрані, 600 кД, має гепарансульфат), сіндекан (епітелій, 32 кД, ф-ції – клітинна адгезія)
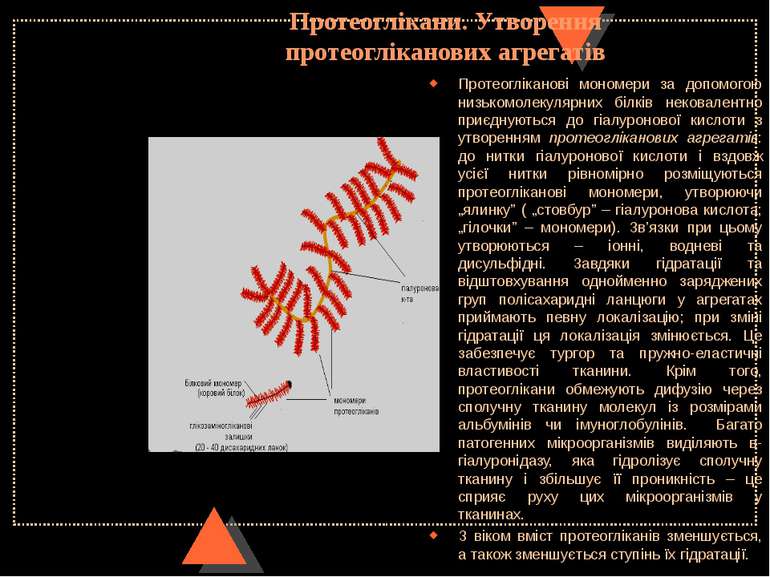
Протеоглікани. Утворення протеогліканових агрегатів Протеогліканові мономери за допомогою низькомолекулярних білків нековалентно приєднуються до гіалуронової кислоти з утворенням протеогліканових агрегатів: до нитки гіалуронової кислоти і вздовж усієї нитки рівномірно розміщуються протеогліканові мономери, утворюючи „ялинку” ( „стовбур” – гіалуронова кислота; „гілочки” – мономери). Зв’язки при цьому утворюються – іонні, водневі та дисульфідні. Завдяки гідратації та відштовхування однойменно заряджених груп полісахаридні ланцюги у агрегатах приймають певну локалізацію; при зміні гідратації ця локалізація змінюється. Це забезпечує тургор та пружно-еластичні властивості тканини. Крім того, протеоглікани обмежують дифузію через сполучну тканину молекул із розмірами альбумінів чи імуноглобулінів. Багато патогенних мікроорганізмів виділяють в-гіалуронідазу, яка гідролізує сполучну тканину і збільшує її проникність – це сприяє руху цих мікроорганізмів у тканинах. З віком вміст протеогліканів зменшується, а також зменшується ступінь їх гідратації.
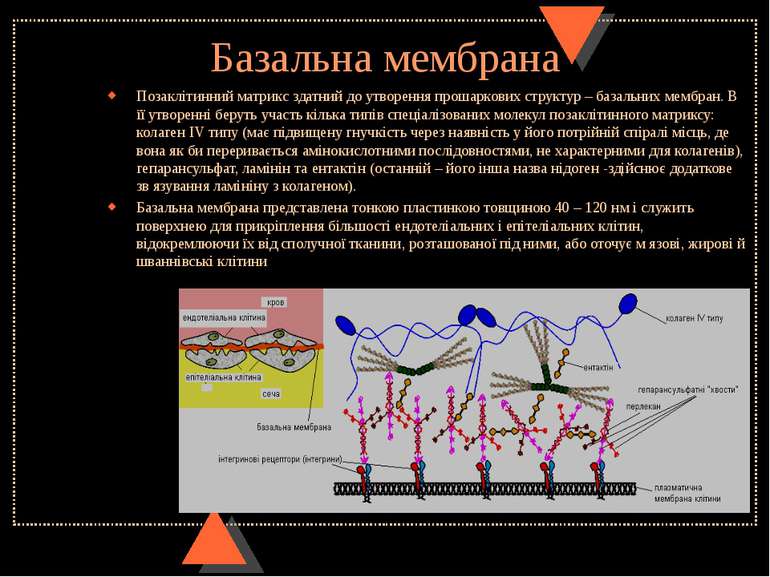
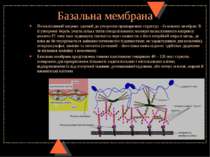
Базальна мембрана Позаклітинний матрикс здатний до утворення прошаркових структур – базальних мембран. В її утворенні беруть участь кілька типів спеціалізованих молекул позаклітинного матриксу: колаген IV типу (має підвищену гнучкість через наявність у його потрійній спіралі місць, де вона як би переривається амінокислотними послідовностями, не характерними для колагенів), гепарансульфат, ламінін та ентактін (останній – його інша назва нідоген -здійснює додаткове зв язування ламініну з колагеном). Базальна мембрана представлена тонкою пластинкою товщиною 40 – 120 нм і служить поверхнею для прикріплення більшості ендотеліальних і епітеліальних клітин, відокремлюючи їх від сполучної тканини, розташованої під ними, або оточує м язові, жирові й шваннівські клітини
Біохімія кісткової тканини Це особливий вид сполучної тканини, головна складова частина кістки, що утворює кісткові пластинки. Функції кісткової тканини: механічна підтримка, депонування Са++ і неорганічного фосфату, утворення клітин кровотворної системи, дозрівання В-клітин
Клітинні елементи кісткової тканини Остеобласти – беруть участь в утворенні міжклітинної речовини, мають розвинутий ЕПР з вираженим апаратом синтезу білків. Вони синтезують проколаген, який переміщується з ЕПР у комплекс Гольджі і включається у секреторні гранули. В результаті дії специфічних протеаз від проколагена відщеплюється N-кінцевий, а далі – і C-кінцевий домени і формується тропоколаген, який створює фібрили у міжклітинному просторі. Тут же синтезуються пртеоглікани і деякі ферменти. Остеоцити – зрілі відросткові клітини кісткової тканини, які виробляють компоненти міжклітинної речовини і замуровані в ньому. Вони утворюються з остеобластів при формуванні кісткової тканини. Остеокласти – гігантські багатоядерні клітини кісткової тканини, здатні резорбувати міжклітинну речовину кісткової тканини в процесі розвитку і перебудови кістки. Резорбція – це розсмоктування кістки за участю остеокластів; при цьому утворюються поглиблення ( лакуни) у кісткових пластинках. Крім того, остеокласти синтезують РНК та білки, але менш інтенсивно. Ці клітини містять багато лізосом та мітохондрій.
Хімічний склад компактної та губчастої кістки В залежності від щільності та розташування пластинок розрізняють компактну кісткову речовину ( у тілах довгих трубчастих кісток) та губчасту ( в епіфізах довгих кісток, у коротких а широких кістках).
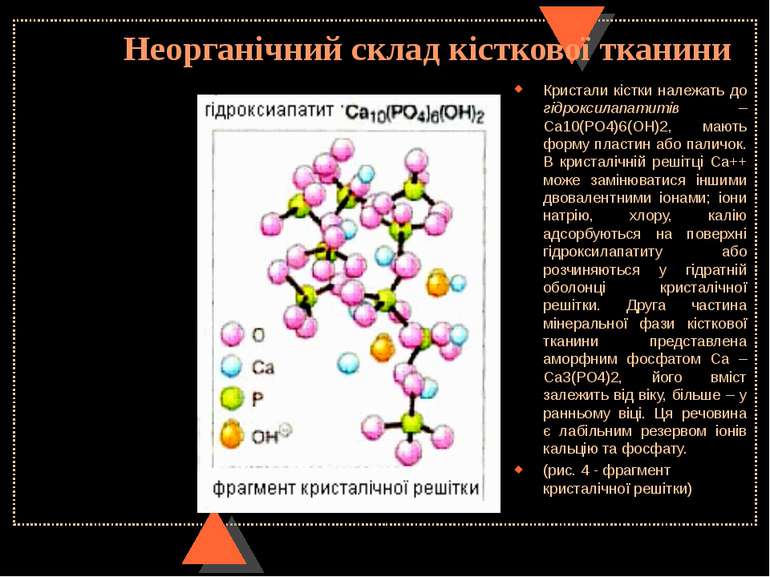
Неорганічний склад кісткової тканини Кристали кістки належать до гідроксилапатитів – Са10(РО4)6(ОН)2, мають форму пластин або паличок. В кристалічній решітці Са++ може замінюватися іншими двовалентними іонами; іони натрію, хлору, калію адсорбуються на поверхні гідроксилапатиту або розчиняються у гідратній оболонці кристалічної решітки. Друга частина мінеральної фази кісткової тканини представлена аморфним фосфатом Са – Са3(РО4)2, його вміст залежить від віку, більше – у ранньому віці. Ця речовина є лабільним резервом іонів кальцію та фосфату. (рис. 4 - фрагмент кристалічної решітки)
Органічний матрикс кісткової тканини 95% - колаген І типу. Його вміст разом із вмістом мінеральних компонентів визначає механічні властивості кісток. Він містить більше оксипроліну, більше вільних е-аміногруп лізинових та оксилізинових залишків та більше фосфатів, зв’язаних з залишками серину, ніж колаген сухожиль та шкіри. Неколагенові білки – це білкові компоненти протеогліканів та ін. Глікозаміноглікани представлені головним чином хондроїтин-4-сульфатом. При оссіфікації (це фізіологічний процес імпрегнації міжклітинної речовини хрящової або сполучної тканини мінеральними солями; синонім – окостеніння) сульфатовані глікозаміноглікани замінюються несульфатованими. Ліпіди кісткової тканини беруть участь у мінералізації кісток; Особливістю кісткового матриксу є високий вміст цитрату (90% загального вмісту в організмі). Він також необхідний для мінералізації кісток завдяки утворенню комплексів із солями Са та Р, забезпечуючи підвищення їх рівня до такого, при якому починаються кристалізація та мінералізація. Також є сукцинат, фумарат, малат, лактат.
Динаміка кісткової тканини (мінералізація і резорбція) Кісткова тканина перебудовується протягом всього життя. При цьому чергуються процеси руйнування (резорбції) кісткової тканини із звільненням Са та процеси мінералізації кісток зі зв’язуванням Са. Мінералізація здійснюється лише при наявності строго орієнтованих колагенових волокон: 1) один ряд молекул тропоколагену зміщений по відношенню до сусіднього на ј довжини молекули; 2) між кінцем однієї молекули і початком іншої є проміжки; вони є початковими центрами відкладення мінеральних речовин кістки ( утворення кристалів). Ці кристали надалі стають ядрами мінералізації, де у проміжках між колагеновими волокнами відкладається гідроксиапатит. При цьому в ділянках кальцифікації за участю лізосомальних протеїназ відбувається деградація протеогліканів; вода також витісняється і повністю мінералізована кістка є практично зневодненою ( 20% її маси – колаген, 80% - мінеральні компоненти). Мінералізації інших колагенвмісних тканин ( шкіри, сухожиль, судинних стінок) запобігає постійний вміст у них протеогліканів. При резорбції кісткової тканини одночасно „розсмоктуються” як мінеральні, так і органічні структури кісткової тканини. У видаленні мінеральних солей відіграє роль посилена продукція органічних кислот ( напр., лактату) при остеолізі ( це розсмоктування органічної ділянки кістки без наступного заміщення іншою тканиною), що сприяє розчиненню мінералів. Для резорбції органічного матриксу необхідна низка ферментів: 1) колагенолітичні ферменти (колагеназа) – викликають утворення фрагментів колагену; 2) лізосомні кислі гідролази - здійснюють внутрішньоклітинне перетравлювання утворених фрагментів.
Регуляція мінералізації та резорбції Паратгормон (гормон паращитоподібних залоз) активує резорбцію кістки (її неорганічного і органічного матриксу) шляхом збільшення числа остеокластів та їх активності (зокрема, в них активується синтез ферментів, які беруть участь у резорбції кісткової тканини). Внаслідок цього Са++ і фосфати виходять у позаклітинний простір і у кров. Зворотню дію має кальцитонін - гормон щитоподібної залози: він є гормоном гіпокальціємійної дії, що гальмує резорбцію і зменшує вміст у плазмі крові Са++ і неорганічних фосфатів. Механізми дії: кальцитонін пригнічує функції остеокластів та зменшує їх утворення із клітин-попередників Кальцитріол (1,25(ОН)2D3) - сполука гормонального типу, що утворюється в організмі з біологічного попередника - жиророзчинного вітаміну D3 (холекальциферолу) - стимулює всмоктування Са++ і фосфатів у кишечнику, підтримуючи фізіологічні концентрації цих іонів у плазмі крові, що забезпечує умови для нормальної побудови кісткової тканини Для нормального протікання кальцифікації кісток важливим є надходження в організм оптимальних доз вітамінів D, А та С.
Деякі особливості біохімії зубу: органічний склад Органічні компоненти зубу – білки, нуклеїнові кислоти, вуглеводи, ліпіди, вітаміни, органічні кислоти. Білки – колаген і неколагенові білки типу фосфопротеїдів і глікопротеїдів, які утворюють прошарки між кристалами Мукополісахариди: вільні та зв’язані із білками, тобто протеоглікани – хондроїтин-4-сульфати, хондроїтин-6-сульфати та гіалуронова кислота. Молекули мукополісахаридів є поліаніонами, тобто містять велику кількість кислих груп, завдяки чому можуть концентрувати катіони. Роль мукополісахаридів – «пластифікатори» колагенової сітки, які підвищують її розтягненість і збільшують її набухання. Вони адсорбують іони Са і Р; при їх руйнуванні процеси мінералізації порушуються ( напр., під впливом іонізуючого опромінення підвищується активність гіалуронідази, який деполімеризує гіалуронову кислоту). Вуглеводи: глікоген, галактоза, мальтоза, фруктоза, ксилоза. Глікоген є джерелом енергії для утворення ядер кристалізації і локалізується у місцях майбутнього центра кристалізації. Крім того, глікоген є джерелом фосфорних ефірів глюкози – субстратів фосфатази, яка відіграє велику роль в утворенні зубу. Глікоген є також джерелом моносахаридів, які входять до складу вуглеводно-білкових комплексів розчинних та нерозчинних білків зуба, підвищуючи їх реакційну здатність. Ліпіди – 0,2-0,6%. Кислі ліпіди зв’язують Са і беруть участь в утворенні ядер кристалізації. Крім того, ліпіди беруть участь у стабілізації аморфного фосфата кальцію. Цитрат – ( 0,2% - у емалі; 1% - у дентині та цементі) має високу комплексоутворюючу здатність, через що бере участь у процесах мінералізації/де мінералізації, утворюючи із фосфатом Са розчинну транспортну форму. Цей процес регулюється гормонами щитоподібних залоз ( їх введення збільшує вміст цитрату). Нуклеїнові кислоти – багато у пульпі зубів. Їх вміст зростає в остеобластах та одонтобластах при мінералізації та ремінералізації зубe.
Деякі особливості біохімії зубу: мінеральний склад Основні елементи – Са, Р, фтор, натрій, магній, які утворюють кристали гідроксиапатиту, формула якого: Са10 (РО4)6(ОН)2 Фторапатит - Са10 (РО4)6F2 - погано розчинний в органічних кислотах; утворення фторапатиту збільшує твердість емалі, знижує її проникність, підвищує резистентність зубів до карієсогенних факторів Карбонатапатит - Са10 (РО4)5СО3(ОН)2 є менш стійким до органічних кислот. Особливості кристалів зубу в тому, що в гідроксиапатиті зубу може бути дефіцит ( вакантні місця) кальцію. Цим пояснюється низьке співвідношення Са і Р у поверхневих шарах зубу, що інколи спостерігається.
Особливості мінерального обміну в тканинах зубу Основа мінерального обміну у тканинах зубу – 3 процеси: - мінералізація; - демінералізація; - ремінералізація; Мінералізація – напр., в період прорізування зубу, визначається станом білкового та мінерального обміну, повноцінним білковим харчуванням, оптимальним вмістом мікро-і мікроелементів у воді та продуктах харчування. Зуб прорізується із недосконалою емаллю; більш високий вміст Са і Р у слині, оптимальний вміст фтору, молібдену, магнію, ванадію, стронцію сприяють дозріванню емалі та формуванню твердої поверхні. Порушення мінералізації веде до утворення ділянок пониженої мінералізації та низької резистентності до карієсу. Демінералізація – фізіологічно зворотній процес, який в нормі врівноважений мінералізацією. Це постійна рекристалізація гідроксиапатита. Посилюється – при порушенні синтезу колагенових та не колагенових білків, зниженні вміст Са у слині, зростанні утворення кислих продуктів. При зниженні у емалі коефіцієнту вмісту Са до Р ( норма – 1/3) фізіологічна декальцинація переходить у патологічну. У каріозній емалі коефіцієнт Са/р знижується. Ремінералізація – відновлення ушкоджених ділянок зуба та іонне заміщення гідроксиапатита ( напр., Са заміщується на фтор) в залежності від характера харчування та стану метаболізма у тканинах зубу.
ВПЛИВ НАЙВАЖЛИВІШИХ МІКРОЕЛЕМЕНТІВ НА СТРУКТУРУ ЗУБУ Фтор підвищує стійкість зуба до карієсу; фторапатит погано розчинний в органічних кислотах; утворення фторапатиту збільшує твердість емалі, знижує її проникність, підвищує резистентність зубів до карієсогенних факторів. Механізм – інгібуюча дія фтору на ферменти гліколізу у бактерій, що затримує утворення органічних кислот та зниження рН середовища. Найбільший вміст фтору у тканинах зубу – до їх прорізування в період мінералізації. При надлишковому надходженні фтору – флюороз ( «крапчастість» емалі). Фтор у великих дозах є ферментативною отрутою, яка знижує активність фосфатази, порушує функцію щитоподібної залози. Фтор утворює з іонами Са комплекс, який виводиться із організму, в результаті зменшується вміст Са і порушується мінералізація зубу. В той же час недостатність фтору затримує розвиток зубів. Вміст фтору у емалі та дентині тісно пов’язана із надходженням його в організм із питною водою та їжею. Оптимум вмісту фтору у воді – 1,5 мг/л. Потенційну токсичність фтористих сполук зменшує Са. При надлишку стронцію у складі апатиту порушується ідеальна архітектоніка кристалу, кісткова тканина зубу стає крихкою. Адже стронцій при його надлишку у навколишньому середовищі здатний витісняти Са із кристалічної решітки і замінювати його там. Рекристалізація – розчинення кристалів та їх утворення знову – залежить від співвідношення іонів Са і Р, від їх нормального вмісту у слині. Кристали гідроксиапатиту стійкі при співвідношенні Са/Р у слині 1,5-1,67. Вміст Са і Р збільшується у напрямку до межі поверхні емалі. При Са/р = 1,33 структура гідроксиапатиту руйнується. Цинк, барій – активують декальцинацію і інгибують мінералізацію; Селен – карієсогенний елемент; при його надлишку у грунті – висока захворюваність на карієс у населення. Магній, марганець, ванадій, стронцій – посилюють мінералізацію. Молібден – у мікродозах посилює стійкість до карієсу. Великий вміст усіх мікроелементів погано діють на стан зубів.
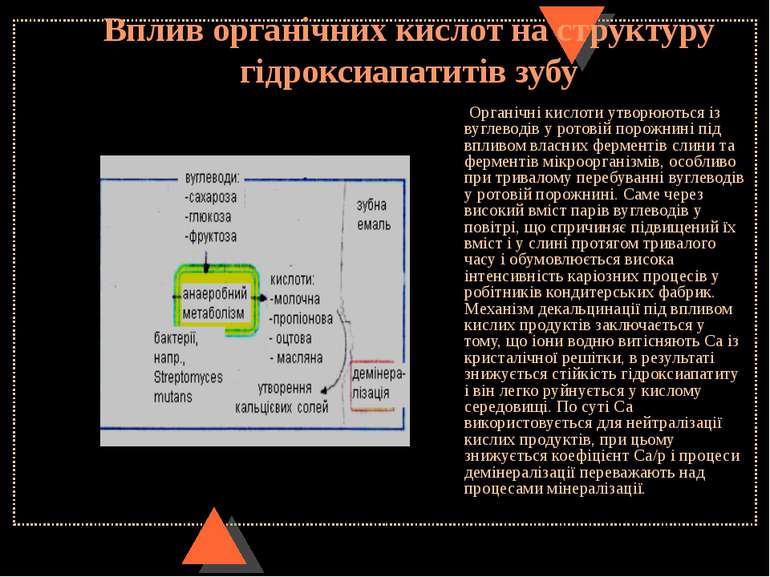
Вплив органічних кислот на структуру гідроксиапатитів зубу Органічні кислоти утворюються із вуглеводів у ротовій порожнині під впливом власних ферментів слини та ферментів мікроорганізмів, особливо при тривалому перебуванні вуглеводів у ротовій порожнині. Саме через високий вміст парів вуглеводів у повітрі, що спричиняє підвищений їх вміст і у слині протягом тривалого часу і обумовлюється висока інтенсивність каріозних процесів у робітників кондитерських фабрик. Механізм декальцинації під впливом кислих продуктів заключається у тому, що іони водню витісняють Са із кристалічної решітки, в результаті знижується стійкість гідроксиапатиту і він легко руйнується у кислому середовищі. По суті Са використовується для нейтралізації кислих продуктів, при цьому знижується коефіцієнт Са/р і процеси демінералізації переважають над процесами мінералізації.
БІОХІМІЧНІ ЗМІНИ У ТКАНИНАХ ЗУБА ПРИ ПАТОЛОГІЇ. Гіперплазія – надлишкове утворення емалі. Причина – недостатнє надходження Са та надлишкове – фтору у тканини зубу. Гіпоплазія – недорозвиток зубу або його тканин. Причина – гіпофункція паращитоподібної залози, рахіт у дитинстві, недостатність вітаміну D; Кислотний некроз – професійне захворювання робітників хімічних підприємств: зниження рН слини сприяє розчиненню тканин зубу; Флюороз – інтоксикація фтором, який є ферментативною отрутою. Карієс – в основі лежить декальцинація емалі, яка супроводжується зміною форми, розміру, орієнтації кристалів гідроксиапатиту. Іони Са покидають кристалічну решітку гідроксиапатиту ( під дією органічних кислот, гіповітамінозу D, гіпофункції гормонів). Далі втрачається і Р. В ділянці каріозного ураження знижується вміст Са, Р, фтору.
Схожі презентації
Категорії