Презентація на тему:
Біохімія крові ч І Клітини крові
Завантажити презентацію
Біохімія крові ч І Клітини крові
Завантажити презентаціюПрезентація по слайдам:
Біохімія крові. ч.І. Загальні властивості й функції крові. Біохімія клітин крові. Гемоглобін. Біохімія плазми крові.
Функції крові Основна - поєднання біохімічних процесів різних частин тіла в цілісну систему та підтримка постійності складу цієї системи Інші функції: - транспорт газів - транспорт поживних речовин до всіх клітин організму та виведення до нирок кінцевих продуктів обміну - регуляторна (утворення у крові місцевих гормонів - гормоноїдів, які переносяться до клітин-мішеней, а також транспорт гормонів, що секретуються ін. ендокринними залозами, та ін. біорегуляторів до місця їх дії - терморегуляція - осмотична - підтримка осмотичного тиску в судинах - захисна - зумовлена наявністю у крові антитіл та фагоцитарною функцією лейкоцитів - детоксикаційна - знешкодження токсинів шляхом їх активного розщеплення ферментами крові
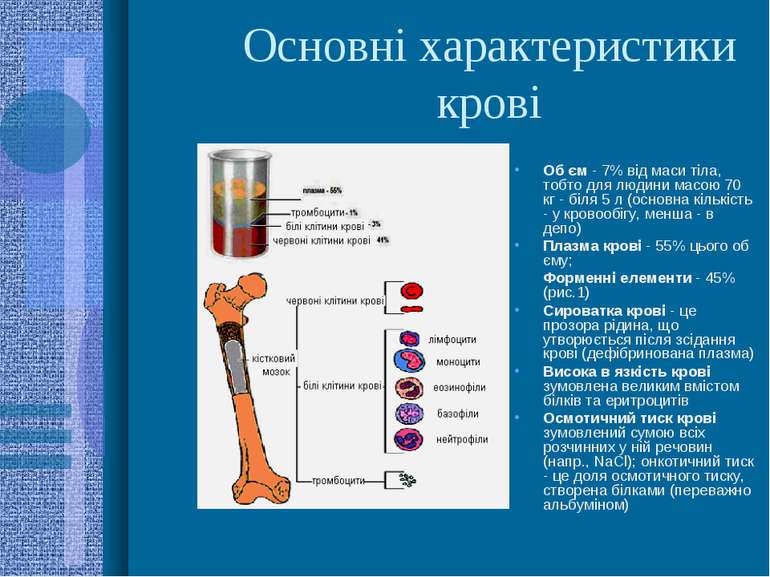
Основні характеристики крові Об єм - 7% від маси тіла, тобто для людини масою 70 кг - біля 5 л (основна кількість - у кровообігу, менша - в депо) Плазма крові - 55% цього об єму; Форменні елементи - 45% (рис.1) Сироватка крові - це прозора рідина, що утворюється після зсідання крові (дефібринована плазма) Висока в язкість крові зумовлена великим вмістом білків та еритроцитів Осмотичний тиск крові зумовлений сумою всіх розчинних у ній речовин (напр., NaCl); онкотичний тиск - це доля осмотичного тиску, створена білками (переважно альбуміном)
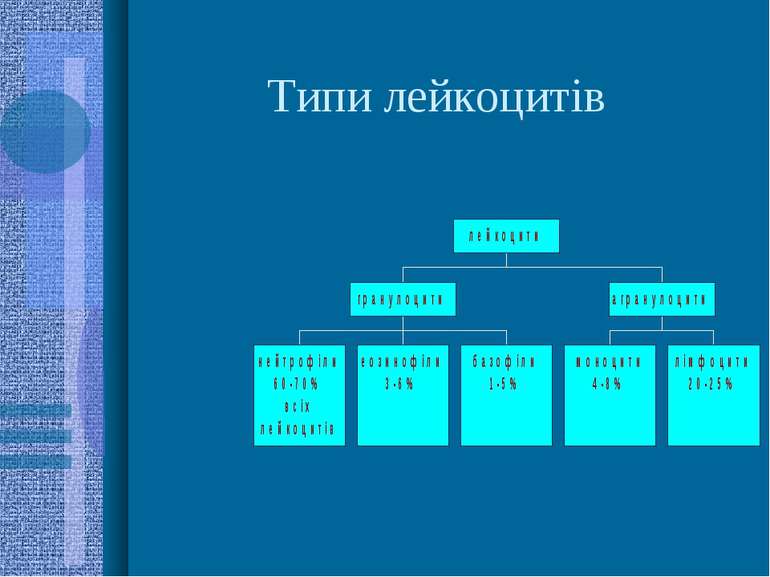
Клітини крові. Лейкоцити (білі кров яні тільця) Норма - 4 000 - 9 000 кл/1 мкл крові Основна функція - захист організму від мікроорганізмів, вірусів, сторонніх речовин
Функції лейкоцитів Нейтрофіли - забезпечують головний захист організму від мікроорганізмів і вірусів; вміст цих клітин зростає при запальних захворюваннях різної етіології, при злоякісних пухлинах, вагітності; зменшується - при грипі, хв. Боткіна, вітряній оспі, поліомієліті, тяжкому сепсисі, апластичних і В12-дефіцитних анеміях, прийомі деяких ліків (цитостатики, амідо- і реопірин, антибіотики, сульфаніламіди) Базофіли - беруть участь в алергічних реакціях, зсіданні крові, внутрішньосудинному ліполізі. мають апарат синтезу білка і синтезують медіатори алергічних реакцій - гістамін і серотонін, які при алергії викликають місцеве запалення. Базофілія спостерігається за хронічного мієлолейкозу, тіреотоксикозу Еозинофіли - функція подібна до нейтрофілів; також відіграють роль у розвитку алергійних станів, за яких їх вміст зростає. Еозинофілію, крім того, спричиняють деякі ліки (див. вище), злоякісні новоутворення, системні хвороби, гельмінтози. Еозинопенія - за апластичних і В12-дефіцитних анемій, в гострому періоді інфекційних захворювань Моноцити - за функціями є макрофагами; тканинні макрофаги (м. печінки - купферівськи клітини, альвеолярні макрофаги легенів) також походять від моноцитів крові. Основні функції - ендо- і фагоцитоз. Моноцитоз характерний для низки інфекційних захворювань (краснуха, скаротина, паротит), тяжкого сепсису, туберкульозу, інфекційного мононуклеозу тощо Лімфоцити - утворюються у лімфоїдній тканині або в тимусі. Роль - формування гуморального і клітинного імунітету, синтез білків імуноглобулінів. Лімфоцитоз - хронічна променева хв.. бронх. астма, голодування, як “+” ознака - при лікуванні туберкульозу. Лімфопенія - ВІЛ/СНІД, лімфогранульоматоз, туберкульоз, мієлолейкоз
Клітини крові. Тромбоцити. Утворюються у кістковому мозку. Живуть 5-7 днів, не містять ядра. Здатні до синтезу білків скоротливої системи (актин, міозин, тропонін, тропоміозин), синтезують простогландини і тромбоксани, які сприяють агрегації тромбоцитів і звуженню судин. Нормальна к-ть - 200-400 тис/1 мкл Основна їх роль - у процесі гемостазу (здатні підтримувати нормальну структуру і функції стінок мікросудин, здатні утворювати у пошкоджених судинах первинну тромбоцитарну пробку, беруть участь у зсіданні крові, впливають на фібриноліз) Діагностичне значення має дослідження адгезивно-агрегаційної функції тромбоцитів (ААФТ) з визначенням індексу ретенції (адгезивності) тромбоцитів, який у нормі = 20 - 55%. Його зменшення до 0 спостерігається при вроджених тромбоцитопатіях, спадковому дефекті тромбоцитів, хв. Віллєбранда, при змінах у плазмі, за яких пригнічується функція тромбоцитів, при тромбоцитопеніях, при вторинних тромбоцитопатіях за мієломи, уремії, цирозу печінки, при прийомі аспірину. Зростання індексу відповідає тромбозам. Другий показник - час утворення крупних агрегатів тромбоцитів (норма - 10-60 с) - відображує стан агрегації тромбоцитів. Його зниження спостерігають у випадках, описаних вище для індексу ретенції. Посилення - за інфаркту міокарду.
Клітини крові. Еритроцити (червоні кров яні клітини) Норма - 3,7-5,1 млн/1 мкл (ж) і 4-5,5 млн/1 мкл (ч). Утворюються в червоному кістковому мозку із стовбурових клітин. В процесі еритропоезу клітини-попередники зменшуються у розмірах, їх ядра руйнуються і виштовхуються із клітин, активно синтезується гемоглобін. У зрілих клітинах рибосоми і мітохондрії зникають, а енергію для функціонування еритроцити беруть із анаеробних процесів. Швидкість еритропоезу регулюється гормоноїдами еритропоетинами, які виробляються у нирках, в печінці й селезінці і стимулюють клітинну диференціацію й проліферацію. Тривалість життя еритроцитів - 110-120 днів. Клітина має форму подвійновогнутого диску з потовщенням по краях. Розміри клітин різні й залежать від статі, віку, кліматичних умов проживання. Основна функція - транспорт СО2 і О2, що забезпечує постачання тканинам кисню і виведення із них вуглекислоти. При зниженні вмісту кисню у повітрі кількість еритроцитів компенсаторно зростає. Зниження вмісту еритроцитів є однією з ознак анемії. Еритроцитоз може бути спричинений гіпоксією (захв. легенів, вроджені вади серця, аномальні гемоглобіни), зростанням продукції еритропоетину (гідронефроз, полікістоз нирок, стеноз ниркової артерії, рак яєчників. ін.), надлишком адренокортикотропіну чи андрогенів (синдром Кушінга, гіперальдостеронізм) - це т. зв. абсолютні еритроцитози. Відносні еритроцитози пов язані зі зневодненням (вживання діуретиків, діарея, тощо), стресом. Для діагностики важливе значення мають морфологічні ознаки еритроцитів: анізоцитоз - поява еритроцитів різного розміру, пойкілоцитоз - різної форми, анізохромія - різного забарвлення є ознаками різних форм анемії.
Еритроцитарні ферменти антиоксидантного захисту Ферменти, що характеризують антиоксидантну систему захисту і містяться у еритроцитах: - еритроцитарна супероксиддисмутаза (СОД, каталізує реакцію: 2О2-+ 2Н+ Н2О2 +О2 , зв язуючи таким чином супероксидний радикал; у відсутності СОД супероксидний радикал спонтанно розлагається із утворенням ще більш агресивного вільного радикалу - синглетного кисню, який ушкоджує білки, НК, ліпіди тощо). - каталаза (каталізує реакцію розложення перекису водню: 2Н2О2 2Н2О +О2). Для клітин важливе певне співвідношення активностей СОД і каталази, т.я. різке зростання аткивності СОД без відповідних змін у активності каталази спричинить появу надлишку Н2О2 . - глутатіонредуктаза (каталізує реакцію: Г-S-S-Г +НАДФН2 2Г-SН +НАДФ; окислений відновлений глутатіон глутатіон бере т.ч. участь у підтримці пулу відновленого глутатіону, який необхідний для захисту численних білків і ДНК від окисних ушкоджень; також необхідна для збереження цілісності еритроцитів, зберігає сульфгідрільні групи різних ферментів у відновленому стані. - глутатіонпероксидаза - каталізує реакції: 2Г-SН +Н2О2 Г-S-S-Г + 2Н2О та 2Г-SН +ROOH (гідроперекис) Г-S-S-Г + ROH +Н2О, тобто поряд із каталазою бере участь у знешкодженні перекису водню, а також знешкоджує гідроперекиси.
Гемоглобін - найважливіший компонент еритроцитів Гемоглобін (Hb) належить до хромопротеїнів і виконує функції транспорту СО2 і О2, зв язування токсичних продуктів обміну (ціанідів, СО), підтримки сталості рН як основа гемоглобінової буферної системи. Молекула Hb складається із 4-х с/о, кожна з яких містить гем і поліпептидний ланцюг глобіну. Вся молекула містить 4 геми і 4 ланцюги глобіну. Поліпептидні ланцюги у складі молекул гемоглобіну попарно однакові (тобто 2 - одного виду, 2 - іншого). Гем Hb складається з 4-х пірольних кілець, зв язаних метиновими місточками. В центрі - атом Fe2+, що має 6 координаційних зв язків: 4 - з атомами N пірольних кілець, 5-тий - для зв язку із глобіном, а 6-й - для зв язку з О2 в оксигемоглобіні або з СО у карбоксигемоглобіні
Типи гемоглобінів Основний Hb дорослої людини - HbА (2альфа-, 2бета-ланцюги). Мінорними Hb (їх біля 10%) є HbА2 (2альфа-,2-дельта) та глікіровані Hb (тобто зв язані з різними вуглеводами, зокрема, з глюкозою) - HbА1b i HbA1c В онтогенезі типи Hb змінюються так: ембріональні фетальні дорослі Така зміна пов язана з особливостями постачання тканин киснем та зі зміною органів кровотворення. Ембріональні Hb (синтезуються з 2 до 14 тижня в/у розвитку) - Говер-1 (4 епсілант-ланцюги), Говер-2 (2альфа-, 2епсілант-), Портланд 1 (2гама-, 2сігма-)
Типи гемоглобінів (продовження) Фетальний Hb плода ( синтезується з 15 тижня, максимальний рівень синтезу - перед моментом народження) - HbF (2альфа- і 2гама-), має кілька форм через утворення комплексів з глюкозою, фосфатами, ін. В перші дні після народження він замінюється на HbА. Фетальний Hb має підвищену спорідненість до кисню Поява ембріональних гемоглобінів у дітей після народження свідчить про повернення до ембріонального типу кровотворення і характерне для набутих захворювань крові - лейкемій, лімфогранульоматозу, ін. Продукт старіння Hb - його комплекс з глутатіоном, утворення якого характерне для всіх типів Hb (“старий” HbА - це HbА3) Глікіруванню окрім HbА можуть підлягати й інші - як нормальні, так і аномальні. Така реакція змінює структуру і функції Hb, у т.ч. і його спорідненість до кисню, при чому порушується віддача його тканинам, що веде до гіпоксії тканин - такі процеси спостерігаються за цукрового діабету. Визначення глікірованих Hb важливе для діагностики цукрового діабету, контроля його компенсації, прогноза ускладнень, клінічного контролю. Окси Hb, карб Hb, карбокси Hb, мет Hb будуть описані у наступних слайдах
Аномальні гемоглобіни та гемоглобінові захворювання: гемоглобінопатії Мутантних Hb - біля 600 видів; вони містять одиничну заміну в альфа-чи бета-ланцюзі, рідше - делеції чи вставки амінокислот. Такі стани мають назву гемоглобінопатії. Більшість з цих Hb функціонують нормально. Прикладами мутованих Hb є HbЕ (2альфа-, 2бета-,26 глутамінова кислота лізин), HbС (2альфа-, 2бета-,6 глутамінова кислота лізин), HbS (2альфа-, 2бета-,6 глутамінова кислота валін), HbМ (5 різновидів, одиночні заміни амінокислот в альфа-чи бета-ланцюзі поряд із гемом), гемоглобіни Москва, Волга, Можайськ, Хельсінки, Цюріх та ін.
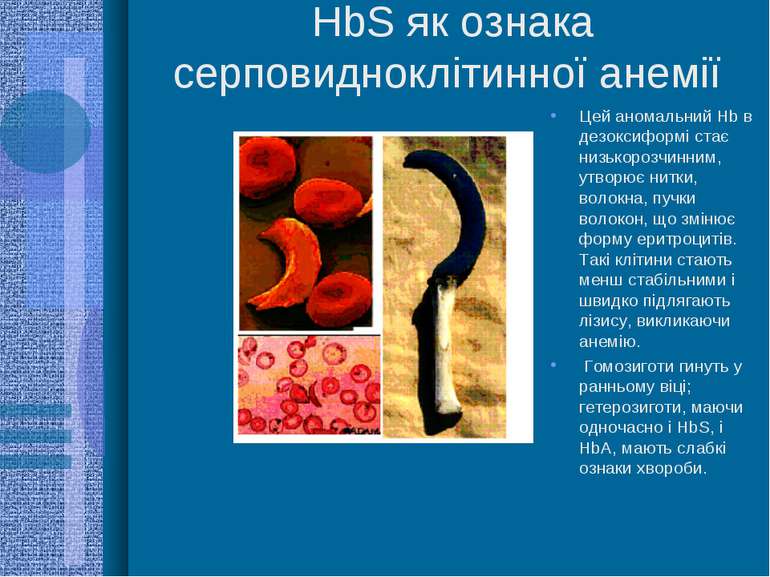
HbS як ознака серповидноклітинної анемії Цей аномальний Hb в дезоксиформі стає низькорозчинним, утворює нитки, волокна, пучки волокон, що змінює форму еритроцитів. Такі клітини стають менш стабільними і швидко підлягають лізису, викликаючи анемію. Гомозиготи гинуть у ранньому віці; гетерозиготи, маючи одночасно і HbS, і HbА, мають слабкі ознаки хвороби.
Аномальні гемоглобіни та гемоглобінові захворювання: таласемії Пов язані зі спадковим порушенням утворення рівних кількостей альфа- і бета-ланцюгів (альфа- і бета-таласемії, відповідно) , або повної відсутності синтезу одного виду ланцюгів. Надлишкові ланцюги утворюють осад, рівень гемоглобіну і термін життя еритроцитів знижується. Це гетерогенні хвороби: існує 4 типи альфа-таласемії, понад 100 мутацій, що спричиняють бета-таласемію, що клінічно проявляється теж у 4 формах (сильна, проміжна, мала, мінімальна) Гомозиготні форми спричиняють смерть у ранньому віці
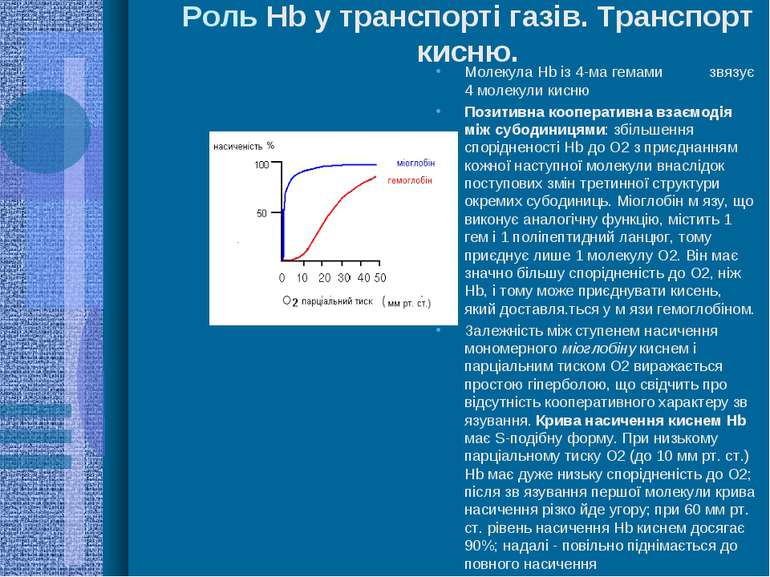
Роль Hb у транспорті газів. Транспорт кисню. Молекула Hb із 4-ма гемами звязує 4 молекули кисню Позитивна кооперативна взаємодія між субодиницями: збільшення спорідненості Hb до О2 з приєднанням кожної наступної молекули внаслідок поступових змін третинної структури окремих субодиниць. Міоглобін м язу, що виконує аналогічну функцію, містить 1 гем і 1 поліпептидний ланцюг, тому приєднує лише 1 молекулу О2. Він має значно більшу спорідненість до О2, ніж Hb, і тому може приєднувати кисень, який доставля.ться у м язи гемоглобіном. Залежність між ступенем насичення мономерного міоглобіну киснем і парціальним тиском О2 виражається простою гіперболою, що свідчить про відсутність кооперативного характеру зв язування. Крива насичення киснем Hb має S-подібну форму. При низькому парціальному тиску О2 (до 10 мм рт. ст.) Hb має дуже низьку спорідненість до О2; після зв язування першої молекули крива насичення різко йде угору; при 60 мм рт. ст. рівень насичення Hb киснем досягає 90%; надалі - повільно піднімається до повного насичення
Роль Hb у транспорті газів. Транспорт кисню (продовження) Рушійною силою для перенесення О2 є різниця його парціального тиску в альвеолярному повітрі (100 мм рт. ст.), рідинах (венозна кров - 40 мм рт. ст., артеріальна кров - 95 мм рт. ст.) і в тканинах організму (міжклітинна рідина - 35 мм рт. ст.). Під час протікання крові через капіляри оксигемоглобін дисоціює, причому ступінь дисоціації залежить від інтенсивності окислювальних процесів у тканинах. Кисень дифундує з еритроцитів через плазму крові у міжклітинну рідину, а потім - у клітини тканин, де і використовується. В тканинах звільнюється біля третини зв язаного кисню. На зв язування Hb кисню впливають, окрім його парціального тиску: температура, рН, вміст СО2 і 2,3-дифосфогліцерату. Підвищення вмісту Н+ і СО2 знижує спорідненість Hb до О2 і сприяє звільненню кисню з оксигемоглобіну (ефект Бора). Подібно діють і інші зазначені фактори. Дифосфогліцерат - проміжний продукт гліколізу - міститься в еритроцитах і, зв язуючись із оксигемоглобіном, сприяє дисоціації кисню. Вміст дифосфогліцерату зростає при підйомах на велику висоту (3-4 км над рівнем моря), а також при патологічних гіпоксіях. При цьому збільшення ступеня дисоціації оксигемоглобіну в тканинах компенсує зниження кількості кисню, який зв язується з Hb у легенях при гіпоксії. Крива насичення Hb киснем під дією цих факторів зміщується вправо
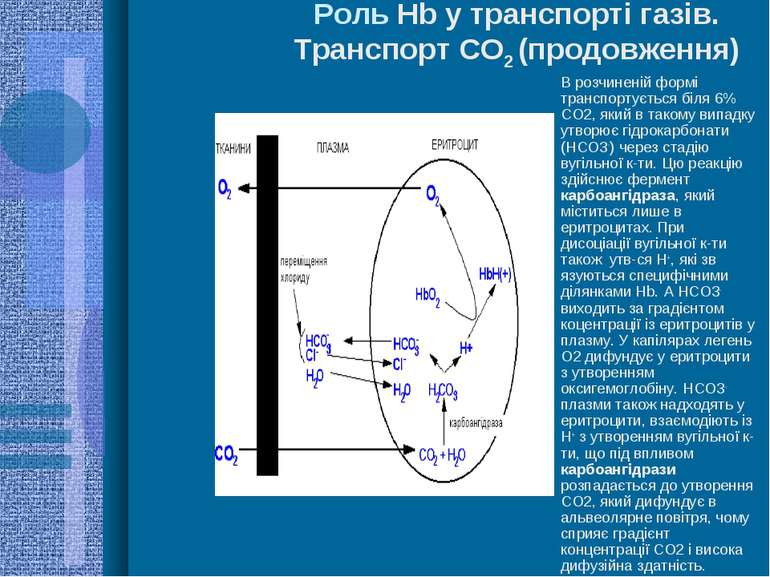
Роль Hb у транспорті газів. Транспорт СО2 СО2 утворюється в тканинах - в основному при окислювальному декарбоксилюванні альфа-кетокислот Парціальний тиск СО2 у міжклітинній рідині - 50 мм рт. ст., в артеріальній крові - 40 мм рт. ст. Коефіцієнт дифузії СО2 у 30 разів більший, ніж для О2, тому навіть за такої невеликої різниці тисків він швидко дифундує з тканин через міжклітинну рідину, стінку капілярів у кров
Роль Hb у транспорті газів. Транспорт СО2 (продовження) В розчиненій формі транспортується біля 6% СО2, який в такому випадку утворює гідрокарбонати (НСО3-) через стадію вугільної к-ти. Цю реакцію здійснює фермент карбоангідраза, який міститься лише в еритроцитах. При дисоціації вугільної к-ти також утв-ся Н+, які зв язуються специфічними ділянками Hb. А НСО3- виходить за градієнтом коцентрації із еритроцитів у плазму. У капілярах легень О2 дифундує у еритроцити з утворенням оксигемоглобіну. НСО3- плазми також надходять у еритроцити, взаємодіють із Н+ з утворенням вугільної к-ти, що під впливом карбоангідрази розпадається до утворення СО2, який дифундує в альвеолярне повітря, чому сприяє градієнт концентрації СО2 і висока дифузійна здатність.
Роль Hb у транспорті газів. Транспорт СО2 (продовження) Гемоглобін і безпосередньо зв язує СО2 N-кінцевою альфа-аміногрупою кожного з 4-х поліпептидних ланцюгів з утворенням карбгемоглобіну: Hb-NH2 +CO2 Hb-NH-COO- +H+ Ця зворотня реакція в капілярах тканин йде зліва направо, а в легенях - зворотньо
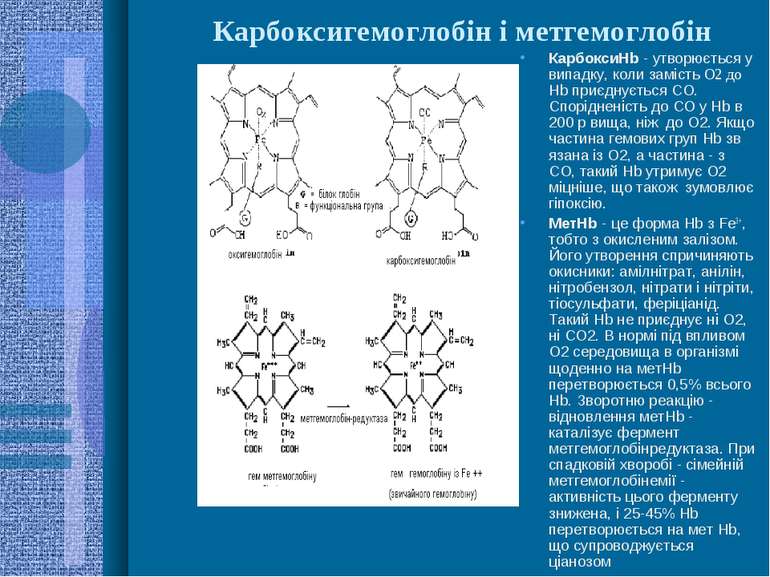
Карбоксигемоглобін і метгемоглобін КарбоксиHb - утворюється у випадку, коли замість О2 до Hb приєднується СО. Спорідненість до СО у Hb в 200 р вища, ніж до О2. Якщо частина гемових груп Hb зв язана із О2, а частина - з СО, такий Hb утримує О2 міцніше, що також зумовлює гіпоксію. МетHb - це форма Hb з Fe3+, тобто з окисленим залізом. Його утворення спричиняють окисники: амілнітрат, анілін, нітробензол, нітрати і нітріти, тіосульфати, феріціанід. Такий Hb не приєднує ні О2, ні СО2. В нормі під впливом О2 середовища в організмі щоденно на метHb перетворюється 0,5% всього Hb. Зворотню реакцію - відновлення метHb - каталізує фермент метгемоглобінредуктаза. При спадковій хворобі - сімейній метгемоглобінемії - активність цього ферменту знижена, і 25-45% Hb перетворюється на мет Hb, що супроводжується ціанозом
Плазма крові. Білки 90-91% води, 9-10% сухого залишку Плазма містить кілька десятків різних білків - транспортні, ферменти, проферменти, інгібітори ферментів, гормони, антитіла, антитоксини, про- і антикоагулянти тощо. Загальний вміст білків у плазмі - 65-85 г/л Зменшення цього показнику - гіпопротеїнемія (до 30-40 г/л) - завжди за нефротичного синдрому, ушкодження печінкових клітин, ШКТ, голодування, виснажливих інфекційних захворювань, стану після важких травм і оперативних втручань, кахексії при злоякісних новоутвореннях тощо. Гіперпротеїнемія ( 100-160 г/л) спостерігається при діареї, рвоті, обширних опіках, мієломній хворобі Диспротеїнемія - зміна відсоткового вмісту окремих білкових фракцій без зміни загального білка За умов електрофорезу на папері, поширеного у клініці, білки плазми поділяють на 5 фракцій; в окремі групи виділяють білки-прокоагулянти і антикоагулянти, які будуть розглянуті при знайомстві із системою гемостазу
Плазма крові. Альбуміни 55-60% білків плазми Функції: - створення онкотичного тиску (при зниженні вмісту альбумінів розвиваються набряки, а хворим із тканинними набряками переливають розчини альбумінів). Пов язана із тим, що альбуміни є високогідрофільними сполуками і легко зв язують значну к-ть води, через що їх об єм зростає майже удвічі - транспортна - ці білки, маючи специфічні ділянки для зв язування, переносять ряд речовин, погано розчинних у воді (вільні жирні к-ти, білірубін, стероїдні гомони, іони металів, деякі ліки). - детоксикаційна - пов язана із попередньою функцією
Плазма крові. Глобуліни Альфа- і бета-глобуліни - транспортні білки (напр., ретинол-зв язуючий білок, тироксин-зв язуючий білок, церулоплазмін, трансферин, тощо) Альфа-1-глобуліни здійснюють транспорт ліпідів, тироксину, кортикостероїдів (приклади - ретинол-зв язуючий білок, тироксин-зв язуючий білок), деякі з них є інгібіторами протеолітичних ферментів (альфа-1-антитрипсин) Альфа-2-глобуліни - відповідають за транспорт ліпідів, іонів міді (приклад - церулоплазмін), деякі з них також є інгібіторами протеолітичних ферментів (альфа-2-макроглобулін). Гаптоглобін і гемопексин запобігають втраті гемового заліза із сечею Бета-глобуліни - беруть участь у транспорті ліпідів, вільного та гемового заліза (основна їх частина - це бета-ліпопротеїди, а також трансферин) Гама-глобуліни (це імуноглобуліни (=антитіла) G, A, D, E, M) виконують захисні функції. До цієї ж групи належать і патологічні білки, які синтезуються при мієломній хворобі специфічними клітинами антитілоутворюючої системи і з являються у плазмі хворих (напр., білок Бенс-Джонса) Діагностичне значення має коефіцієнт альбуміно/глобулінового співвідношення (А/Г, або “білковий коефіцієнт”), який у нормі дорівнює 1,2-2. Зниження його - за хронічних дифузних ушкодженнях печінки, інфекційних хворобах, запальних хворобах плеври, легенів, злоякісних новоутвореннях.
Плазма крові. Найважливіші для клініки білки плазми крові. Білки гострої фази. Білки гострої фази - це різнорідна група білків. При порушенні гомеостазу, яке супроводжується запальною реакцією (що характерне для гострого періоду захворювання), відбувається швидка і значна зміна їх концентрацій. Поява цих білків, зокрема,є першою ознакою бактеріальної, фірусної, паразитарної інфекції, фізичної чи хімічної травми, токсичної чи аутоімунної реакції, ішемічного некрозу, злоякісних пухлин
Найважливіші з білків гострої фази Гаптоглобін - представник альфа-2-глобулінів; має здатність до сполучення з Hb, який утворився при гемолізі еритроцитів. Отриманий комплекс може поглинатися системою макрофагів, що запобігає втраті заліза, яке входить до складу Hb. Зростання його вмісту є результатом стимуляції його синтезу одним із інтерлейкінів Церулоплазмін - ще один представник альфа-2-глобулінів. що містить мідь; здатний окислювати аскорбінову к-ту, адреналін, ДОФА. Має властивості Сu-вмісної оксидази, що окислює Fe2+ до Fe3+ , що сприяє вбудовуванню заліза у трансферин а надалі - і у феритин. депо заліза. Зниження його вмісту, зокрема, виявляють за хвороби Вільсона-Коновалова - при цьому іони міді виходять із судинного русла і накопичуються протеогліканами сполучної тканини. Трансферин (=силерофілін) - бета-глобулін, здатний зв язувати Fe3+ у плазмі крові; це транспортна форма заліза, яка акцептує іони Fe3+ , що надходять у кров після всмоктування заліза у кишечнику, та передає залізо на тканинний феритин (в складі феритину біля 4500 іонів Fe3+ ), в складі якого залізо депонується у печінці, селезінці, кістковому мозку альфа-1-протеїназний інгібітор (= альфа-1-антитрипсин) - утворює з протеїназами (трипсином, хімотрипсином, плазміном, тромбіном, протеазами лейкоцитів чи чужорідних клітин, протеїназ підшлункової залози за гострого панкреатиту) комплекси, пригнічуючи при цьому протеолітичну їх активність. При запальному процесі зростає синтез альфа-1-антитрипсину в гепатоцитах. Вроджена недостатність веде до розвитку у молодому віці емфіземи легенів через розщеплення тканинним трипсином міжальвеолярних перетинок
Найважливіші з білків гострої фази (продовження) альфа-1-антихімотрипсин - функція і механізм дії подібні до альфа-1-антитрипсину альфа-2- макроглобулін - універсальний сироватковий інгібітор протеїназ: діє на серинові, тіолові, карбокси- та металопротеїнази. Механізм дії - подібний до альфа-1-антитрипсину. Його біологічна роль - регуляція системи тканинного протеолізу, що важливе у таких процесах, як зсідання крові, фібриноліз, імунні процеси, реакції запалення, функціонування системи комплементу, регуляція судинного тонусу С-реактивний білок (СРБ) - відсутній у сироватці здорової людини; з являється при запальних процесах, при некрозах - у періоди загострень хронічних хвороб або при гострому захворюванні (це власне білок гострої фази). Його назва зумовлена здатністю реагувати з С-полісахаридом пневмокока, утворюючи при цьому преципітати; СРБ стає активатором інших проявів запалення, зокрема, системи комплементу. Визначення СРБ важливе у діагностиці гострої фази ревматизму, за інфаркта міокарду, при пневмококових, стрептококових, стафілококових інфекціях Кріоглобулін - також відсутній у крові здорової людини; з являється при мієломі, нефрозі, цирозі печінки. ревматизмі, лімфосаркомі, лейкозах. За температури нижче 37 С випадає у осад. Орозомукоїд - належить до альфа-1-глобулінів. Синтез цього білка гострої фази стимулюється гліколіпідами, які звільнюються із макрофагів, активованих інтерлейкіном-6. має імуномодулюючу дію на різні етапи імунної відповіді. Його вмст зростає за всіх запальних і некробіотичних процесах Інтерферон - синтезується у клітинах під впливом вірусів; здатний пригнічувати їх розмноження у клітинах, не впливаючи на вже існуючі вірусні частки.
Найважливіші для клініки ферменти плазми крові Власні ферменти плазми крові - протеази, фосфатази, естерази, у т.ч. компоненти про- і антикоагуляційних систем, ферменти, що беруть участь у імунних процесах Ферменти, що потрапляють у кров в результаті всмоктування соку підшлункової залози, слини (трипсин, амілаза, ліпаза) 3 групи найважливіших для клініки ферментів крові - секреторні, екскреторні та індикаторні - розглядалися при вивченні біохімії печінки Важливим для діагностики є дослідження ізоферментів. Напр.: - ЛДГ4, ЛДГ5 - печінка; ЛДГ1 і ЛДГ2 - серцевий м яз; ЛДГ3 - селезінка, нирки - Креатинкіназа - ВВ - мозок; ММ - скелетні м язи; МВ та ММ - серцевий м яз Органоспецифічні ферменти - напр., для печінки це гістидаза. сорбітолдегідрогеназа, аргіназа, орнітинкарбамоїлтрансфераза
Небілкові органічні сполуки плазми. Залишковий азот Після осадження білків плазми чи сироватки крові в надосадовій рідині визначають т. зв. залишковий азот (або рест-азот, RN) - це азот органічних і неорганічних небілкових сполук Залишковий азот складається із азоту: - сечовини (50%) - амінокислот (25%) - сечової к-ти (4%) - креатину (5%) - креатиніну (2,5%) - солей амонію та індикану (0,5%) та менших кількостей: - вільних нуклеотидів - нуклеозидів - білірубіну - холіну - олігопептидів та ін
Небілкові органічні сполуки плазми. Залишковий азот (продовження) Норма - 20-40 мг%, або 0,2-0,4 г/л, або 7,06 - 14,1 ммоль/л у сироватці крові У здорової людини коливання незначні, залежать від кількості харчового білка, показник може зростати за вагітності на пізніх термінах Азотемія - підвищення показника - зумовлена порушенням між утворенням і виведенням продуктів азотового обміну з організму. Причинами можуть бути: - затримка виведення азотовмсних сполук через порушення видільної здатності нирок (гломерулонефрити, гостра чи хронічна ниркова недостатність), тяжкої недостатності кровообігу - надлишкове надходження азотовмісних сполук у кров через посилений розпад білків при пораненнях, опіках, кахексії, поширених запаленнях тощо Зниження показника - за тяжкої печінкової недостатності та некрозі печінки Для діференційної діагностики захворювань нирок від глибоких дистрофічних ушкоджень печінки використовують коефіцієнт Х: Х = (азот сечовини / залишковий азот) х 100, % Норма - 46 - 60%; при хронічних нефритах - до 90%; при тяжких формах гепатитів він навпаки зменшується Визначення залишкового азоту застосовують, зокрема, для діагностики захворювань нирок у педіатрії
Небілкові органічні сполуки плазми. Вуглеводи Це переважно моносахариди, головним чином глюкоза (натще 65-119 мг%, або 3,58-6,05 ммоль/л) та фруктоза, галактоза і деякі пентози (рибоза, дезоксирибоза, а також глікозаміноглікани (0,65+/- 0,05 мг%), сіалові к-ти (58-65 мг%), фукоза (6-дезоксигалактоза) (6,7-9,8 мг%) Основні продукти гліколізу, що містяться у плазмі крові: - молочна к-та (8-17 мг%) - піровіноградна к-та (0,4-2,5 мг%) - ацетооцтова к-та - метаболіти трикарбонового циклу
Небілкові органічні сполуки плазми. Ліпіди Загальний вміст ліпідів у плазмі крові коливається залежно від режиму і якості харчування, віку, статі - в сер. 5 - 7 г/л. Серед них: - тригліцериди - 0,5-1,9 г/л - фосфоліпіди - 1,1-2,75 г/л - холестерол загальний - 1,5-2,6 г/л - холестерол етерифікований - 1,0-2,1 г/л - жирні к-ти (неетерифіковані) - 0,08-0,2 г/л Аліментарна гіперліпемія - фізіологічне зростання цього показника після вживання їжі, багатої на жири У крові гідрофобні ліпіди містяться у вигляді ліпопротеїнів - у зв язку із спеціальними білками - аполіпопротеїнами, які сприяють утворенню ліпопротеїнових міцел. Існує 5 класів аполіпопротеїнів - А, В, С, D, Е - які у певних співвідношеннях входять до складу ліпопротеїнів різних класів
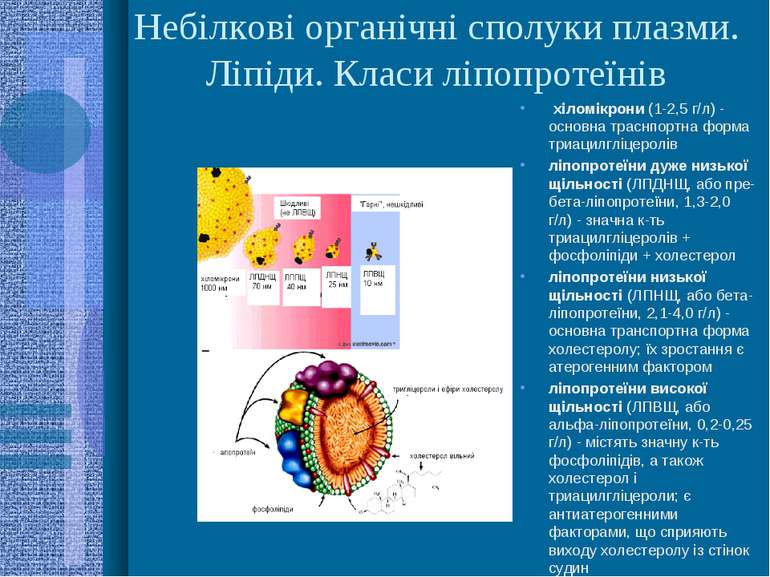
Небілкові органічні сполуки плазми. Ліпіди. Класи ліпопротеїнів хіломікрони (1-2,5 г/л) - основна траснпортна форма триацилгліцеролів ліпопротеїни дуже низької щільності (ЛПДНЩ, або пре-бета-ліпопротеїни, 1,3-2,0 г/л) - значна к-ть триацилгліцеролів + фосфоліпіди + холестерол ліпопротеїни низької щільності (ЛПНЩ, або бета-ліпопротеїни, 2,1-4,0 г/л) - основна транспортна форма холестеролу; їх зростання є атерогенним фактором ліпопротеїни високої щільності (ЛПВЩ, або альфа-ліпопротеїни, 0,2-0,25 г/л) - містять значну к-ть фосфоліпідів, а також холестерол і триацилгліцероли; є антиатерогенними факторами, що сприяють виходу холестеролу із стінок судин
Небілкові органічні сполуки плазми. Пігменти крові Сполуки, що утворюються при розпаді чи при синтезі гема гемопротеїнів (гемоглобіну, міоглобіну, цитохромів, тощо) Продукти розпаду гему - жовчні пігменти: білірубін, уробіліноген, уробілін, стеркобіліноген, стеркобілін. У крові визначають загальний б/р (0,3-1,2 мг%, або 5,13-20,5 мкмоль/л), некон югований, або непрямий б/р (0,2-1 мг%, або 3,4-17,1 мкмоль/л, або 75% загального), та кон югований, або прямий (0,05-0,25 мг%, або 0,86-4,3 мкмоль/л) Порфірини - це проміжні продукти біосинтезу гему: уропорфірини, копропорфірини, протопорфірин ІХ. Порфірії - це патологічні стани, пов язані зі спадковою чи набутою недостатністю ферментів, що беруть участь у біосинтезі гему. У здорової людини у нормі у крові виявляють лише копропорфірин - до 0,01 г/л
Основні неорганічні компоненти плазми Кальцій - 2,5 ммоль/л Натрій - 140 ммоль/л Калій - 5 ммоль/л Фосфор неорганічний - 0,97 - 1,61 ммоль/л Магній - 1 ммоль/л Сироваткове залізо - 14,32 - 21,48 мкмоль/л Мідь - 11 - 22 мкмоль/л Хлориди - 95 - 110 ммоль/л А також аніони бікарбонатів, сульфатів, іодидів
Схожі презентації
Категорії