Презентація на тему:
альтер.бх.мо.
Завантажити презентацію
альтер.бх.мо.
Завантажити презентаціюПрезентація по слайдам:
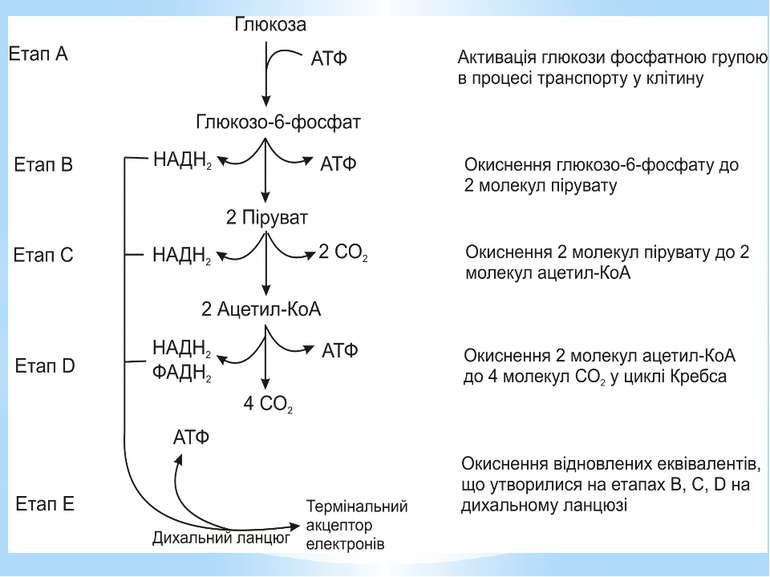
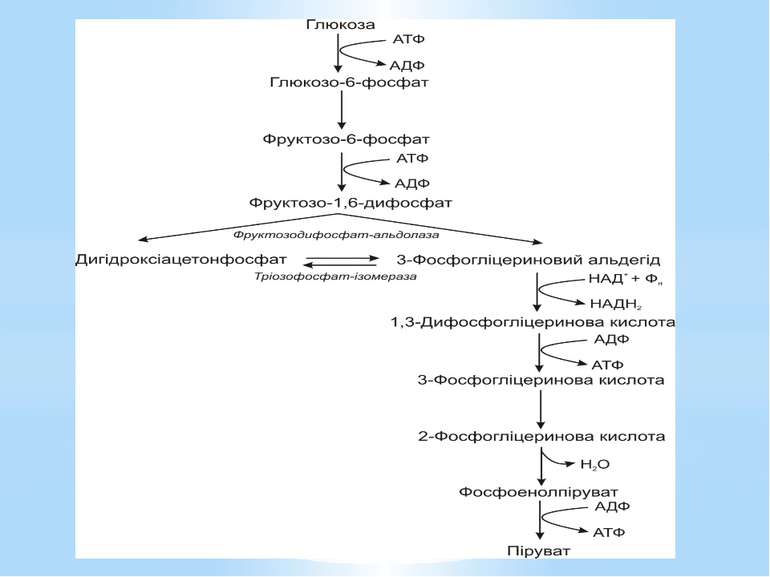
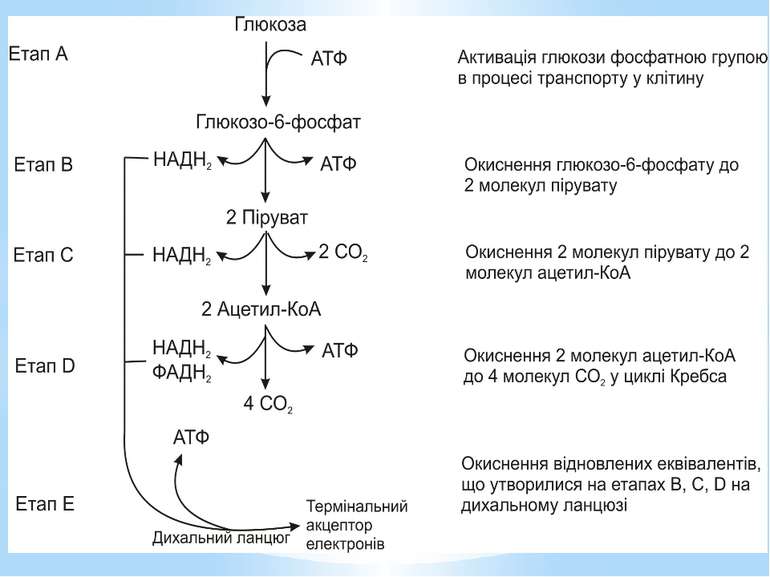
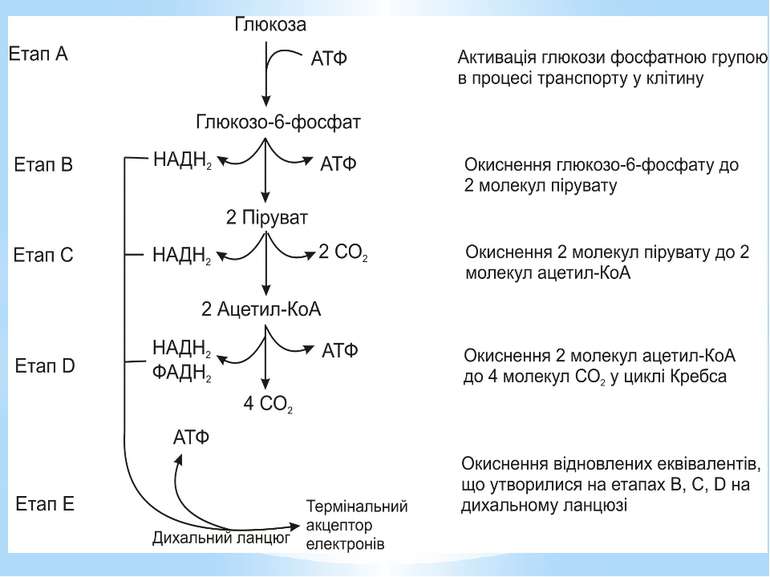
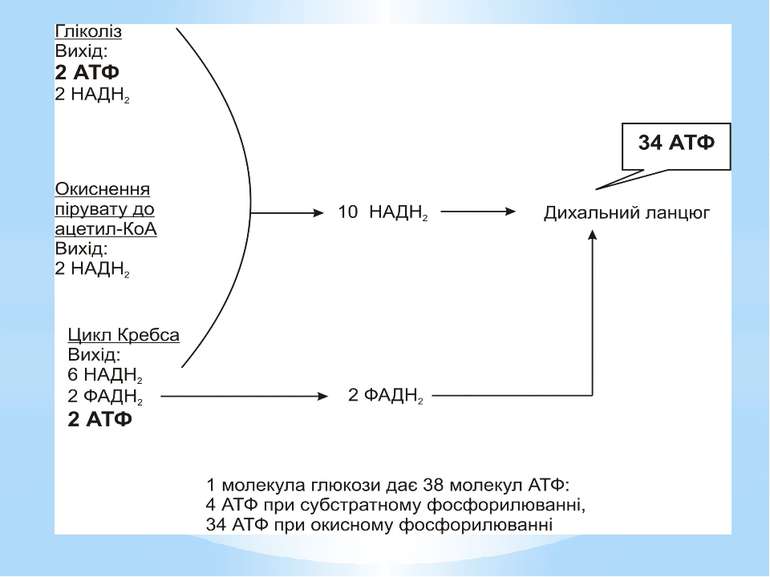
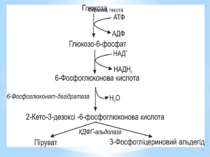
Гліколіз Внаслідок гліколізу з однієї молекули глюкози утворюються 4АТФ та 2НАДН2. Оскільки 2АТФ витратилося на першому етапі, загальний енергетичний вихід становить 2АТФ та 2НАДН2 на одну молекулу глюкози.
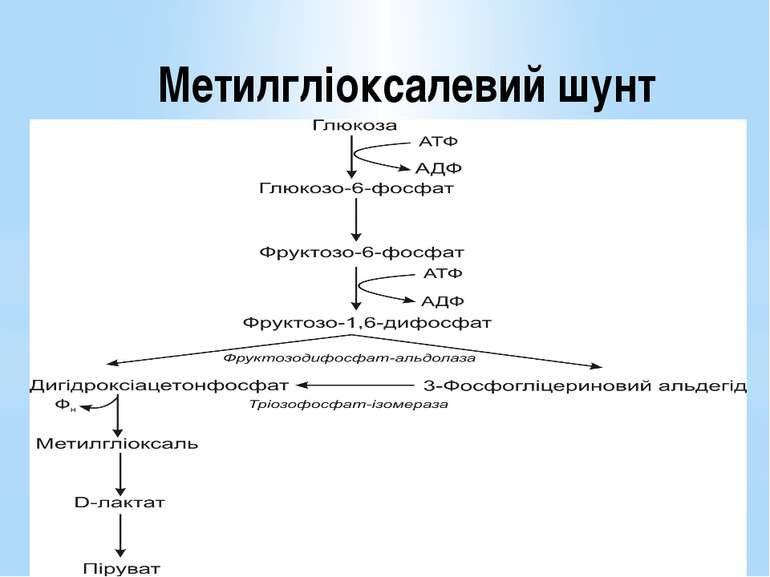
За обмеженої кількості неорганічних фосфатів у середовищі гліцеральдегід-3-фосфат-дегідрогеназа є недостатньо активною. Фосфорилування 3-фосфогліцеринового альдегіду не відбувається. Перетворення субстрату здійснюється обхідним шляхом через дигідроксіацетонфосфат і проміжний метаболіт метилгліоксаль. Цей метаболічний шлях називають метилгліоксалевим шунтом.
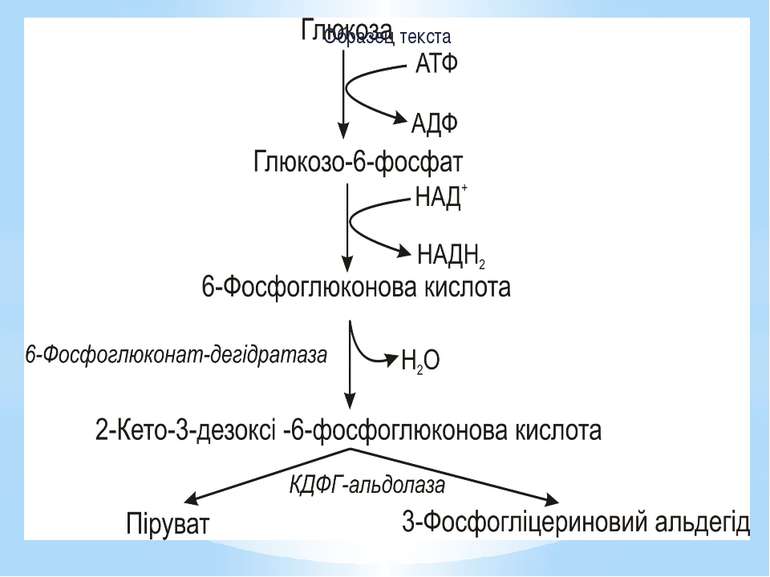
Шлях Ентнера-Дудорова Піруват утворюється з глюкози лише за 4 реакції (у гліколізі – за 9). В результаті такого розщеплення 1АТФ витрачається і утворюється 1НАДН2. Основний ключовий метаболіт – 2-кето-3-дезоксі-6-фосфоглюконова кислота (КДФГ), а специфічні ферменти: 6-фосфоглюконатдегідратаза КДФГ-альдолаза. Шлях Ентнера-Дудорова має кілька точок перетину з пентозофосфатним і гліколітичним шляхами, тому за потреби може на них переключатися.
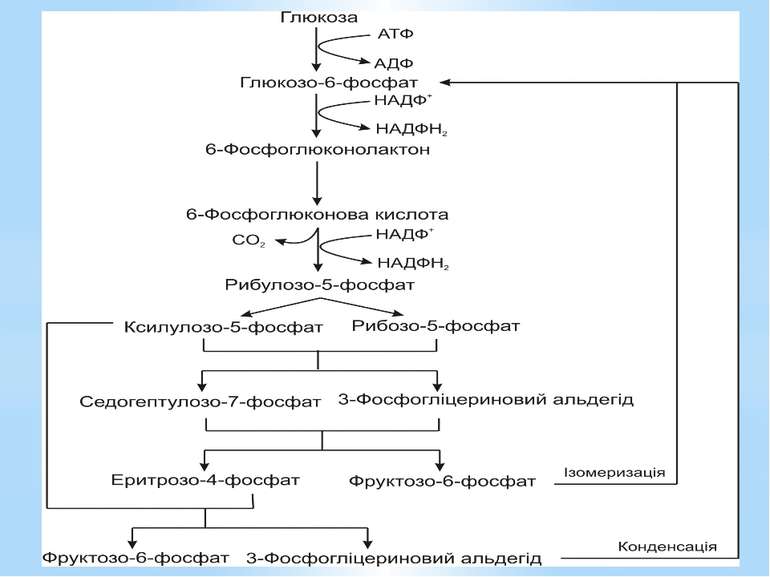
Пентозофосфатний шлях При розщепленні глюкози пентозофосфатним шляхом: витрачається 1АТФ, відновлюються 2НАДФН2, відщеплюється 1СО2, синтезуються сполуки з різними довжинами вуглецевого скелета: С3,С4,С5,С7, необхідні для подальшого біосинтезу.
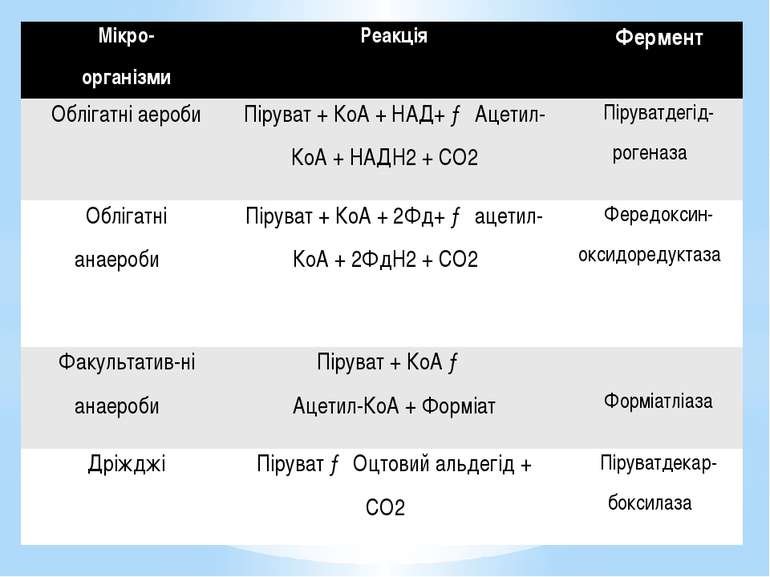
Мікро- організми Реакція Фермент Облігатніаероби Піруват+КоА+НАД+→Ацетил-КоА+ НАДН2+СО2 Піруватдегід-рогеназа Облігатніанаероби Піруват+КоА+ 2Фд+→ацетил-КоА+ 2ФдН2+СО2 Фередоксин-оксидоредуктаза Факультатив-ніанаероби Піруват+КоА→ Ацетил-КоА+Форміат Форміатліаза Дріжджі Піруват→ Оцтовий альдегід +СО2 Піруватдекар-боксилаза
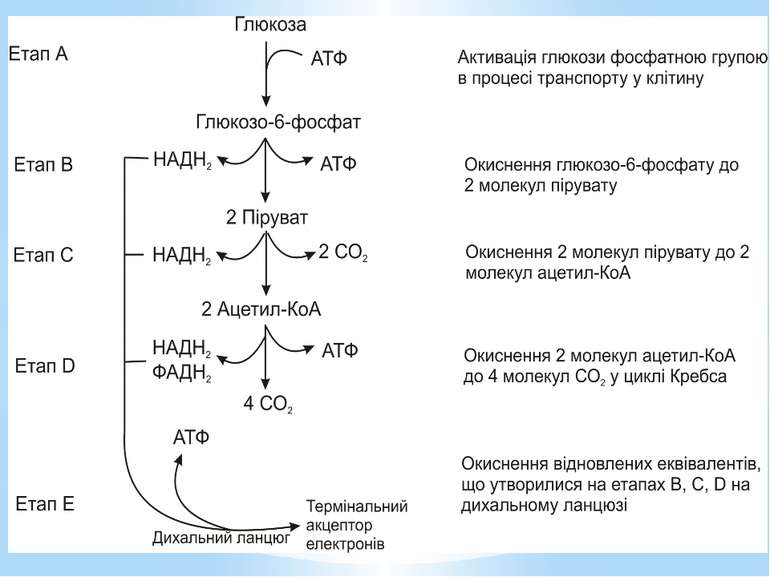
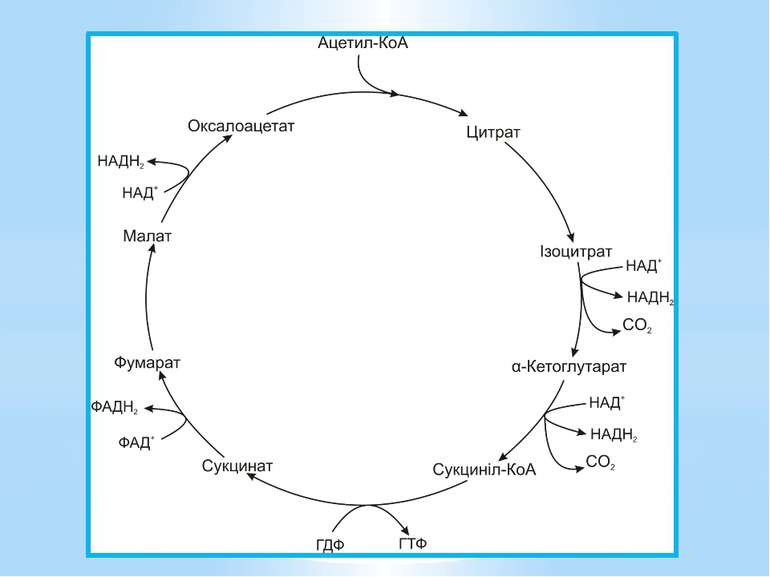
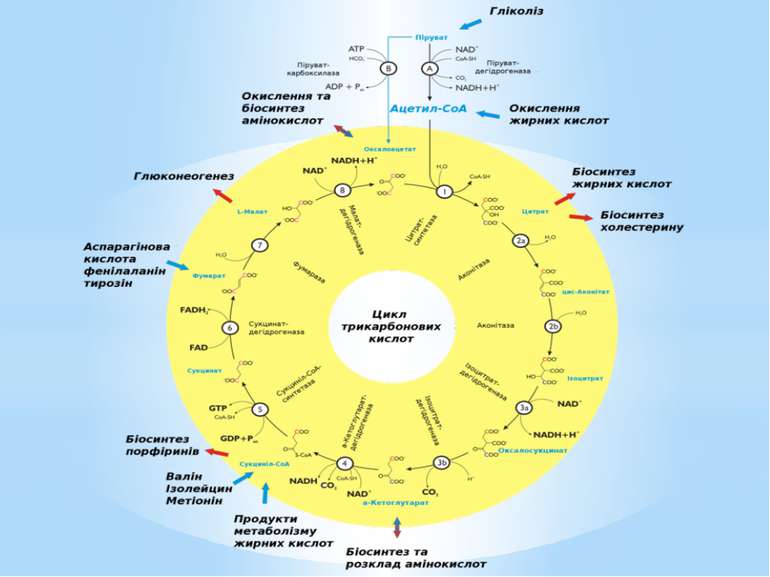
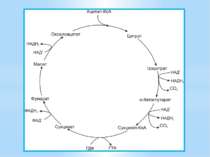
Окиснення ацетильної групи ацетил-КоА до СО2 у циклі Кребса. Основне призначення циклу Кребса – окиснення ацетату (ацетил-КоА) до 2СО2. Паралельно з цим з 1 молекули ацетил-КоА утворюється ГТФ, 3НАДН2 і ФАДН2. Цей цикл також має велике значення для анаболізму, бо α-кетоглутарова і щавлево-оцтова кислоти використовуються клітиною для біосинтезу амінокислот.
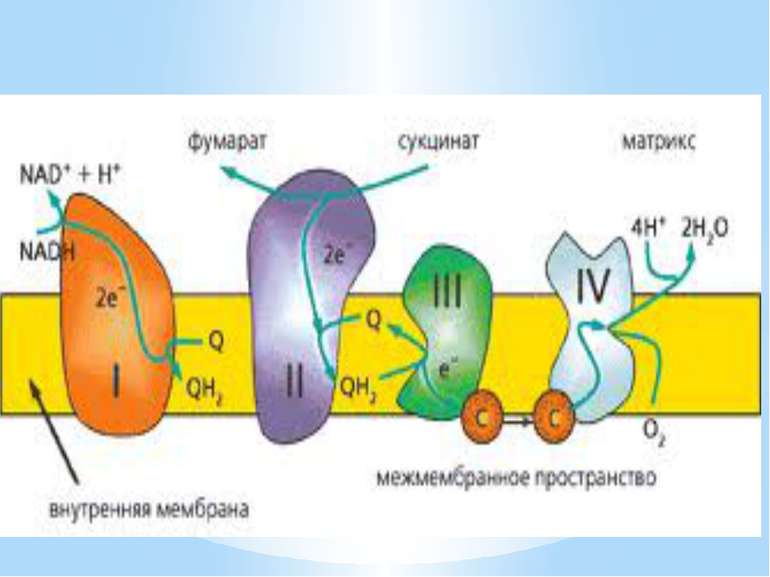
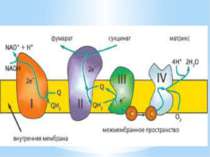
Дихальний ланцюг – це сукупність великої кількості переносників і ферментів, які фізично зв’язані з матрексом мембран і заглиблені в їх ліпідний шар. У еукаріотів дихальний ланцюг в основному локалізований на внутрішній мембрані мітохондрій, а у прокаріотів – на цитоплазматичній мембрані (ЦПМ) та її утворах (мезосомах), спрямованих усередину клітини
Чергування переносників атомів водню й електронів призводить до транслокації протонів крізь мембрану. В результаті на мембранах виникає градієнт електрохімічного потенціалу іонів водню Протони повертаються назад у клітину крізь мембрану лише в місцях локалізації АТФ-синтетази (АТФ - ази). Завдяки цьому відбувається реакція фосфорилування АДФ в АТФ: АДФ + Фн + Н+ = АТФ + Н2О
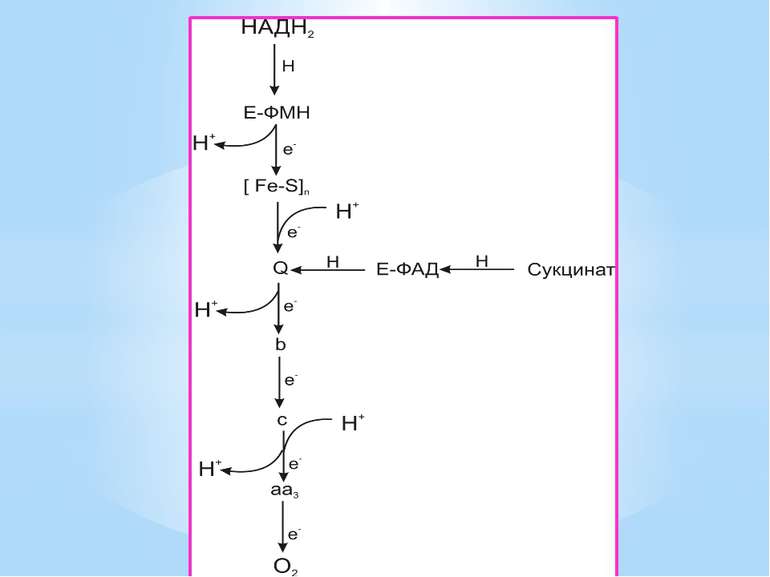
Місця винесення протонів крізь мембрану називають пунктами фосфорилування. У мітохондріальному дихальному ланцюзі таких пунктів три: між Е-ФМН та залізо-сірчаними білками; між хіноном і цитохромами; на цитохромі aa3. На кожні 2 електрони, що переносяться на кисень з НАДН2, можуть фосфорилуватися 3 молекули АТФ, а з ФАДН2 – 2 молекули АТФ. Дихальні ланцюги прокаріотів на відміну від еукаріотів надзвичайно різноманітні. Склад переносників й кількість пунктів фосфорилування, а отже, й вихід АТФ, залежать від багатьох чинників: ОВП донора й акцептора електронів. Типу метаболізму мікроорганізмів, Умов довкілля.
Неповне окиснення органічних сполук Аеробні хемоорганотрофи прості органічні субстрати зазвичай окиснюють до СО2 й Н2О і частково використовують для біосинтезу. Але за певних умов вони можуть окиснювати субстрат неповністю і накопичувати у середовищі органічні кислоти і спирти. Це явище отримало назву «аеробне бродіння», однак його механізм і причини принципово різняться від класичного анаеробного бродіння.
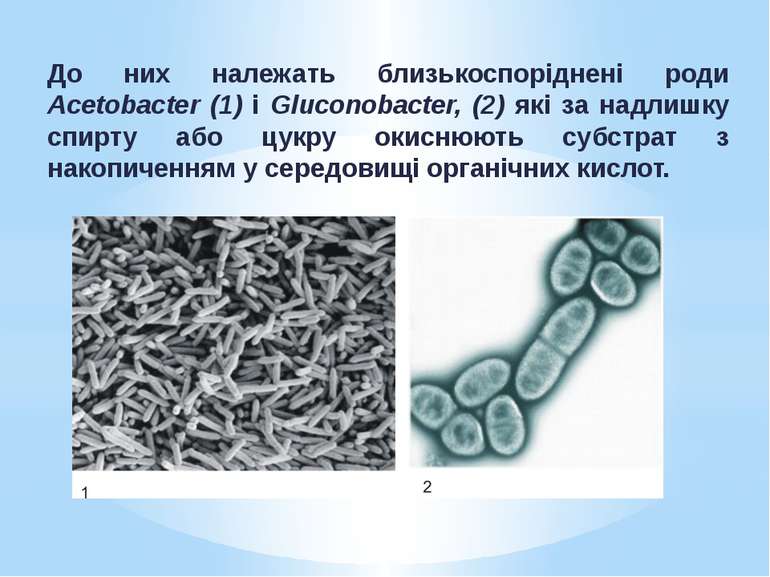
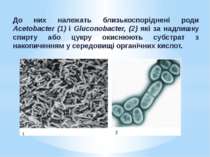
Неповне окиснення має практичне значення і використовується в біотехнологіях для отримання цінних речовин. Неповне окиснення органічних речовин мікроорганізмами може зумовлюватися: Особливостями метаболізму (наприклад, Acetobacter, Gluconobacter ); Аномальними фізіологічними умовами (нестача у середовищі макро- й мікроелементів або надлишок вуглеводів). Типовими бактеріями, що здійснюють неповне окиснення внаслідок особливостей метаболізму, є оцтовокислі бактерії - група грамнегативних хемоорганогетеротрофних аеробів.
До них належать близькоспоріднені роди Acetobacter (1) і Gluconobacter, (2) які за надлишку спирту або цукру окиснюють субстрат з накопиченням у середовищі органічних кислот.
Бактерії роду Acetobacter мають повний цикл Кребса. Однак спочатку вони окиснюють весь етанол до ацетату, який накопичується у середовищі. Після повного використання етанолу бактерії починають окиснювати ацетат до СО2 і води.
У лабораторних і промислових умовах внаслідок порушення регуляції метаболізму гриби родів Rhizopus, Mucor, Circinella, Aspergillus можуть виділяти у середовище молочну, глюконову, щавлеву, цитринову, ітаконову, фумарову, яблучну, бурштинову, мурашину кислоти за нестачі заліза, мангану, міді, магнію, калію або кальцію.
Більшість представників Bacillus у разі росту за високих концентрацій вуглеводів накопичують у середовищі ацетат, піруват, ацетоїн, бутандіол, які потім використовуються клітинами на стадії спороутворення.
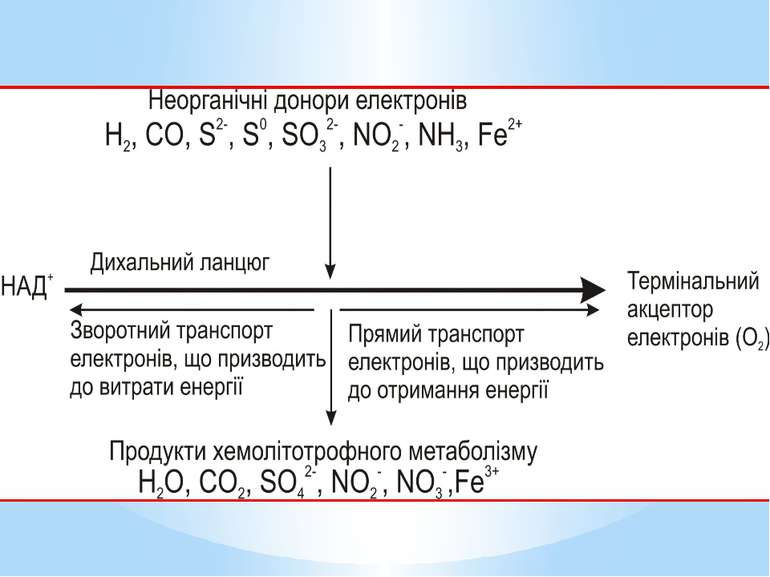
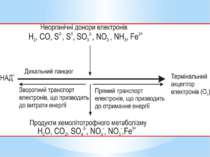
Літотрофні мікроорганізми як джерело (донор) електронів використовують неорганічні сполуки у відновленому стані. Залежно від донора електронів серед аеробних хемолітотрофів розрізняють: водневі бактерії ( окиснюють молекулярний водень); нітрифікувальні бактерії (окиснюють амоній і нітрит); безбарвні сіркобактерії (окиснюють сульфід і сірку); тіонові бактерії (окиснюють сульфід); карбоксидобактерії (окиснюють монооксид вуглецю); залізобактерії (окиснюють залізо-ІІ)
Метаболізм аеробних хемолітотрофів характеризується чотирма особливостями: АТФ утворюється в процесі окисного фосфорилування, тобто на дихальному ланцюзі; реакції субстратного фосфорилування відсутні (виняток - тіонові бактерії); електрони надходять на дихальний ланцюг на рівні цитохромів (виняток -водневі бактерії); транспорт електронів дихальним ланцюгом відбувається в прямому і зворотному напрямках.
Реакція ОВП, мВ Н2→ 2Н++ 2е- - 410 НАДН+ Н+→НАД++ 2е-+2Н+(реакція окиснення НАДН2на дихальному ланцюзі захемоорганотрофногометаболізму) - 320 Н2S→S0+2Н++ 2е- - 250 S0+ 3Н2O→SO32-+6Н++ 4е- + 5 SO32-+Н2O→SO42-+2Н++ 2е- - 280 NH4++ 2Н2O→NO2-+8Н++ 6е- + 440 NO2-+Н2O→NO3-+2Н++ 2е- + 350 O2+4Н++ 4е-→2Н2O(реакція відновлення кисню на дихальному ланцюзі за аеробного дихання) + 810
Електрони при окисненні неорганічних сполук безпосередньо надходять на дихальний ланцюг. Місце їх надходження визначається ОВП реакції окиснення донора. Відірвавшись від донора, електрон потрапляє на той переносник дихального ланцюга, значення ОВП якого вище за ОВП реакції окиснення донора. Отже, в усіх хемолітотрофів, крім водневих бактерій, електрони потрапляють на дихальний ланцюг не на початок (рівень флавопротеїнів), а на середину (рівень хінонів і цитохромів)
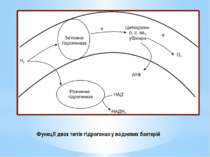
У хемолітотрофів електрон може рухатися дихальним ланцюгом у двох напрямках: прямому зворотному. За прямого транспорту електрон рухається до термінального акцептора від переносників з нижчими значеннями ОВП до вищих. Таке перенесення супроводжується утворенням градієнта протонів і відповідно синтезом АТФ. Оскільки шлях електронів у прямому напрямку в хемолітотрофів значно коротший, ніж у хемоорганотрофів, кількість пунктів фосфорилування в них менша (як правило, один), а отже, і вихід АТФ значно нижчий.
У разі зворотного транспорту електрони від місця входження на дихальний ланцюг рухаються у напрямку флавопротеїнів (ФМН) і врешті відновлюють НАД+. Призначення зворотного перенесення електронів - утворення відновлених еквівалентів, які необхідні клітині для біосинтезу і не можуть утворитися іншим шляхом за хемолітотрофного метаболізму. На відміну від хемоорганотрофів, у яких НАДН2 синтезується без затрат АТФ, у хемолітотрофів цей процес енергозатратний.
Більшість хемолітотрофних бактерій є автотрофами, що потребує істотних енергетичних витрат (12 молекул відновлених еквівалентів і 18 молекул АТФ на 1 молекулу глюкози) Отже, на відміну від хемоорганогетеротрофів хемолітотрофи отримують АТФ лише за рахунок окисного фосфорилування за прямого транспорту електронів короткою термінальною частиною дихального ланцюга додатково витрачають АТФ на автотрофний біосинтез; на відновлення НАД+ за зворотного перенесення електронів.
Енергетичні проблеми хемолітотрофів вирішуються наступним чином: Оскільки вони мають дуже розгалужену термінальну частину дихального ланцюга і високу концентрацію цитохромів, це дає їм змогу передавати на термінальний акцептор велику кількість електронів. У зв’язку з цим вони мають розвинену систему внутрішніх цитоплазматичних мембран. Хемолітотрофи досить швидко окиснюють неорганічні донори електронів. Вони переробляють велику кількість неорганічних сполук і виділяють у середовище багато кінцевих метаболітів, що надзвичайно важливо для колообігу речовин у природі.
Водневі (воденьокиснювальні) бактерії - це аеробні хемолітоавтотрофні прокаріоти, здатні отримувати енергію й електрони окисненням молекулярного водню, а всі речовини клітини будувати з вуглецю СО2. Молекулярний водень вони використовують і в анаболізмі для отримання відновлених еквівалентів.
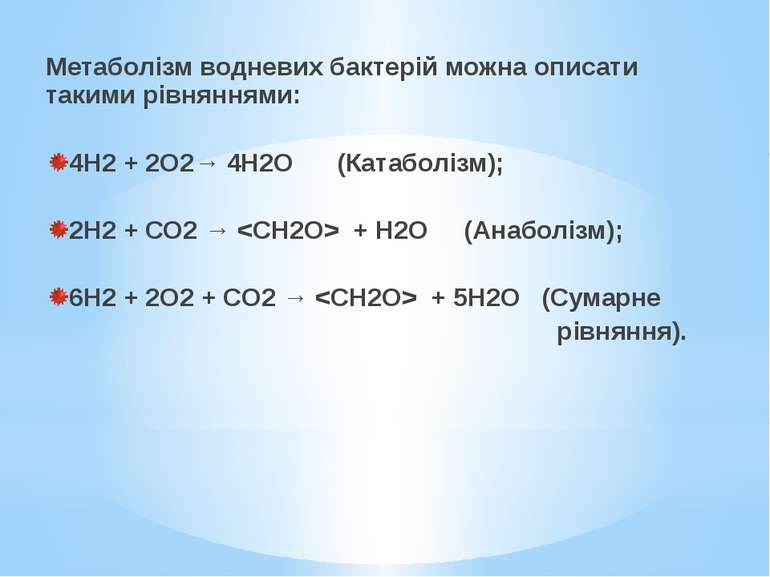
Метаболізм водневих бактерій можна описати такими рівняннями: 4Н2 + 2О2→ 4Н2О (Катаболізм); 2Н2 + СО2 → + Н2О (Анаболізм); 6Н2 + 2О2 + СО2 → + 5Н2О (Сумарне рівняння).
Водневі бактерії не є таксономічною групою. До водневих бактерій належать представники 20 родів, які мають різну морфологію, різне забарвлення за Грамом, рухливі і нерухливі, спорові і неспорові форми. За винятком термофільних бактерій роду Hydrogenobacter, що характеризуються облігатною хемолітоавтотрофією, всі інші водневі бактерії – факультативні форми. Вони можуть використовувати як джерело вуглецю й енергії також різноманітні органічні сполуки.
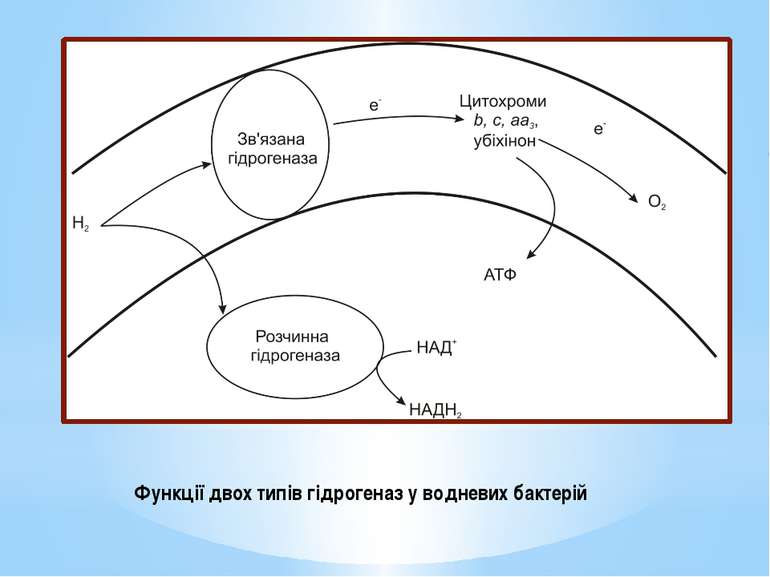
Їх здатність окиснювати молекулярний водень пов’язана з наявністю гідрогеназ, що каталізують реакцію: Н2 → 2Н+ + 2е- Водневі бактерії містять два типи гідрогеназ : розчинну зв’язану. Розчинна гідрогеназа міститься у цитоплазмі і каталізує відновлення НАД+. НАДН2 використовується у біосинтезі. Гідрогеназа, зв’язана із субклітинними часточками, безпосередньо передає електрони на дихальний ланцюг на рівень флавопротеїнів, хінонів або цитохрому b, тобто бере участь в енергетичному метаболізмі.
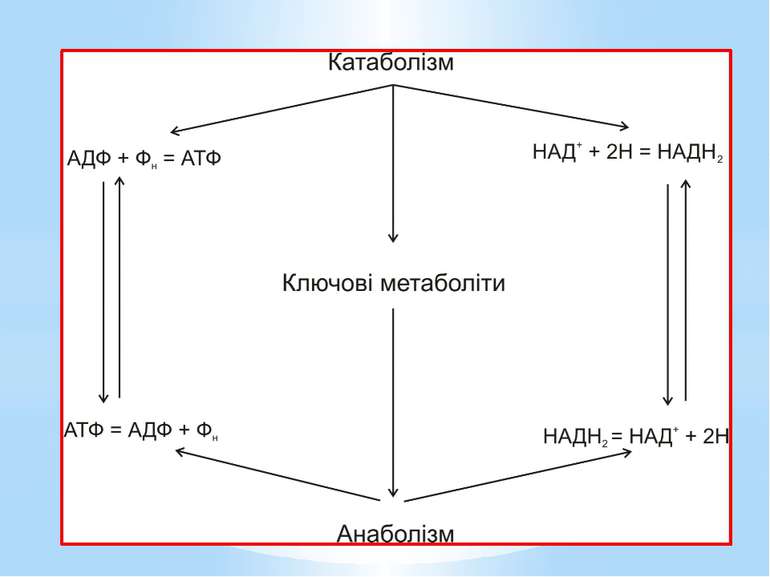
Анаболізм (грец. anabole – піднесення, сходження, накидання) – це сукупність енергозалежних біохімічних процесів синтезу простих молекул, полімерів і структурних компонентів клітини. Процеси анаболізму супроводжуються: окисненням відновлених еквівалентів; гідролізом АТФ. Основне призначення реакцій анаболізму – біосинтез.
Реакції анаболізму в клітині можна розділити на три рівні: cинтез мономерів та дрібних молекул; cинтез полімерів та макромолекул; cинтез структурних компонентів клітини.
Структурні компоненти клітини утворюються з 4 класів макромолекул: нуклеїнових кислот; білків; поліцукридів, складних ліпідів.
Для синтезу цих макромолекул клітині необхідно понад 100 дрібних молекул: рибонуклеотидів (4 типи), дезоксирибонуклеотидів (4 типи), амінокислот (близько 20), моноцукрів (близько 15), понад 20 речовин для синтезу складних ліпідів, 20 коферментів і переносників тощо. Вони формуються з попередників біосинтезу, які називають ключовими метаболітами, проміжними метаболітами, або центраболітами.
Ключовими метаболітами є: глюкозо-1-фосфат, глюкозо-6-фосфат, рибозо-5-фосфат, еритрозо-4-фосфат, фосфоенолпіруват, піруват, 3-фосфогліцеринова кислота, α-кетоглутарова кислота, сукциніл-КоА, щавлево-оцтова кислота, діоксіацетонфосфат, ацетил-КоА.
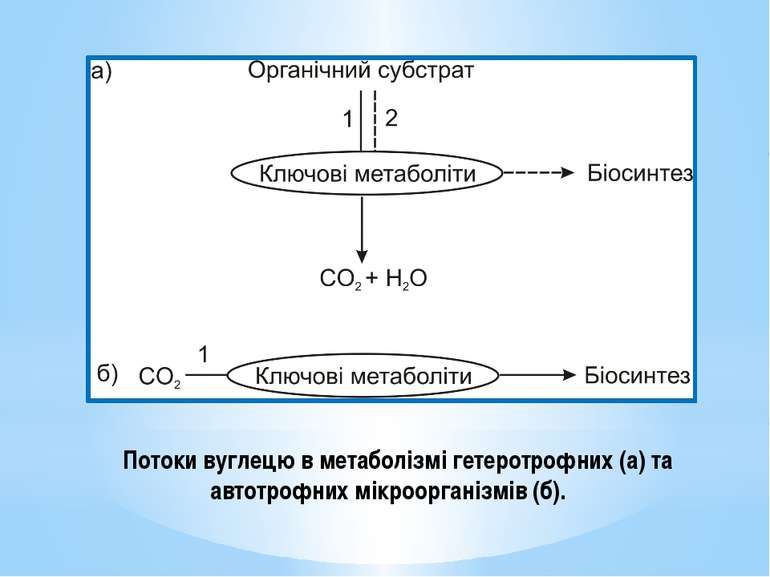
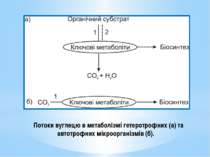
У гетеротрофів ключові метаболіти вилучаються з амфіболічних шляхів. У гетеротрофів існує 2 потоки вуглецю: Катаболічний - спрямований на розщеплення органічного субстрату через ключові продукти до СО2 та Н2О, Анаболічний – від ключових продуктів на біосинтез В автотрофів ключові метаболіти синтезуються з неорганічного вуглецю. В автотрофів існує 1 потік вуглецю, спрямований на біосинтез: СО2 → ключові метаболіти → складні орг.сполуки
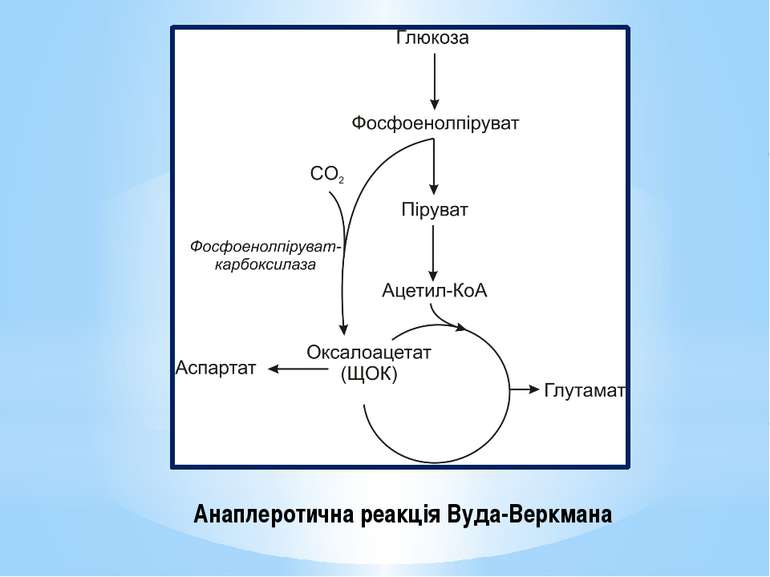
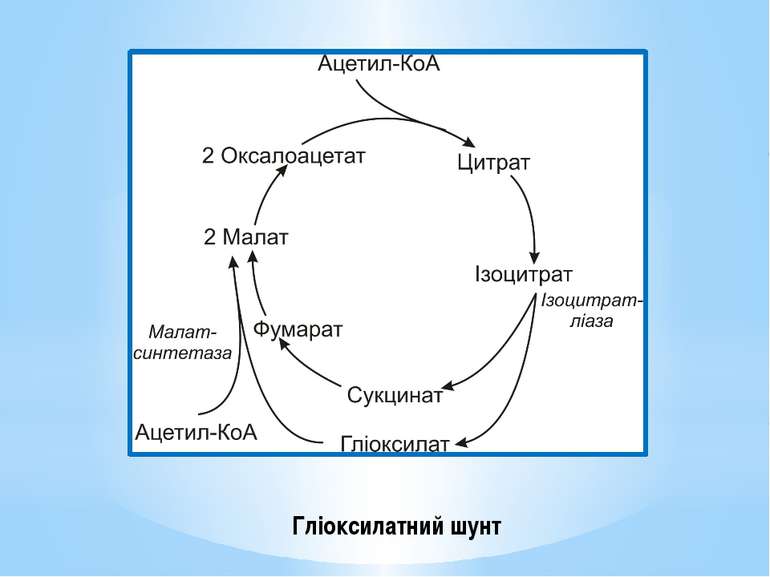
Поповнення пулу ключових метаболітів здійснюється спеціальними анаплеротичними реакціями (реакціями поповнення): утворення оксалоацетату з пірувату чи фосфоенолпірувату (реакція Вуда-Веркмана); поповнення пулу оксалоацетату за рахунок гліоксилатного шунта; перетворення аспарагінової кислоти на оксалоацетат ( див. реакції трансамінування амінокислот); перетворення глутамінової кислоти на α-кетоглутарову внаслідок дезамінування, тощо.
Найважливішою у природі анаплеротичною реакцією є реакція карбоксилування пірувату до оксалоацетату (ЩОК) за участю піруваткарбоксилази: Піруват + АТФ + СО2 → ЩОК + АДФ. Вона відбувається у мітохондріях клітин тварин, але не рослин. Ця реакція безпосередньо пов’язує гліколіз і ЦТК. Піруваткарбоксилаза активується ацетил-КоА, тому коли кількість ацетил-КоА перевищує запаси ЩОК, рівень ЩОК швидко зростає за участю піруваткарбоксилази. Реакція енергозатратна.
За реакцією Вуда-Веркмана фосфоенолпіруват (ФЕП) карбоксилується за участю фосфоенолпіруваткарбоксилази: ФЕП + СО2 → ЩОК. При цьому використовується багатий на енергію фосфоенолпіруват, але безпосередній гідроліз АТФ не відбувається. Реакція Вуда-Веркмана відбувається у клітинах дріжджів, бактерій та вищих рослин, але ніколи - у клітинах тварин.
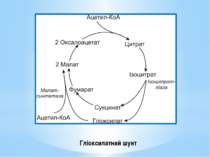
Гліоксилатний шунт – одна з модифікацій ЦТК, функцією якої є синтез додаткової молекули ЩОК. Від звичайного ЦТК він різниться наявністю двох ферментів: ізоцитратліази і малатсинтетази. Ізоцитратліаза каталізує реакцію розщеплення ізоцитрату до сукцинату й гліоксилату. Малатсинтетаза каталізує реакцію конденсації додаткової молекули ацетил-КоА та гліоксилату з утворенням малату. Отже, у гліоксилатний шунт включаються дві молекули ацетил-КоА і синтезується додаткова молекула ЩОК. Гліоксилатний шунт є у мікроорганізмів та рослин, але відсутній у тварин.
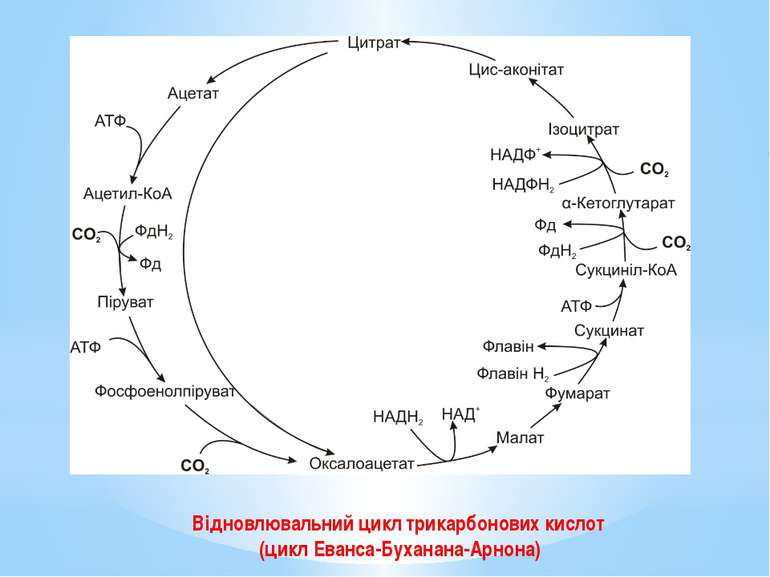
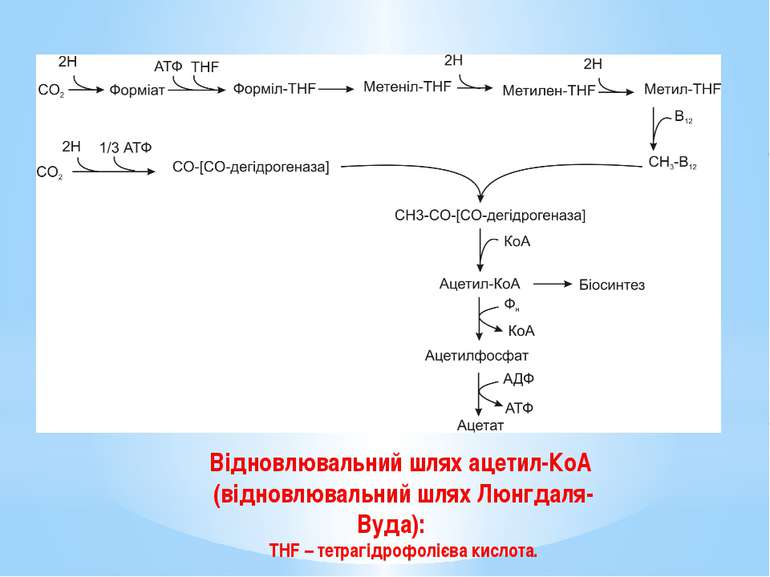
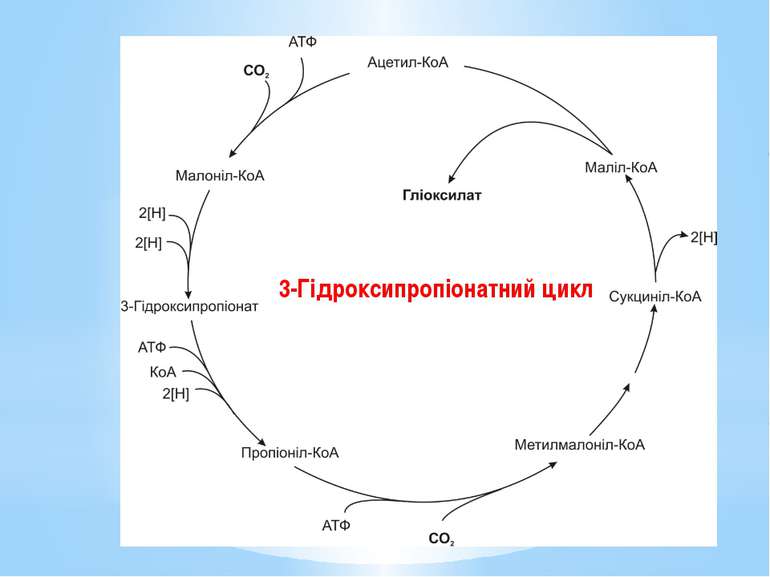
У мікроорганізмів відомо чотири шляхи фіксування вуглекислого газу: цикл Кальвіна (відновлювальний пентозофосфатний або рибулозо-біфосфатний шлях, RuBP); відновлювальний цикл трикарбонових кислот (цикл Еванса-Буханана-Арнона, rTCA); відновлювальний шлях ацетил-КоА (відновлювальний шлях Люнгдаля-Вуда, rACA); 3-гідроксипропіонатний цикл.
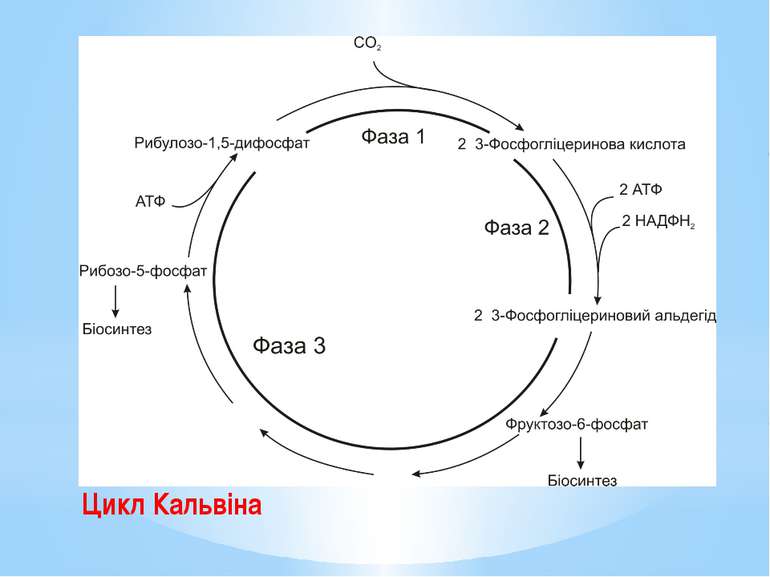
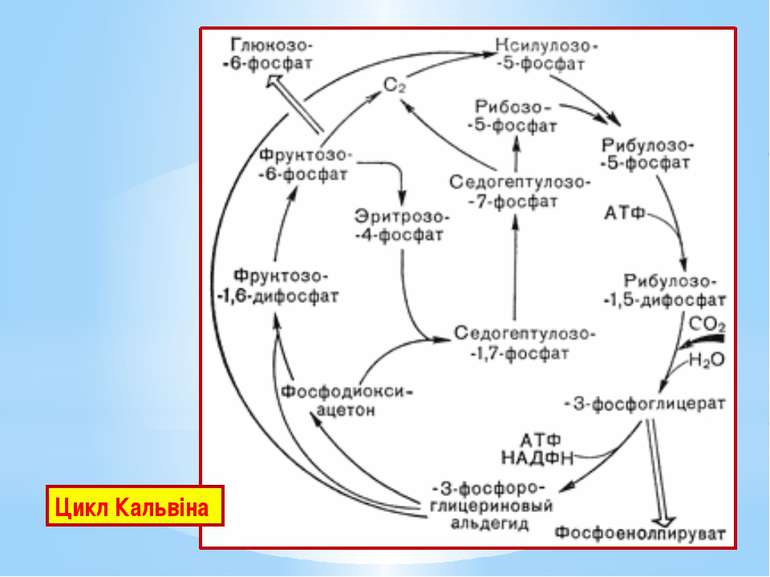
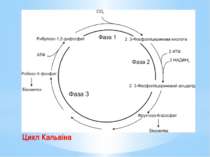
Цикл Кальвіна – найважливіший шлях біосинтезу на Землі, характерний для рослин, ціанобактерій, пурпурних та зелених бактерій. Цикл Кальвіна складається з трьох фаз: Фаза 1. Фіксування вуглекислого газу. СО2 зв’язується з рибулозо-1,5-дифосфатом (С5-сполукою). Реакцію каталізує рибулозо-1,5-біфосфаткарбоксилаза (RuBisCo) – найунікальніший ключовий фермент цього циклу В результаті утворюються дві молекули 3-фосфогліцеринової кислоти (дві С3-сполуки). Рибулозо-1,5-дифосфат + СО2 + Н2О → → 2 3-Фосфогліцеринова кислота.
Фаза 2. Відновлення карбоксильних груп фосфогліцеринової кислоти до альдегіду. 3-фосфогліцеринова кислота активується з утворенням 1,3-дифосфогліцеринової кислоти: 3-Фосфогліцеринова кислота + АТФ → → 1,3-Дифосфогліцеринова кислота + АДФ; 1,3-дифосфогліцеринової кислоти відновлюється до 3-фосфогліцеринового альдегіду. 1,3-Дифосфогліцеринова кислота + НАДФН2 → → 3-Фосфогліцериновий альдегід + НАДФ+ + Фн. На цій стадії витрачаються практично вся енергія та відновник, необхідні для фіксації СО2. Частково 3-фосфогліцериновий альдегід перетворюється на фруктозо-6-фосфат і йде на потреби біосинтезу.
Фаза 3. Регенерація акцептора вуглекислого газу. Решта реакцій циклу призводить до відтворення рибулозо-1,5-дифосфату. Розпочинаються вони синтезом фруктозо-6-фосфату з двох молекул тріозофосфатів. Потім перебудовується вуглецевий скелет з утворенням пентозо-5-фосфатів. Ці процеси нагадують обернені (відновлювальні) реакції пентозофосфатного шляху. Регенерація акцептора СО2 завершується фосфорилуванням рибозо-5-фосфату до рибулозо-1,5-дифосфату із затратою АТФ. Процес каталізується другим специфічним ключовим ферментом циклу Кальвіна – фосфорибулокіназою.
Енергетичний баланс циклу Кальвіна. Для утворення молекули фруктозо-6-фосфату, яка використана для біосинтезу, має карбоксилуватися 6 молекул рибулозо-1,5-дифосфату, тобто зафіксуватися 6СО2. 6 молекул рибулозо-1,5-дифосфату після карбоксилування перетворяться на 12 молекул 3-фосфогліцеринової кислоти, потім на 12 молекул 1,3-дифосфогліцеринової кислоти і відновляться згодом до 12 молекул 3-фосфогліцеринового альдегіду. На такі перетворення клітина витратить 12АТФ і 12НАДФН2. Наступні 6АТФ будуть використані під час регенерації акцептора СО2 на фосфорилування рибозо-5-фосфату до рибулозо-1,5-дифосфату.
Отже, синтез однієї молекули фруктози «коштує» клітині 18АТФ та 12НАДФН2. Загальне рівняння фіксування СО2 через цикл Кальвіна : 6СО2 + 12НАДФН2 + 18АТФ → С6Н12О6 + 12НАДФ+ + 18АДФ + 18Фн
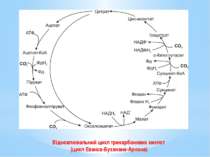
Цикл Арнона (відновлювальний ЦТК) - це модифікований цикл Кребса, який функціонує у зворотному, відновлювальному напрямку. Розрізняють повний і короткий цикли. У результаті 1 оберту повного циклу фіксуються 4 молекули СО2 і синтезується щавлево-оцтова кислота (ЩОК). Оскільки ЩОК сама по собі є проміжним продуктом циклу, то після 1 повного оберту одна молекула ЩОК регенерується, а друга синтезується з 4 фіксованих і відновлених молекул СО2.
У повному відновлювальному ЦТК відбуваються 4 реакції фіксації й відновлення СО2: Ацетил-КоА + СО2 + Фередоксин відн → →Піруват + КоА + Фередоксин окис; Сукциніл-КоА + СО2 + Фередоксин відн → → α-Кетоглутарат + КоА + Фередоксин окис; α-Кетоглутарат + СО2 + НАДФН2 ↔ Ізоцитрат+ + НАДФ+ ; Фосфоенолпіруват + СО2 → ЩОК + Фн.
Реакції (2), (3) відбуваються як у звичайному циклі Кребса, так і у відновлювальному ЦТК. Реакції (1), (4) зустрічаються лише у відновлювальному ЦТК. Сполуки, що вступають у реакції (1), (2), відновлюються фередоксинами, а не НАДФН2. Асиміляція СО2 супроводжується затратою енергії.
Оберт короткого циклу приводить до регенерації ЩОК і синтезу ацетату з СО2. Саме короткий цикл Арнона, який утворює ацетил-КоА з 2СО2, є оберненим до циклу Кребса. Відкриття циклу Еванса-Буханана-Арнона підтвердило еволюційний зв’язок між гетеротрофними та автотрофними мікроорганізмами.
Відновлювальний шлях ацетил-КоА (відновлювальний шлях Люнгдаля-Вуда): THF – тетрагідрофолієва кислота.
Відновлювальний шлях ацетил-КоА (відновлювальний шлях Люнгдаля-Вуда) присутній у: автотрофних сульфатредукторів, гомоацетогенів, метаногенів. На відміну від решти шляхів асиміляції СО2, він не є циклічним. Вуглекислий газ відновлюється молекулярним воднем згідно рівняння: 4Н2 + 2СО2 = Ацетат +2Н2О.
Одна молекула СО2 зв’язується спеціальним кофактором – тетрагідрофолієвою кислотою (THF) і відновлюється до метильної групи. Друга молекула СО2 відновлюється до карбонільної (С=О) групи за допомогою ферменту карбонмонооксиддегідрогенази. Метильна і карбонільна групи об’єднуються в ацетил-КоА, який використовується у подальших процесах біосинтезу.
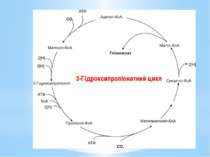
У результаті повного оберту цього циклу фіксується 2СО2 та синтезується гліоксилат (СНОСООН). Одна молекула СО2 акцептується ацетил-КоА з утворенням малоніл-КоА, а інша - з’єднавшись з пропіоніл-КоА, утворює метилмалоніл-КоА. Кінцевий проміжний продукт циклу – маліл-КоА розщеплюється на ацетил-КоА та гліоксилат. Ацетил-КоА знову фіксує СО2 на наступному оберті, а гліоксилат використовується для біосинтезу. Процес можна описати таким рівнянням: 2 НСО3- + 2НАДФН2 + 3Н+ + 3АТФ → СНО-СОО- + +2НАДФ+ + 3АДФ + 3Фн Донори електронів і природа багатьох ферментів цього циклу наразі не вивчені.
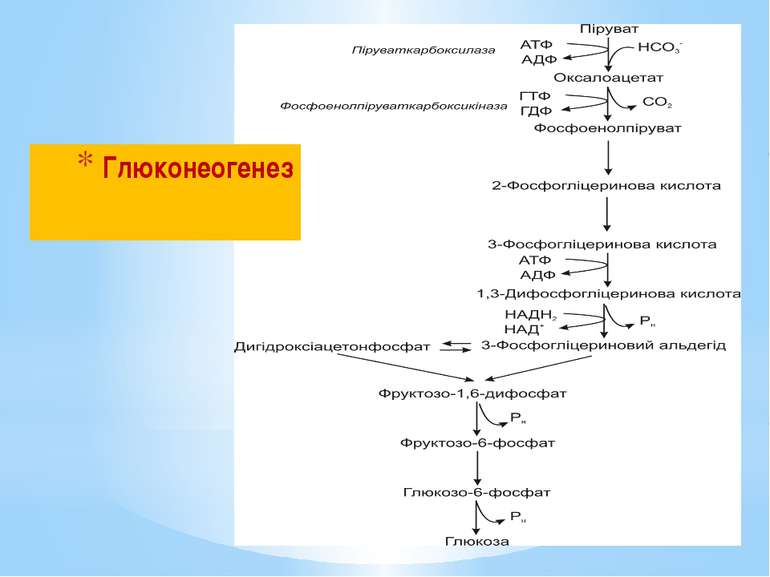
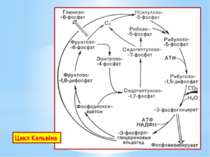
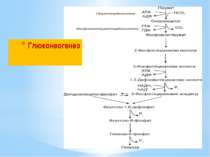
Глюконеогенез – це процес синтезу глюкози з пірувату. Він подібний до гліколізу, але відбувається у зворотному (відновлювальному) напрямку. При гліколізі, окиснення глюкози супроводжується синтезом 2АТФ: Глюкоза + 2НАД+ + 2АДФ + 2Фн → 2 Піруват + +2НАДН2 + 2АТФ + 2Н2О При глюконеогенезі на синтез глюкози витрачається 6АТФ: 2 Піруват + 2НАДН2 + 4АТФ + 2ГТФ + 6Н2О → → Глюкоза + 4АДФ + 2ГДФ + 6Фн + 2НАД+ + 2Н+
При гліколізі фосфоенолпіруват перетворюється на піруват з виділенням АТФ за 1 реакцію під дією піруваткінази. При глюконеогенезі піруват перетворюється на фосфоенолпіруват за 2 реакції, через проміжний продукт ЩОК з використанням АТФ та ГТФ під дією двох ферментів: піруваткарбоксилази та фосфоенолпіруваткарбоксикінази.
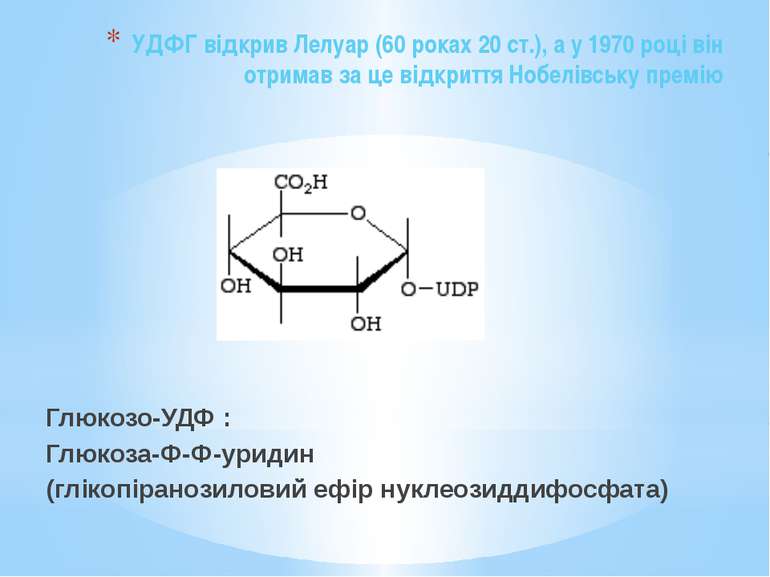
Етапи синтезу поліцукридів: Етап І Глюкозо-6-фосфат перетворюється на глюкозо-1-фосфат: Глюкозо-6-фосфат Глюкозо-1-фосфат Етап ІІ Фосфорильований цукор активується нуклеотидтрифосфатом Глюкозо-1-фосфат взаємодіє з уридинтрифосфатом (УТФ): Глюкозо-1-фосфат + УТФ Глюкозо-УДФ + ФФн Утворюється уридиндифосфоглюкоза і пірофосфат неорганічний.
УДФГ відкрив Лелуар (60 роках 20 ст.), а у 1970 році він отримав за це відкриття Нобелівську премію Глюкозо-УДФ : Глюкоза-Ф-Ф-уридин (глікопіранозиловий ефір нуклеозиддифосфата)
Етап ІІІ одна одиниця активованого цукру додається до іншої і т.д. УДФГ - ключовий метаболіт у анаболізмі поліцукридів. Приєднанням УДФ активуються також мономери пептидоглікану N-ацетилглюкозамін та N-ацетилмурамова кислота: UDP-NAG (уридиндифосфат-N- ацетилмурамова кислота) UDP-NAM (уридиндифосфат- N- ацетилглюкозамін)
Відновлення молекулярного азоту в промислових умовах здійснюється за температури 5000С і тиску 30 МПа. В Україні мінеральні азотні добрива з молекулярного азоту виробляють: Виробниче об’єднання “Азот” (Черкаси, Рівне, Северодонецьк, Дніпродзержинськ); Одеський припортовий завод
Азотфіксація – це використання атмосферного газоподібного молекулярного азоту N2 як джерела азоту для біосинтезу. В результаті азотфіксації молекулярний азот відновлюється до амонію, який включається у біосинтез амінокислот. Цей процес характерний лише для бактерій (вільноіснуючих та симбіотичних) і деяких археїв, які містять специфічний складний фермент – нітрогеназу (нітрогеназний комплекс).
Бактерії здійснюють азотфіксацію за звичайних умов, але витрачають на це велику кількість енергії. N2 + 8е- + 8Н+ + 16АТФ = 2NН3 + Н2 + 16АДФ + 16Фн для відновлення 1 молекули азоту бактерії необхідно 16 молекул АТФ і 8 відновлених еквівалентів.
Вільноіснуючіаеробніазотфіксатори Органотрофи Фототрофи Літотрофи Azotobacterspp. Klebsiella Beijerinckia Bacilluspolymyxa Mycobacteriumflavum Azospirillumlipoferum Citrobacterfreundii Methylotrophus(більшість) Cyanobacteria(більшість) Alcaligenes Thiobacillus(деякі види)
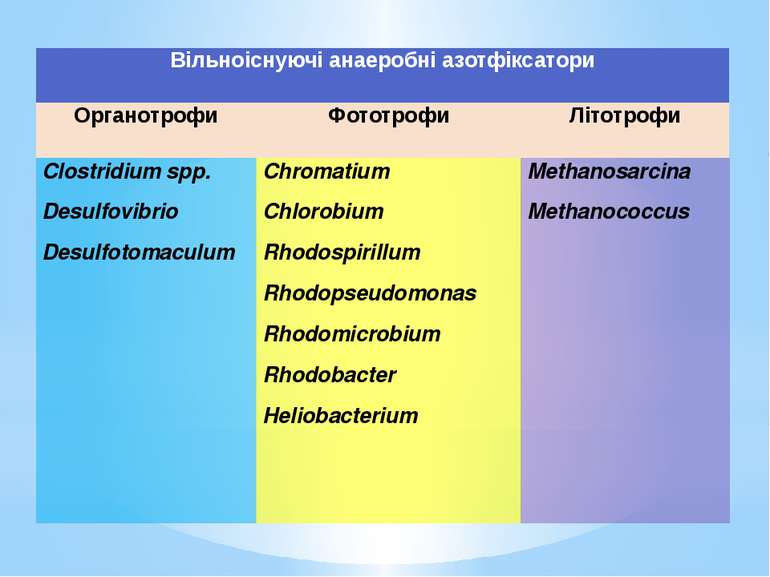
Вільноіснуючіанаеробніазотфіксатори Органотрофи Фототрофи Літотрофи Clostridium spp. Desulfovibrio Desulfotomaculum Chromatium Chlorobium Rhodospirillum Rhodopseudomonas Rhodomicrobium Rhodobacter Heliobacterium Methanosarcina Methanococcus
Симбіотичніазотфіксатори з бобовими рослинами(соя, горох, конюшина) утворюють асоціації бактерії родівRhizobium,Bradyrhizobium знебобовимирослинами утворюють асоціації актиноміцети родуFrankia
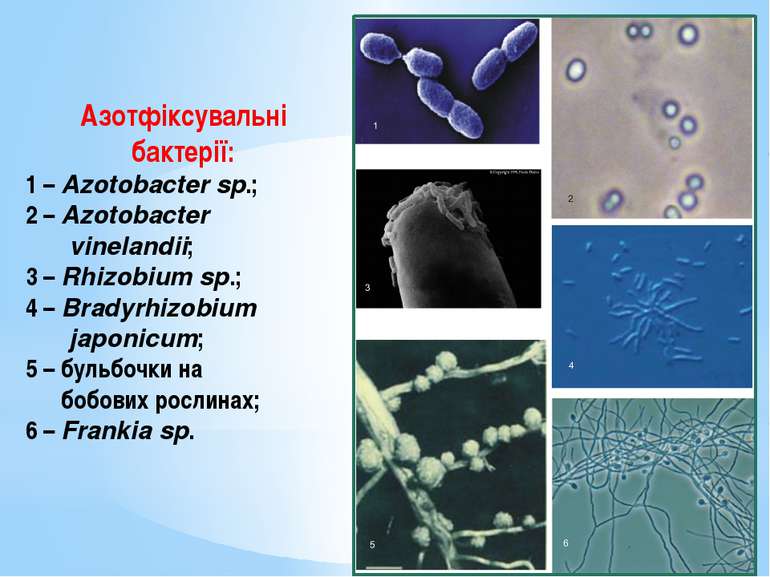
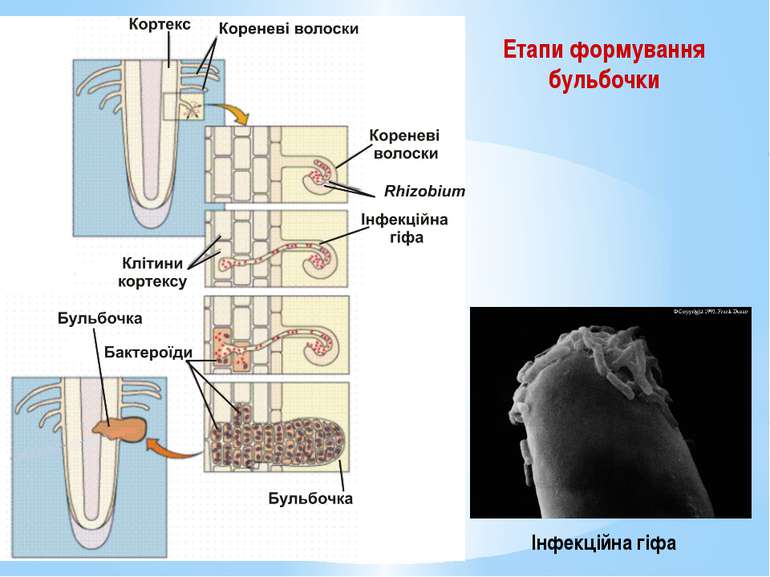
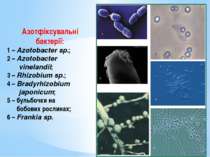
Азотфіксувальні бактерії: 1 – Azotobacter sp.; 2 – Azotobacter vinelandii; 3 – Rhizobium sp.; 4 – Bradyrhizobium japonicum; 5 – бульбочки на бобових рослинах; 6 – Frankia sp.
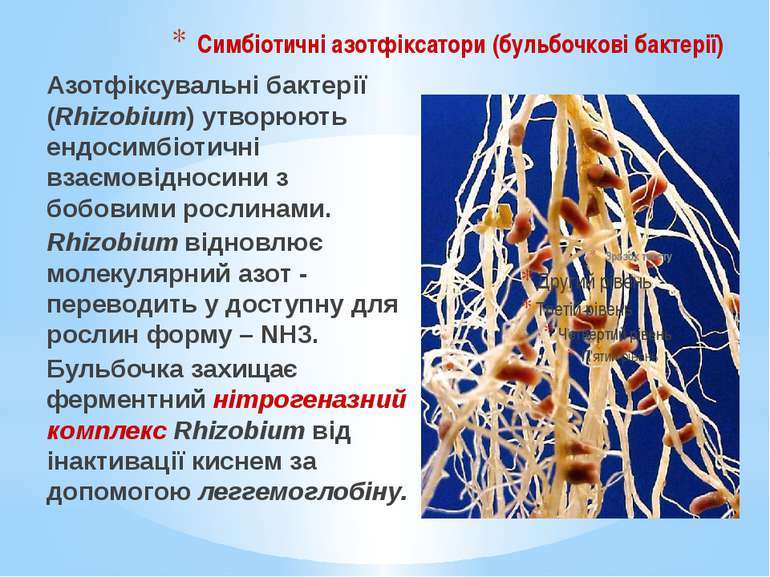
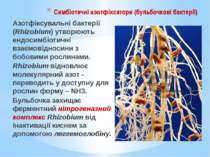
Симбіотичні азотфіксатори (бульбочкові бактерії) Азотфіксувальні бактерії (Rhizobium) утворюють ендосимбіотичні взаємовідносини з бобовими рослинами. Rhizobium відновлює молекулярний азот - переводить у доступну для рослин форму – NH3. Бульбочка захищає ферментний нітрогеназний комплекс Rhizobium від інактивації киснем за допомогою леггемоглобіну.
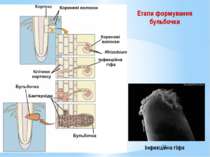
Етапи формування бульбочки У кореневому волоску бактерії утворюють інфекційну гіфу – слизову масу з бактеріальних клітин, що інтенсивно розмножуються. Інфекційна гіфа проникає у паренхіму рослини, а згодом у тетраплоїдні клітини рослини. Частина бактерій починає розмножуватися у цитоплазмі тетраплоїдних клітин, стимулюючи поділ сусідніх клітин. Так формується тканинна бульбочка.
Бактеріальні клітини з часом перетворюються на бактероїди. Бактероїди – це клітини, що втратили здатність до поділу, містять більше глікогену, поліфосфатів, полі-β-оксимасляної кислоти, але менше ДНК, фіксують молекулярний азот. На другий день бульбочка стає червоною завдяки синтезу леггемоглобіну. Леггемоглобін зв’язує кисень. На четвертий день бактероїд починає фіксувати молекулярний азот.
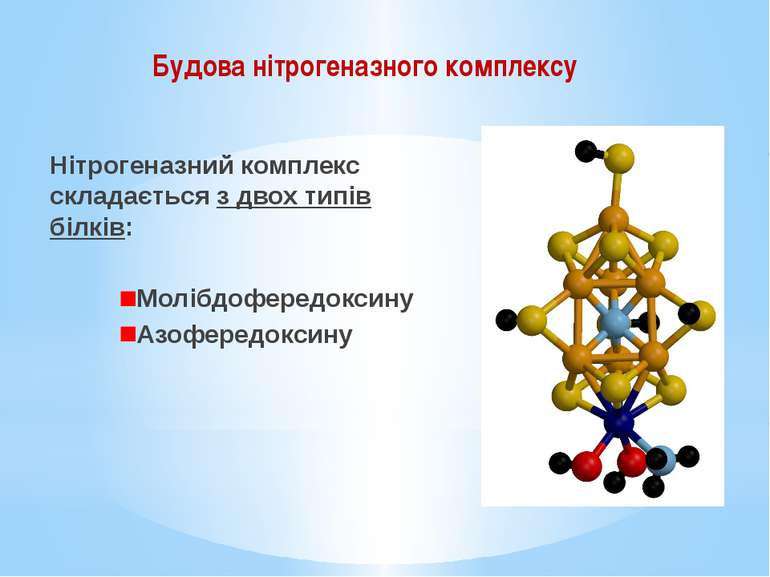
Нітрогеназний комплекс складається з двох типів білків: Молібдофередоксину Азофередоксину Будова нітрогеназного комплексу
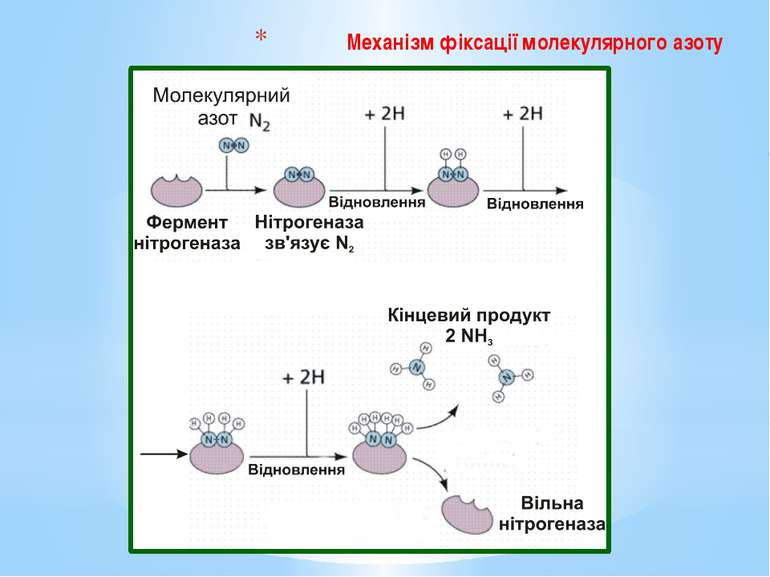
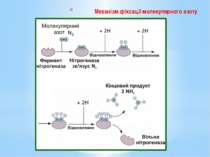
Для відновлення 1 молекули азоту бактерії необхідно 16 молекул АТФ і 8 відновлених еквівалентів. За рахунок енергії, що виділяється під час гідролізу АТФ, істотно знижується ОВП нітрогеназного комплексу (з -290 до -400 мВ), тобто нітрогеназа набуває властивостей «супервідновника». Відновлені еквіваленти використовуються для постадійного відновлення N2 до 2NH3. Оскільки паралельно з утворенням амонійного азоту відбувається виділення молекулярного водню, процес потребує 8 електронів: N2 + 8е- + 8Н+ + 16АТФ = 2NН3 + Н2 + 16АДФ + 16Фн
Джерелами електронів можуть бути: органічні сполуки у хемоорганотрофних азотфіксаторів (Azotobacter, Klebsiella, Clostridium), неорганічні сполуки у хемолітотрофів (Alcaligenes, Methanosarcina, Methanococcus), а також екзогенні донори електронів у фотосинтетиків (Cyanobacteria, Chromatium, Chlorobium, Rhodospirillum, Heliobacter). Електрони надходять до нітрогеназного комплексу через низькопотенційні переносники: (фередоксини, флаводоксини).
(Позначення: AzoFd – азофередоксин; MoFe – молібдофередоксин) Схема азотфіксації за Штифелем
Етапи фіксування молекулярного азоту З відновленого фередоксину електрони надходять на азофередоксин (Fe-білок) і відновлюють його; Азофередоксин передає електрони на молібден молібдофередоксину, сам при цьому окиснюється, а молібден молібдофередоксину (MoFe-білок) відновлюється з Мо(VI) до Mo(IV). Паралельно з цим за рахунок гідролізу АТФ відбувається пониження ОВП нітрогеназного комплексу з -290 до -400 мВ. Молібдофередоксин стає супервідновленим.
Атом заліза у молекулі молібдофередоксину сполучається з N2 й утворюється комплекс N≡N-Fe (нітрид); У молекулі молібдофередоксину (MoFe-білок) відбувається поетапне відновлення N2 за рахунок окиснення Mo(IV) до Мо(VI) через такі емпіричні проміжні продукти: N≡N + 4e- → HN=NH (диімід) + Н2; HN=NH + 2е- → H2N-NH2 (гідразин); H2N-NH2 + 2е- → 2NH3 (аміак).
5. Молекулярний водень, що утворюється, активує молібдофередоксин перед відновленням молекулярного азоту.
Н2 в атмосферу практично не виділяється, а розкладається гідрогеназою на протони й електрони. Електрони подаються на дихальний ланцюг. В результаті клітина отримує додаткову енергію, а молекулярний кисень, що її оточує, швидше відновлюється. Це захищає нітрогеназний комплекс від інгібування киснем.
Для активної азотфіксації бактерія має підтримувати азофередоксин у супервідновленому стані. Молекулярний кисень, ОВП якого становить +810 мВ, незворотно окиснює нітрогеназний комплекс. Тому, у аеробних азотфіксаторів існують спеціальні механізми захисту нітрогенази від кисню.
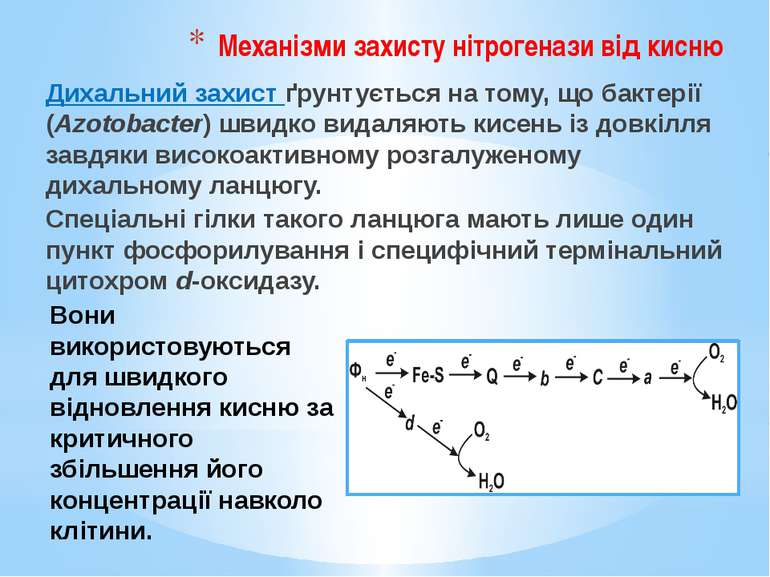
Механізми захисту нітрогенази від кисню Дихальний захист ґрунтується на тому, що бактерії (Azotobacter) швидко видаляють кисень із довкілля завдяки високоактивному розгалуженому дихальному ланцюгу. Спеціальні гілки такого ланцюга мають лише один пункт фосфорилування і специфічний термінальний цитохром d-оксидазу. Вони використовуються для швидкого відновлення кисню за критичного збільшення його концентрації навколо клітини.
Конформаційний захист нітрогенази забезпечується особливим захисним конформаційним білком. У разі загрози інактивації киснем він сполучається з нітрогеназою. При цьому нітрогеназа тимчасово втрачає свою активність, але отримує стійкість до кисню. Після зниження концентрації кисню нітрогеназа повертається в активний стан.
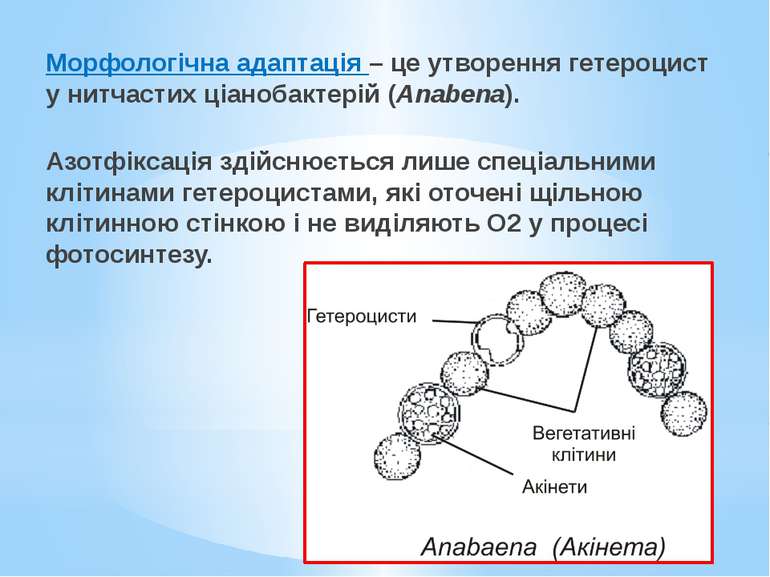
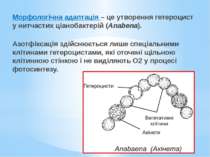
Морфологічна адаптація – це утворення гетероцист у нитчастих ціанобактерій (Anabena). Азотфіксація здійснюється лише спеціальними клітинами гетероцистами, які оточені щільною клітинною стінкою і не виділяють О2 у процесі фотосинтезу.
Симбіотичний захист характерний для симбіотичних азотфіксуючих бактерій (Rhizobium). Вони ідукують синтез у клітинах рослини-симбіонта білка леггемоглобіну, який зв’язує кисень, знижуючи його парціальний тиск. Негативний аеротаксис дає змогу рухливим азотфіксаторам уникати середовища з підвищеною концентрацією кисню.
Схожі презентації
Категорії